2017-2018学年福建省闽侯第二中学五校教学联合体高二上学期期末考试化学试题 解析版
福建省闽侯第二中学五校教学联合体2017-2018学年高二上学期期末考试化学试题
1. 反应C(s)+H2O(g)CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
A. 体积不变,充入氮气使压强增大 B. 体积缩小一半
C. 压强不变,充入氮气使体积增大 D. 升高温度
【答案】A
【解析】
【分析】
反应中有固体参加,改变固体的量对反应速率没有影响,如气体的浓度不变,则反应速率不变,而浓度、压强、温度以及催化剂影响反应速率。
【详解】A. 体积不变,充入氮气使压强增大,与反应有关的物质浓度不变,速率不变,故A正确;B. 将容器的体积缩小一半,气体物质浓度增大,反应速率增大,故B错误;C、保持压强不变,充入N2使容器体积变大,参加反应的气体的分压减小,反应速率减小,故C错误;D、升温。反应速率增大,故D错误。故选A。
【点睛】本题考查反应速率的影响因素,注意把握固体的特点,易错点为A、C,注意惰性气体的影响。
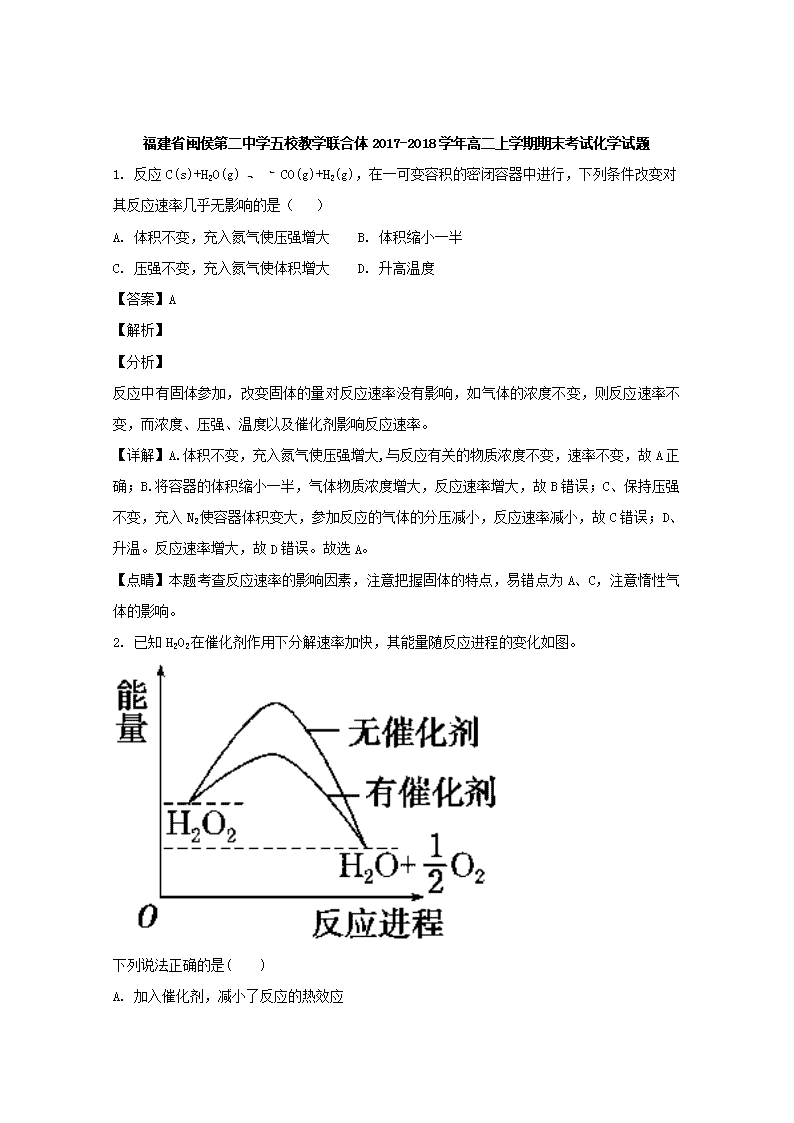
2. 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图。
下列说法正确的是( )
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0
D. 反应物的总能量高于生成物的总能量
【答案】D
【解析】
试题分析:A.加入催化剂,减小了反应的活化能,使反应在较低的温度下发生,但是反应的热效应不变,A项错误;B.加入催化剂,可提高H2O2分解的反应速率,该反应不是可逆反应,而且催化剂不能使平衡发生移动,因此不存在平衡转化率的提高与否,B项错误;C.在书写热化学方程式式时,要注明物质的存在状态,C项错误;D.根据图示可知反应物的总能量高于生成物的总能量,该反应是放热反应,D项正确;答案选D。
【考点定位】考查化学反应的热效应,催化剂对化学反应的影响等知识。
【名师点睛】本题考查化学反应的热效应,催化剂对化学反应的影响等知识。化学图像在化学反应原理的表示中有直观、形象、具体的特点,化学反应的过程就是原子重新组合的过程,在这个过程中断裂旧键吸收能量,形成新的化学键放出热量。反应物的能量要高于生成物的能量就是放热反应,生成物的能量若高于反应物的能量,反应是吸热反应。看清反应物、生成物的能量的高低,掌握反应的热效应的含义及反应原理,是本题的关键。
3. 用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是( )
A. HCl B. NaOH C. Na2SO4 D. NaCl
【答案】C
【解析】
试题分析:A、电解HCl溶液中氢离子、氯离子放电,氢离子浓度减小,pH值变大,A错误;B、电解NaOH溶液中氢离子、氢氧根离子放电,相当于电解水,NaOH浓度变大,pH值变大,B错误;C、电解硫酸钠溶液中氢离子、氢氧根离子放电,相当于电解水,硫酸钠浓度变大,pH值不变,C正确;D、电解NaCl溶液中氢离子、氯离子放电,氢离子浓度减小,pH值变大,D错误。答案选C。
考点:考查电解池原理的判断
4. 甲醇脱氢可制取甲醛:CH3OH(g) HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
A. Q>0
B. 600 K时,Y点甲醇的v(正)
c(OH-)>c(CH3COO-)>c(H+) ② c(Na+) >c(OH-)= c(CH3COO-)>c(H+)
③ c(Na+) >c(CH3COO-)> c(OH-)>c(H+) ④ c(Na+) = c(CH3COO-)> c(OH-)=c(H+)
⑤ c(CH3COO-)> c(Na+) >c(H+)>c(OH-), 结合离子关系填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是__________,离子浓度的大小顺序符合上述序号______;若溶液中性,离子浓度的大小顺序符合上述序号________;
(2)若溶质为CH3COONa和 CH3COOH,则离子的关系符合上述序号_________。
【答案】 (1). CH3COONa (2). ③ (3). ④ (4). ③④⑤
【解析】
(1).若只溶解了一种溶质,则该溶质只能是CH3COONa,该溶液中离子浓度的大小顺序为:c(Na+) >c(CH3COO-)> c(OH-)>c(H+),符合上述序号③;根据电荷守恒c(Na+) +c(H+)= c(CH3COO-)+c(OH-),若溶液呈中性,则c(H+)= c(OH-),所以c(Na+)= c(CH3COO-),溶液中c(Na+)>c(H+),则离子浓度的大小顺序为: c(Na+) = c(CH3COO-)> c(OH-)=c(H+),符合上述序号④,故答案为:CH3COONa;③ ;④ ;
(2).若溶质为CH3COONa和 CH3COOH,因不知道CH3COONa和 CH3COOH的物质的量的相对大小,则溶液可能呈酸性、中性或碱性,若溶液呈酸性,则离子浓度的大小顺序为:c(CH3COO-)> c(Na+) >c(H+)>c(OH-),符合序号⑤;若溶液呈中性,则离子浓度的大小顺序为: c(Na+) = c(CH3COO-)> c(OH-)=c(H+),符合序号④;若溶液呈碱性,离子浓度的大小顺序为:c(Na+) >c(CH3COO-)> c(OH-)>c(H+),符合序号③,故答案为:③④⑤。
20. 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10 s时,用Z表示的反应速率为_______,X的物质量浓度减少了________,Y的转化率为________。
(2)该反应的化学方程式为_______________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示。则下列说法符合该图象的是________。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
【答案】 (1). 0.079 mol·L-1·s-1 (2). 0.395 mol·L-1 (3). 79.0% (4). X(g)+Y(g)2Z(g) (5). C、D
【解析】
本题考查化学反应速率的计算以及影响化学平衡移动的因素,(1)根据化学反应速率数学表达式,v(Z)=1.58/(2×10)mol/(L·s)=0.079mol/(L·s);X减少的浓度为(1.2-0.41)/2mol·L-1=0.395mol·L-1,Y的转化率为(1-0.21)/1×100%=79.0%;(2)同一容器中,化学反应速率之比等于化学计量数之比等于物质的量变化之比,因此X、Y、Z的系数之比为:(1.2-0.41):(1-0.21):1.58=1:1:2,因此化学反应方程式为:X(g)+Y(g)2Z(g);(3)根据图像,t1时刻化学反应速率增大,但化学平衡不移动,A、增大X浓度,平衡向正反应方向移动,故A错误;B、升高温度,化学平衡必然改变,故B错误;C、缩小容器的体积,相当于增大压强,因为反应前后气体系数之和相等,因此增大压强,平衡不移动,但正逆反应速率增大,故C正确;D、使用催化剂加快反应速率,但平衡不移动,故D正确。
21. 用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称量好的2.0 g烧碱样品配成100mL待测液,需要的主要玻璃仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______、_________ 。
(2)用碱式滴定管量取10.00mL待测液,置于锥形瓶中,同时滴加1-2滴指示剂。化学上常选用的指示剂有酚酞或____________。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视________________,直到滴定到终点,若选择酚酞作为指示剂,判断滴定终点的标志是___________________________。
(4)根据下列数据,测得c(NaOH)=________。烧碱的纯度=____________。
滴定次数
待测液体积(mL)
标准盐酸体积(mL)
滴定前读数(mL)
滴定后读数(mL)
第一次
10.00
0.50
20.40
第二次
10.00
4.00
24.10
第三次
10.00
1.00
24.10
(5)以标准的盐酸溶液滴定未知浓度的氢氧化钠溶液,下列操作引起待测液浓度偏小的是_______________(填序号)。
①读数:滴定前平视,滴定后俯视
②未用待测液润洗碱式滴定管
③用待测液润洗锥形瓶
④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
【答案】 (1). 00mL容量瓶 (2). 胶头滴管 (3). 甲基橙 (4). 锥形瓶中溶液颜色的变化 (5). 当滴入最后一滴时,溶液颜色恰好由红色变为无色,且半分钟内不复原,则达到滴定终点 (6). 0.4020 mol·L-1 (7). 80.4% (8). ①②
【解析】
(1).将准确称量好的2.0 g烧碱样品配成100mL待测液,需要的主要玻璃仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有100mL容量瓶和胶头滴管,故答案为:100mL容量瓶;胶头滴管;
(2).因石蕊的变色范围为5—8,变色范围较大,不适宜做指示剂,因此化学上常选用的指示剂有酚酞或甲基橙,故答案为:甲基橙;
(3).在酸碱中和滴定实验中,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定达到终点;若选择酚酞作为指示剂,判断滴定终点的标志是: 当滴入最后一滴时,溶液颜色恰好由红色变为无色,且半分钟内不复原,则达到滴定终点,故答案为:锥形瓶中溶液颜色的变化;当滴入最后一滴时,溶液颜色恰好由红色变为无色,且半分钟内不复原,则达到滴定终点;
(4).三次滴定分别消耗盐酸标准液的体积为:19.90mL、20.10mL、23.10mL,因第三次滴定的数据偏差较大,舍去,则消耗盐酸标准液的平均体积为:=20.00mL,则c(NaOH)==0.4020 mol·L-1,n(NaOH)=0.4020 mol·L-1×0.100L=4.020mol,则烧碱的纯度==80.4%,故答案为:0.4020 mol·L-1;80.4%;
(5). ①读数:滴定前平视,滴定后俯视,会使标准液的体积偏小,测定的待测液浓度偏小,故①符合;②未用待测液润洗碱式滴定管,会使待测液被稀释,造成标准液的体积偏小,测定的待测液浓度偏小,故②符合;③用待测液润洗锥形瓶,会使消耗的标准液偏多,测定的待测液浓度偏大,③不符合;④不小心将标准液滴在锥形瓶外面,会使消耗的标准液偏多,测定的待测液浓度偏大,④不符合;⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁,对测定结果无影响,⑤不符合;故答案为:①②。
点睛:本题主要考查酸碱中和滴定实验的相关操作和误差分析,易错点是滴定结果的误差分析,在判断滴定结果是偏大还是偏小时,务必要先列出c(待测液)= 的公式,其中c(标准液)和V(待测液)是已知的,则根据错误的操作,判断对V(标准液)的影响,若V(标准液)偏大,则测定结果偏大,若V(标准液)偏小,则测定结果偏小,若对V(标准液)无影响,则对测定结果也无影响。