- 2021-08-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年四川省泸州市泸县第二中学高一上学期期末模拟考试化学试题
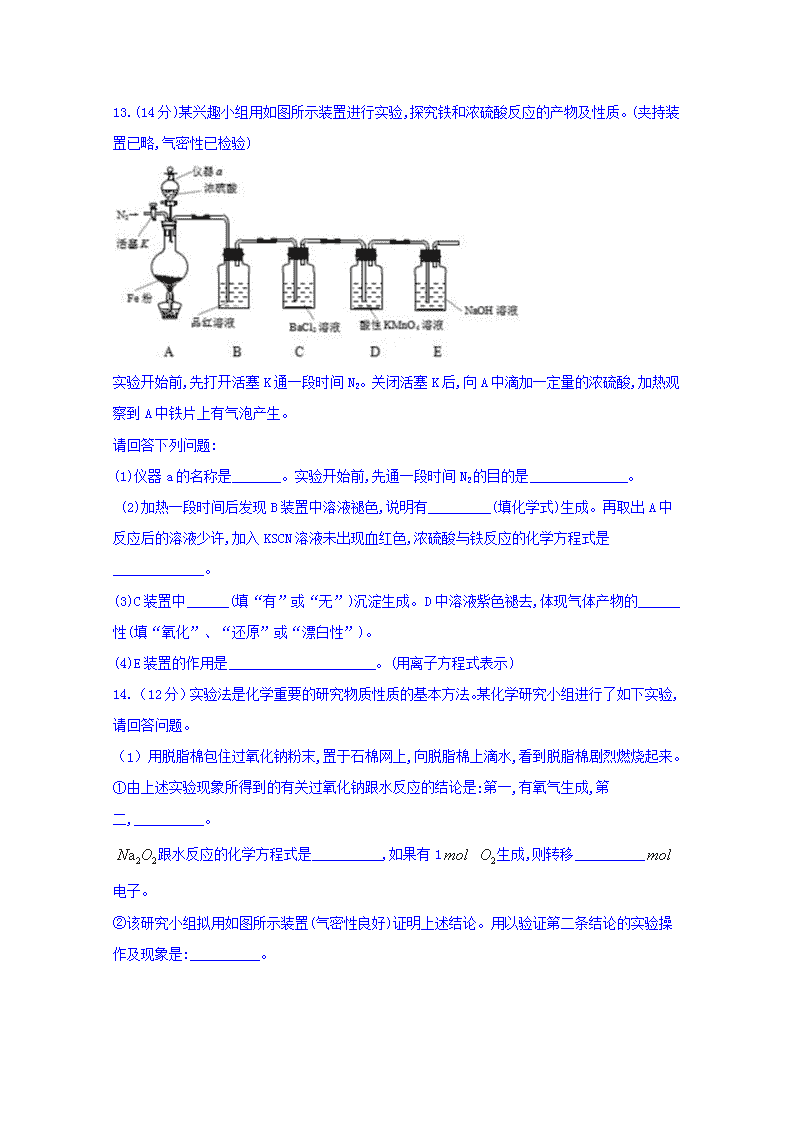
2019年秋四川省泸县第二中学高一期末模拟考试 理综化学试题 考试时间:物理化学生物共150分钟 每科100分 共300分 可能用到的相对原子质量: H-1 C-12 O-16 N-14 S-32 Fe-56 Na-23 S32 C135.5 Fe56 Ba137 第I卷 选择题(48分) 一、选择题(每小题题只有一个答案符合题意,4分每题,共48分) 1.下列物质存放方法错误的是 A. 铝片长期放置在不密封的纸盒里 B. 漂白粉长期放置在烧杯中 C. FeSO4溶液存放在加有少量铁粉的试剂瓶中 D. 金属钠存放于煤油中 2.下列仪器,能加热但应该垫石棉网使用的是 A.试管 B.容量瓶 C.坩埚 D.锥形瓶 3.下列有关工业生产的叙述中正确的是 A.电解氯化钠溶液可得到金属钠 B.光照氯气和氢气的混合物生产盐酸 C.从铝土矿到铝单质过程中未涉及氧化还原反应 D.工业接触法制硫酸的主要设备有沸腾炉、接触室、吸收塔 4.下列有关物质的性质与用途具有对应关系的是 A.MgO具有高熔点,可用于制耐火材料 B.NaHCO3受热易分解,可用于治疗胃酸过多 C.金属铜具有金属光泽,可用作导电材料 D.浓硫酸具有脱水性,可用作干燥剂 5.下列实验操作错误的是 A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 C.蒸发结晶时应将溶液蒸干 D.称量时,称量物置于托盘天平的左盘,砝码放在托盘天平的右盘中 6.下面是某同学在实验报告中的记录,其中正确的记录是 A.用25mL量筒量取18.26mL盐酸 B.用托盘天平称量9.75g硫酸铜 C.用500mL的容量瓶配制480mL溶液 D.Al (OH)3胶体带正电荷,可以产生电泳现象 7.下列关于浊液、胶体和溶液的说法中不正确的是 A.浊液不稳定,久置易分层或沉淀 B.氢氧化铁胶体是纯净物 C.浊液、胶体、溶液的本质区别在于它们的分散质粒子直径大小不同 D.胶体可产生丁达尔效应而溶液不可以 8.下列离子能大量共存的是 A.无色酚酞试液呈红色的溶液中:Na+ 、K+、、 B.无色透明的溶液中:Cu2+、K+、、 C.含有大量Ba(NO3)2的溶液中:Mg2+、、、Cl- D.紫色石蕊试液呈红色的溶液中:Ca2+、K+、、 9.下列反应中,离子方程式书写正确的是 A.Fe和盐酸反应:2Fe + 6H+ =2Fe3+ + 3H2↑ B.硫酸与氢氧化钡溶液反应:H++ + Ba2+ + OH﹣=BaSO4↓ + H2O C.醋酸和碳酸钠溶液反应:2H++=H2O+CO2↑ D.石灰石和盐酸反应:CaCO3 + 2H+ =Ca2+ + CO2↑ + H2O 10.含Na2SO4、MgSO4和NaNO3的1L混合溶液,已知其中c(Mg2+)=0.4mol·L-1,c()=0.7mol·L-1,c()=0.2mol·L-1,则此溶液中c(Na+)为 A.0.2mol·L-1 B.0.4mol·L-1 C.0.6mol·L-1 D.0.8mol·L-1 11.工业制备高铁酸钾的离子方程式为:2Fe(OH)3+3ClO-+4OH-2+3Cl-+5H2O。关于该反应的说法正确的是 A.中铁显+3价 B.ClO-发生还原反应 C.Fe(OH)3是氧化剂 D.ClO-失去电子 12.下列有关实验现象与物质性质对应关系的说法中,错误的是 A. Na2CO3溶液遇酚酞变红,说明Na2CO3溶液呈碱性 B. Cl2使湿润的有色布条褪色,说明Cl2具有漂白性 C. NO遇空气变为红棕色,说明NO具有还原性 D. 新制的Fe(OH)2遇氧气变为红褐色,说明Fe(OH)2具有还原性 第II卷 非选择题(52分) 13.(14分)某兴趣小组用如图所示装置进行实验,探究铁和浓硫酸反应的产物及性质。(夹持装置已略,气密性已检验) 实验开始前,先打开活塞K通一段时间N2。关闭活塞K后,向A中滴加一定量的浓硫酸,加热观察到A中铁片上有气泡产生。 请回答下列问题: (1)仪器a的名称是_______。实验开始前,先通一段时间N2的目的是______________。 (2)加热一段时间后发现B装置中溶液褪色,说明有_________(填化学式)生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,浓硫酸与铁反应的化学方程式是_____________。 (3)C装置中______(填“有”或“无”)沉淀生成。D中溶液紫色褪去,体现气体产物的______性(填“氧化”、“还原”或“漂白性”)。 (4)E装置的作用是_____________________。(用离子方程式表示) 14.(12分)实验法是化学重要的研究物质性质的基本方法。某化学研究小组进行了如下实验,请回答问题。 (1)用脱脂棉包住过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,看到脱脂棉剧烈燃烧起来。 ①由上述实验现象所得到的有关过氧化钠跟水反应的结论是:第一,有氧气生成,第二,__________。 跟水反应的化学方程式是__________,如果有1 生成,则转移__________电子。 ②该研究小组拟用如图所示装置(气密性良好)证明上述结论。用以验证第二条结论的实验操作及现象是:__________。 (2)①将光亮的无绣铁钉放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化, 其原因是__________。 ②另称取铁钉6.0放入15.0浓硫酸中,加热,充分应后得到溶液并收集到气体。甲同学认为中除外还可能含有。若要确认其中有,应选用的试剂编号为__________。 a. 溶液和氯水 b.铁粉和溶液 c.浓氨水 d.酸性溶液 乙同学把气体通入足量氯水中,写出发生反应的离子方程式为:__________。 15.(14分)元素化合物知识是高中化学的重点内容,请你用学习到的元素化合物知识回答下列问题: (1)浓硝酸见光易分解,实验室保存硝酸的方法是___________________________________。 (2)铜与稀HNO3反应产生NO的离子方程式为________________________,参与反应的硝酸中,表现酸性与氧化性的硝酸物质的量之比为________。铜粉放入稀硫酸溶液中,无明显变化,但加入某盐一段时间后,发现铜粉质量减少,则该盐不可能是______。(填序号) A.K2SO4 B.FeCl3 C.KNO3 D.Cu(NO3)2 (3)小苏打和Al(OH)3均可以治疗胃酸过多,小苏打治疗胃酸时发生的离子方程式为: ;Al(OH)3具有两性,也能溶解在NaOH溶液中,则反应的离子方程式为 ;AlCl3溶液与过量氨水反应制备Al(OH)3的离子方程式为 。 16.(12分)根据下流程图回答下列问题: (1)过程①是为了除去粗盐中的、Ca2+、Mg2+、Fe3+等杂质,若要除去,则需要加入的试剂为 ;若所加的该试剂过量,则可以被后加入的 除去。 (2)过程②能否一步实现转化? (填“能”或“否”),Mg(OH)2与盐酸反应可以得到MgCl2溶液,则该反应的离子方程式为 。 (3)过程④反应的离子方程式为 。 (4)若用CCl4萃取溴水中的Br2,分液时CCl4层应从分液漏斗的 放出。 2019年秋四川省泸县第二中学高一期末模拟考试 理综化学试题参考答案 一、单选题 1-5:BDDAC 6-10:CBADD 11-12:BB 13.答案:(1)分液漏斗;排除装置中的空气 (2)SO2;Fe+2H2SO4(浓)FeSO4+SO2↑+2H2O (3)无;还原 (4) 14.(1)①放出大量的热; ;2 ②将口插入到盛水的烧杯中,有气泡产生 (2)①铁表面被钝化; ②d; 15.(1)保存时应保存在棕色试剂瓶中,并置于阴凉处 (2)3Cu+8H++2=3Cu2++2NO↑+4H2O; 3:1; A (3)+H+=H2O+CO2↑; Al(OH)3+OH-=[Al(OH)4]-; Al3++3NH3·H2O=Al(OH)3↓+3 16.(1)BaCl2溶液; Na2CO3溶液 (2)否,Mg(OH)2+2H+=Mg2++2H2O (3)Br2+SO2+2H2O=+2Br-+4H+ (4)下口查看更多