- 2021-08-06 发布 |
- 37.5 KB |
- 34页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新教材高中化学第二章元素与物质的世界第二节第1课时电解质及其电离课件鲁科版必修1
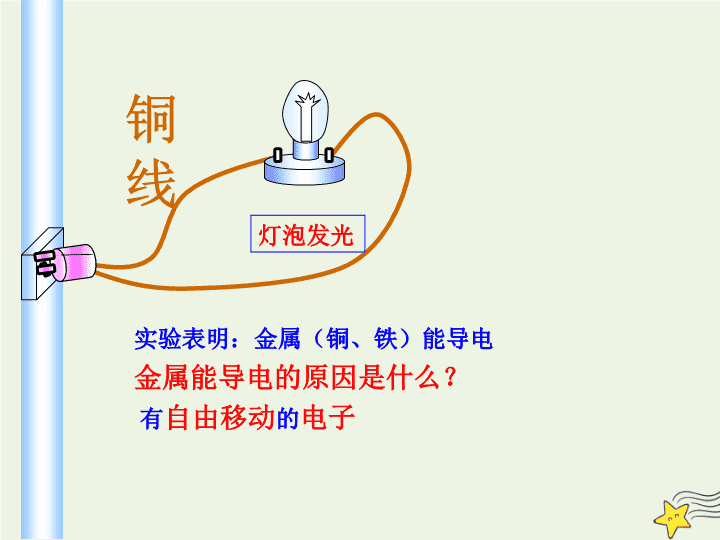
第 2 节 电解质 学习目标 1. 了解电离、电解质、离子反应和离子方程式的含义。 2. 认识离子交换引起的离子反应发生的条件,初步学会一些简单离子反应的离子方程式的书写。 第 1 课时 电解质及其电离 铜线 灯泡发光 实验表明:金属(铜、铁)能导电 金属能导电的原因是什么? 有 自由移动 的 电子 活动 · 探究 各种物质固体与溶液导电性总结规律。 固体或 纯液体 蔗糖 KNO 3 NaCl NaOH 乙醇 现象 结论 溶液 蔗糖 KNO 3 NaCl NaOH 乙醇 现象 结论 灯泡不亮 灯泡不亮 灯泡不亮 灯泡不亮 灯泡不亮 灯泡不亮 灯泡不亮 灯泡亮 灯泡亮 灯泡亮 不导电 不导电 不导电 不导电 不导电 不导电 不导电 导电 导电 导电 有的物质在 熔融态 也能导电,比如KNO 3 、NaCl等。 【实验结论】 ⑴ KNO 3 、NaCl 、NaOH等固体不导电,但溶于水或加热至融化(熔融状态)可以导电; ⑵蔗糖固体、纯乙醇等不导电,溶于水或加热至融化(熔融状态)也不导电; 电解质和非电解质 在水溶液里 或 熔融状态下 能 够导电的 化合物 称为 电解质 。 HCl 、 NaOH 、 NaCl等 在水溶液 中 和 熔融状态下 都不能 导电 的 化合物 称为 非电解质。 蔗糖 、 酒精等 电解质与非电解质的类别 常见的电解质有 酸、碱、盐、金属氧化物、水 等请分别举例(每种举两例) _______________ 、 _______________ 、 __________________________ 等。 常见的非电解质有 大部分有机物 如 ___________ 、 ______ ; 非金属氧化物 如 ________ 、 ___________ 、 ___________ 以及 NH 3 等。 HCl 、 H 2 SO 4 NaOH 、 Ca(OH) 2 Na 2 SO 4 、 KHSO 4 CuO 、 Na 2 O 乙醇 蔗糖 CO SO 2 NO 2 盐酸? 小结 【 注意问题小结 】 ① 电解质非电解质必须是化合物,能导电的不一定是电解质 ② 电解质必须在水溶液或熔融态才导电,电解质不一定能导电 ③ 电解质必须是自身提供的离子导电 , 如 NH 3 、 SO 2 、 CO 2 等; NH 3 、 SO 2 、 CO 2 在水溶液中能够导电,说明 NH 3 ·H 2 O 、 H 2 SO 3 、 H 2 CO 3 是电解质,而自身不是;它们分别是非电解质,非电解质 ④ 金属氧化物只在熔融状态下导电。 如 CuO 、 Na 2 O 、 Al 2 O 3 等 1 、铜、石墨均导电,所以它们是电解质。 ( ) 2 、 NaCl 溶液能导电,所以它是电解质。 ( ) 3 、电解质在水溶液中和熔融状态下都一定能导电 ( ) 4 、蔗糖、酒精在水溶液和融化状态下均不导电,所以它 们是非电解质。 ( ) × × √ × 5 、下列状态的物质,既能导电又属于电解质的是 A 、 MgCl 2 晶体 B 、 NaCl 溶液 C 、氯化氢气体 D 、熔融烧碱 √ 课堂练习 在下列给出的物质中,按要求填写下列空白 ① HCl ②CuO ③CuSO 4 ·5H 2 O ④Ca(OH) 2 ⑤ H 2 O ⑥ Cu ⑦ Cl 2 ⑧ 盐酸 ⑨ Na 2 CO 3 ⑩ CH 3 COOH 11、SO 3 12 乙醇 13 NH 3 其中能够导电的是_______________________________________。 属于电解质的是_______________________________________。 属于非电解质的是_______________________________________。 ⑤ ⑥ ⑧ ①②③④⑤⑨⑩ 11 、 12 、 13 导电的物质: 1 、金属单质和石墨 2 、溶于水或熔融态的电解质 活动 · 探究 等浓度 各种溶液导电性,观察现象,总结规律。 0.5mol/L 溶液 HCl CH 3 COOH NaCl NaOH 氨水 现象 结论 灯泡 很亮 灯泡不太亮 灯泡 很亮 灯泡 很亮 灯泡 不太亮 导电能力强 导电能力强 导电能力不太强 导电能力不太强 导电能力强 【思考】为什么等浓度的不同溶液,导电能力不同? 溶液的导电能力与什么有关? 【 知识支持 】 ( 1 ) 溶液导电性与自由移动的离子浓度有关,离子浓度越大,导电能力越强 。 (2)有的电解质在水溶液中完全电离,有的电解质在水溶液中部分电离,因此等浓度的不同溶液中,电离出的离子浓度不同,导电能力也不同。 强电解质: 在水溶液中 完全 电离的电解质。 弱电解质 : 在水溶液中 部分 电离的电解质。 强电解质和弱电解质 强弱电解质种类 强酸、强碱和大多数盐都是 强电解质 强酸:(六大强酸) HCl、HNO 3 、H 2 SO 4 、 HClO 4 、HBr、HI 强碱:(四大强碱) NaOH、KOH、Ca(OH) 2 、Ba(OH) 2 大多数的盐: NaCl、AgCl、 BaSO 4 …… 金属氧化物 也是强电解质,熔融状态下都能完全电离 弱酸、弱碱和小部分盐、水是 弱电解质 弱酸 : CH 3 COOH 、 HF、HClO、H 2 S 、H 2 CO 3 、 H 2 SO 3 、H 3 PO 4 (中强酸) 弱碱: 所有难溶性碱、 NH 3 •H 2 O 个别盐 : (CH 3 COO) 2 Pb等 水 是极弱的电解质 在上述给出的物质中,其中属于强电解质的是 __________________________ ; 属于弱电解质的是 _____________________________________________ 。 ①②③④⑨ ⑤⑩ 【课堂练习】在下列给出的物质中,按要求填写下列空白 HCl ②CuO ③CuSO 4 ·5H 2 O ④Ca(OH) 2 ⑤ H 2 O ⑥ Cu ⑦ Cl 2 ⑧盐酸⑨ Na 2 CO 3 ⑩ CH 3 COOH 11 SO 3 12乙醇 13 NH 3 【 注意问题 】 ( 1 ) 电解质强弱与溶解度无关 ,如 BaSO 4 是强电解质; (2) 溶液导电性强弱由取决于溶液中自由移动的离子浓 度和所带的电荷(即自由移动的电荷浓度), 与电解质 强弱无关,BaSO 4 溶液导电能力弱于1mol·L-1的CH 3 COOH 溶液。 【课堂练习】思考判断 (1)强电解质在水溶液里只有离子,没有分子。 (2)弱 电解质在水溶液的只有离子,没有分子。 (3)BaSO 4 难溶于水,其水溶液导电能力极弱,所有BaSO 4 是弱电解质。 (4)强电解质的导电能力一定比弱电解质的导电能力强 (5)难溶物质一定是弱电解质。 ( ) × × × × √ 思考:新制氯水的成份: 三分子四离子 【 电解质的电离 】 【 思考 】 阅读课本 P 41 “2” ,并回答下列问题: ( 1 ) NaCl 晶体是如何形成的?其晶体中有自由移动的离子吗?其晶体能否导电? ( 2 ) NaCl 溶于水或熔融状态能否导电?为什么?溶液能够导电的条件是什么? ( 3 )) NaCl 溶液中自由移动的离子是怎样产生的?什么是电离? 溶于水 在水分子的作用下化学键被破坏 加热熔化 离子获得能量克服化学键 【 质疑 】 固体氯化钠不导电 , 而氯化钠溶液和熔融 态的氯化钠都有导电能力,原因是什么 ? 氯化钠晶体 Na + 、 Cl - 通过 静电作用 ( 化学键 ) 按一定规律紧密排列 Na Cl Na + Cl - 电解质 溶于水 或 受热熔化 时,离解成能够 自由移动的离子 的过程称为电离。 电离可以用 电离方程式 表示 【电离】 电离时生成的阳离子 全部 是氢离子 的化合物叫做 酸 。 电离时生成的阴离子 全部 是氢氧根离子 的化合物 叫做 碱 。 电离时生成 金属阳离子 ( 或铵根离子 ) 和 酸根阴离子 的化合物叫做 盐 。 酸、碱、盐 的定义 ② 等号两边粒子所带的电荷总数相等 系数最简。弱酸的酸式酸根不能拆写。 ① 等号两边各元素的原子个数相等 检查: 电离方程式 : NaCl = Na + + Cl - 阳离子 阴离子 化学式 等号 离子符号 探究二、电离方程式的书写 【 课堂小结 】 化合物 电解质 非电解质 强电解质 弱电解质 酸、碱、盐、 金属氧化物、H 2 O 强酸、强碱、盐、 金属氧化物 弱酸、弱碱、H 2 O 多数有机物、NH 3 非金属氧化物 溶于水或熔 化状态 能否导电 能否 完全 电离 强电解质、弱电解质比较 强电解质 弱电解质 定义 物质类型 电离程度 电离过程 存在微粒 实例 方程式 水溶液中全部电离 水溶液中部分电离 完全电离 部分电离 阴、阳离子 离子、未电离的分子 强酸、强碱、盐 弱酸、弱碱、水 可逆过程 不可逆 HClO H + +ClO — NaOH ====Na + +OH - NaCl HCl NaOH HClO 醋酸 水 1 、电解质是( ) A 、导电性很强的物质 B 、可溶性盐类 C 、在溶于水或熔融状态下能导电的化合物 D 、在水溶液中能全部电离的化合物 C 2 、下列说法正确的是( ) A 、在直流电作用下,氯化钠在水中电离成自由移动的阴阳离子 B 、 Cl 2 的水溶液能导电,但是 Cl 2 属于非电解质 C 、硫酸钡难溶于水,但硫酸钡属于强电解质 D 、水很难电离,纯水几乎不电离,所以水是非电解质 C 3 、下列物质中,能够导电的电解质是( ) A 、铜丝 B 、熔融的 MgCl 2 C 、 NaCl 溶液 D 、蔗糖 4 、下面叙述中正确的是( ) A 、其水溶液能导电的化合物都是电解质 B 、固态时不能导电的化合物一定是非电解质 C 、能导电的物质不一定是电解质 D 、稀硫酸能导电,所以稀硫酸是电解质 B C 5 、下列说法正确的是 ( ) A 、 AgCl 难溶于水,故 AgCl 不是电解质 B 、 CO 2 的水溶液能导电,所以 CO 2 是电解质 C 、金属能导电,所以金属是电解质 D 、固态的 NaCl 不导电,熔融状态的 NaCl 能导电,故 NaCl 是电解质 D 6 、下列物质的水溶液能导电,但属于非电解质的是( ) A 、 HClO B 、 Cl 2 C 、 NaHCO 3 D 、 CO 2 7 、为了维持人体内电解质的平衡,人在大量出汗后应及 时补充( ) A 、 Mg 2 + B 、 Ca 2 + C 、 Na + D 、 Fe 3 + D C D 8 、下列电离方程式中,错误的是 ( ) A 、 Al 2 (SO 4 ) 3 ==== 2Al 3+ +3SO 4 2- B 、 FeCl 3 ==== Fe 3+ +3Cl - C 、 HCl ==== H + +Cl - D 、 Na 2 CO 3 ==== Na 2+ +CO 3 2- 9 、下列说法正确的是( ) A 、 NaCl 、 MgCl 2 在熔融状态时都能导电,因此它们都是 电解质 B 、 HCl 、 H 2 SO 4 液态时都不导电,因此它们都是非电解 质 C 、易溶于水的化合物都是电解质 D 、强电解质水溶液的导电能力一定强于弱电解质水溶液 的导电能力 A 10 、下列物质:① NaCl ② 稀硫酸 ③酒精 ④ Fe ⑤ NaOH 溶液 ⑥蔗糖溶液 ⑦ BaSO 4 ⑧ 醋酸 ⑨ Cl 2 ⑩ CO 2 以上物质中是混合物的有 ;(填序号,下同) 是电解质但该状态不导电的有 ; 是强电解质的有 ; 是非电解质的有 ; 既不是电解质也不是非电解质,但本身能导电的有 。 ③ ⑩ ② ⑤ ⑥ ① ⑦ ⑧ ① ⑦ ② ④ ⑤查看更多