- 2021-08-06 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年宁夏回族自治区银川一中高二下学期期中考试化学试题 Word版
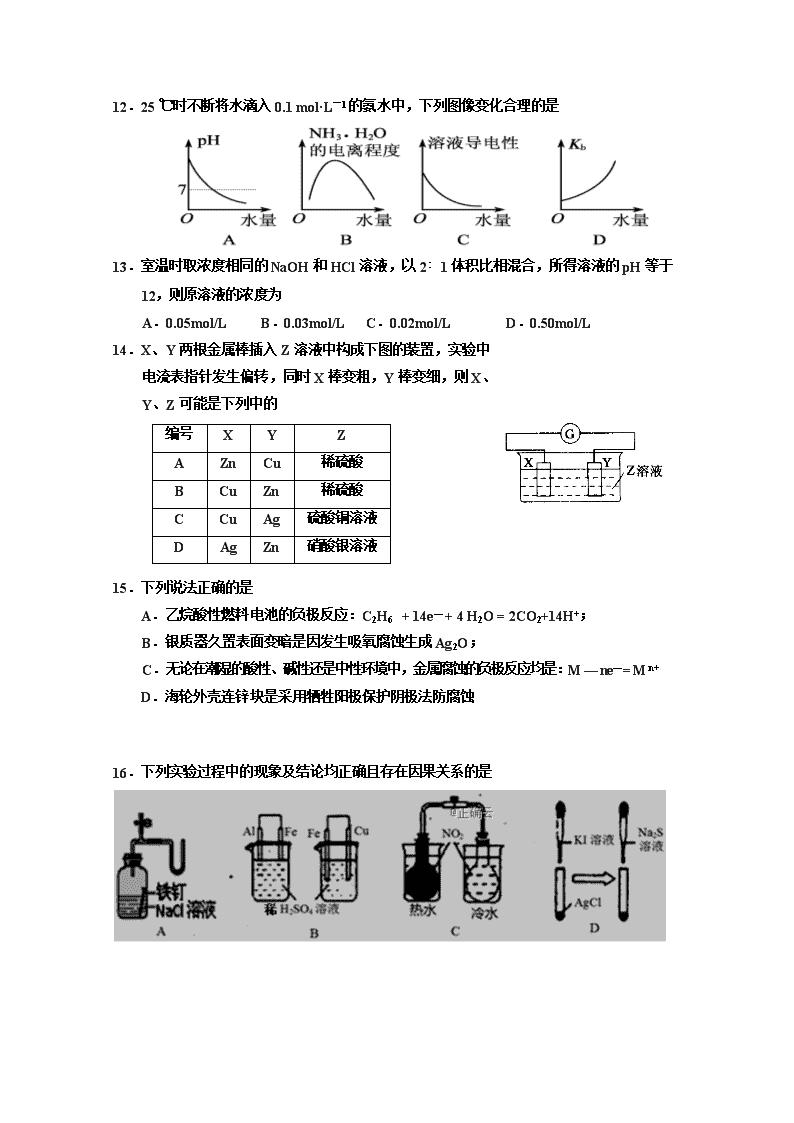
银川一中2018/2019学年度(下)高二期中考试 化 学 试 卷 命题人:何卫宁 可能用到的相对原子质量:H—1 O—16 Na—23 S—32 Cl—35.5 Cu—64 一、选择题:(每小题只有一个正确答案,每小题2分,共50分) 1.下列有关电解质的说法正确的是 A.强电解质一定是离子化合物 B.易溶性强电解质的稀溶液中不存在溶质分子 C.强电解质溶液的导电能力一定比弱电解质强 D.由于硫酸钡难溶于水,所以硫酸钡是弱电解质 2.下列方程式书写正确的是 A.HCO3−的电离方程式:HCO3-+H2OH3O++CO32- B.泡沫灭火器的原理:Al3++3HCO3- Al(OH)3↓+3CO2↑ C.NH4Cl溶于D2O中:NH4++D2ONH3·D2O+H+ D.Na2S显碱性原因:S2-+2H2OH2S+2OH- - 3、对H2O的电离平衡不产生影响的粒子是 A. B.26Fe3+ C. D. 4.下列实验操作能达到目的是 A.用pH试纸测定氯水溶液的pH=3 B.将FeCl3溶液加热蒸干并灼烧获得Fe2O3固体 C.向明矾溶液中加入一定量NaOH制备Al(OH)3胶体 D.室温下,测得pH=5的NaHSO4溶液与pH=9的NaHCO3溶液中水的电离程度相等 5.下列实验符合要求的是 A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 B.用托盘天平称取NaOH固体时需先在左右两盘中各放上大小相同的纸片 C.若25 mL滴定管中液面的位置在刻度为10mL处,则滴定管中液体的体积一定大15 mL D.用玻璃棒蘸取溶液滴在表面皿上的已润湿pH试纸上测得其pH为12 6.常温下,下列溶液中可能大量共存的离子组是 A.加入金属镁能产生大量H2的溶液中:Na+、NH4+、F-、SO32- B.含有大量S2-的溶液中:K+、Mg2+、ClO-、SO42- C.能使Al3+生成沉淀的溶液中:NH4+、Na+、SiO32-、HCO3- D.水电离产生的c(OH-)=1×10-10 mol/L的溶液中:Al3+、SO42-、NO3-、Cl- 7.下列有关钢铁腐蚀与防护的说法正确的是 A.钢管与电源正极连接,钢管可被保护 B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀 D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+ 8.如图所示各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序是 A.④>②>①>③ B.②>①>③>④ C.④>②>③>① D.③>②>④>① 9.实验:①向盛有1 mL 0.1 mol·L-1MgCl2溶液试管中加1 mL 0.2 mol·L-1NaOH溶液,得到浊液 a,过滤得到滤液b 和白色沉淀c。②向沉淀 c中滴加0.1 mol·L-1FeCl3溶液,沉淀变为红褐色。下列分析不正确的是 A.滤液b中不含有Mg2+ B.实验可以证明Fe(OH)3比Mg(OH)2更难溶 C.②中颜色变化说明Mg(OH)2转化为Fe(OH)3 D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+ (aq)+2OH-(aq) 10.有A、B、C、D四种一元酸溶液,对它们进行的有关实验及其结果分别为:(1)在物质的量浓度相同的A、C两溶液中,都滴加几滴甲基橙时,A溶液呈黄色,C溶液呈橙色(2)B的钠盐溶液的pH值小于C的钠盐溶液pH值(3)A酸与D的盐反应生成A的盐和D酸。由此可以确定这四种酸的酸性由强到弱的正确排列顺序为 A.B>C>A>D B.A>C>B>D C.D>A>C>B D.C>B>A>D 11. c(H+)相同的等体积的两份溶液 A 和 B,A 为盐酸,B 为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出的氢气的质量相等,则下列说法正确的是 ①反应所需要的时间 B>A ②开始反应时的速率 A>B ③参加反应的锌的物质的量 A=B ④反应过程的平均速率 B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余 A.③④⑤ B.③④⑥ C.②③⑤ D.②③⑤⑥ 12.25 ℃时不断将水滴入0.1 mol·L-1的氨水中,下列图像变化合理的是 13.室温时取浓度相同的NaOH和HCl溶液,以2﹕1体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 A.0.05mol/L B.0.03mol/L C.0.02mol/L D.0.50mol/L 14.X、Y两根金属棒插入Z溶液中构成下图的装置,实验中 电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、 Y、Z可能是下列中的 编号 X Y Z A Zn Cu 稀硫酸 B Cu Zn 稀硫酸 C Cu Ag 硫酸铜溶液 D Ag Zn 硝酸银溶液 15.下列说法正确的是 A.乙烷酸性燃料电池的负极反应:C2H6 + 14e— + 4 H2O = 2CO2+14H+; B.银质器久置表面变暗是因发生吸氧腐蚀生成Ag2O; C.无论在潮湿的酸性、碱性还是中性环境中,金属腐蚀的负极反应均是:M — ne— = M n+ D.海轮外壳连锌块是采用牺牲阳极保护阴极法防腐蚀 16.下列实验过程中的现象及结论均正确且存在因果关系的是 实验 实验现象 结论 A 广口瓶中光亮的铁钉放置一段时间后生锈 铁钉发生析氢腐蚀 B 左烧杯铁表面冒气泡,右烧杯铜表面冒气泡 金属活动性:Al>Fe>Cu C 左烧杯气体颜色加深,右烧杯气体颜色变浅 2NO2(g)N2O4 (g) △H>0 D 白色固体先变为黄色,后变为黑色 Ksp:AgCl<AgI<Ag2S 17.下列实验操作正确的是 ①与溶液可作焊接金属中的除锈剂 ②用带橡胶塞的玻璃试剂瓶存放氟化钠溶液 ③用盐酸酸化过的FeCl3溶液,除去H2还原CuO实验留在试管内的铜 ④测定某溶液的pH时,先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液点在试纸上,并与标准比色卡比较,测得pH为2.1 A.①③ B.①②③ C.③ D.②③ 18.常温下,Ka(HCOOH)=1.77×10−4,Ka(CH3COOH)=1.75×10−5,Kb(NH3·H2O) =1.75×10−5,下列说法正确的是 A.相同体积pH均为3的HCOOH和CH3COOH溶液,中和NaOH的能力相同 B.0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH 等体积混合后: c(HCOO−) + c(OH−) < c(HCOOH) + c(H+) C.浓度均为0.1 mol·L−1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者 D.将CH3COONa溶液从20℃升温至30℃,溶液中增大 19. 浓度均为0.1mol·L-1、体积均为V0的HX、HY溶液,分别 加水稀释至体积V,pH随lg的变化关系如图所示。下 列叙述正确的是( ) A. 常温下,由水电离出的c(H+)·c(OH -):ab D. lg =3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则减小 20.常温,某二元弱酸H2A溶液中离子浓度与 y pH的关系如图所示(y为lg [c(HA−)/c(H2A)] 或lg [c(A2−)/c(H2A)]):下列说法不正确的是 A.曲线b为lg[c(HA−)/c(H2A)] 与pH的变 化关系 B.该温度下,H2A的Ka2约为10−4.1 C.若在上图中作lg[c(HA−) /c(A2−)] ~ pH关 系图,得到的曲线会与曲线b平行 D.若升高温度,则图中曲线a、b上移 21.在常温下,0.1000 mol·L-1Na2CO3溶液25 mL用 0.1000 mol·L-1盐酸滴定,滴定曲线如图。对滴定过 程中所得溶液中相关离子浓度间的关系,下列说法 正确的是 A. a点:c(CO32-)>c(HCO3-)>c(OH-) B. b点:5c(Cl-)=4c(HCO3-)+4c(CO32-) C. c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) D. d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) 22.t℃时,AgCl的Ksp=2×10-10,砖红色固体Ag2CrO4在水中 的沉淀溶解平衡曲线如图所示。下列说法正确的是 A.在t℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+ CrO42-(aq)的平衡常数K=2.5×10-7 B.在t℃时,Ag2CrO4的Ksp=1×10-12 C.在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 D.在t℃时,用AgNO3标准溶液滴定20 mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 23.NO2、O2和熔融KNO3可制作燃料电池,其原理如图 所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y可循环使用。下列说法正确的是 A.放电时,NO3-向石墨Ⅱ电极迁移 B.石墨Ⅱ附近发生的反应为NO+O2+e-===NO3- C.该电池总反应式为4NO2+O2===2N2O5 D.当外电路通过4 mol e-时,负极上共产生2mol N2O5 24.将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是 A.A点pH小于7是因为Cu2+水解使溶液显酸性 B.BC段阳极产物是Cl2 C.整个过程中阳极先产生Cl2,后产生O2 D.CD段电解的物质是水 25. 图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸, 滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑 向d端扩散。下列判断正确的是 A.滤纸上c点附近会变红色 B.Cu电极质量减小,Pt电极质量增大 C.Z中溶液的pH先减小,后增大 D.溶液中的SO42-向Cu电极定向移动 二、非选择题:(共50分) 26.(每空2分共10分) 某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上; ②固定好滴定管并使滴定管尖嘴处充满液体; ③调节液面至“0”或“0”刻度线以下,并记下读数; ④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液; ⑤用标准液滴定至终点,记下滴定管液面读数。 请回答下列问题: (1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。 A.配制标准溶液的固体NaOH中混有Na2O杂质 B.滴定终点读数时,俯视滴定管的刻度,其他操作正确 C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗 D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 (2)判断滴定终点的现象是___________________________________________________ __________________________________________________________。 (3)如图是某次滴定时滴定管中的液面,其读数为________mL。 (4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。 滴定次数 待测体积(mL) 标准NaOH溶液体积(mL) 滴定前读数 滴定后读数 第一次 20.00 0.40 20.40 第二次 20.00 2.00 24.10 第三次 20.00 4.00 24.00 27. (每空2分共14分) 按要求回答下列问题: (1)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是 。 A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大 C.溶液中不变 D.溶液中减小 (2)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积变化忽略不计)。 (3)常温下,浓度均为0.lmol/L的下列五种溶液的pH值如表所示: 溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN pH 8.8 9.7 11.6 10.3 11.1 ①根据表中数据,将pH=3的下列四种酸溶液分别稀释100倍,pH变化最小的是 A.HCN B.HClO C.H2CO3 D.CH3COOH ②根据以上数据,判断下列反应可以成立的是 。 A.CH3COOH+Na2CO3 NaHCO3+CH3COONa B.CH3COOH+NaCN CH3COONa+HCN C.CO2 +H2O+2NaClO Na2CO3+2HClO D.NaHCO3+HCN NaCN+H2O+CO2 (4)几种离子开始沉淀时的pH如下表: 离子 Fe2+ Cu2+ Mg2+ pH 7.6 5.2 10.4 当向含相同浓度离子Cu2+、Fe2+、Mg2+的溶液中滴加NaOH溶液时, (填离子符号)先沉淀。 (5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。 (1)已知部分弱酸的电离平衡常数如下表: 弱酸 HCOOH HCN H2CO3 电离平衡常数(25 ℃) Ka=1.77×10-4 Ka=5.0×10-10 Ka1=4.3×10-7 Ka2=5.6×10-11 ①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是_________; ②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) __________。 28.(每空2分共16分) NaCN溶液 反应器 操作A 滤渣1 除杂 CaCl2 转化池 FeSO4 K4Fe(CN)6 Na2CO3 KCl 滤渣2 系列操作B 亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN废液为主要原料制备黄血盐的流程如下: 请回答下列问题: (1)常温下,HCN的电离常数Ka=5.0×10-10。 ①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。 ②浓度均为0.5mol·L−1的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。 (2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。 (3)系列操作B为_____________________。 (4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。 太 阳 光 催 化 剂 a 催 化 剂 b e- Fe(CN)64- Fe(CN)63- (5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。 ①K+移向催化剂___________(填“a”或“b”)。 ②催化剂a表面发生的反应为_________________。 29.(每空2分共10分) 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在电极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-===2O2-)。 (1)c电极作_______极,d电极上的电极反应式为________________________________。 (2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为________________,若a电极产生56 mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。 a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 高二期中化学试卷参考答案 1-5:B AC B C 6-10:D B A A A 11-15:A C B D D 16-20:B A C A C 21-25:D B C B A 26.(每空2分共10分)答案 (1)① CD (2)滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不变色 (3)22.60 (4)0.2000 27. (14分,每空2分) (1)CD , (2)1:1 (3)①A,②AB (4)Cu2+ (5)①Na2CO3溶液,②b>a>c 28.(每空2分共16分) (1)①抑制CN−水解;(2分) ②碱(2分);Kh=Kw/Ka=1×10−14/5×10−10=2×10−5>5×10−10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性(2分) (2)相同温度下K4Fe(CN)6的溶解度小于Na4Fe(CN)6 (2分) (3)过滤、洗涤、干燥 (2分) (4)KFe[Fe(CN)6](s)+Tl+(aq) ===TlFe[Fe(CN)6](s)+K+(aq) (2分) (5)①b(2分);②Fe(CN)-e−===Fe(CN) (2分) 29、(每空2分,共10分) (1) 正 ; CH4+4O2--8e-===CO2+2H2O (2) 4OH--4e-===2H2O+O2↑ ; 1 ; ac查看更多