化学卷·2018届黑龙江省大庆实验中学高二上学期期末考试(2017
大庆实验中学2016-2017上学期期末考试
高二化学试题
可能用到的相对原子质量 H-1 N-14 O-16 F-19 Na-23 Mg-24 S-32 Cl-35.5 Cu-64 Ag-108
一、单选题(每题只有一个选项符合题意,每题3分):
1.下列过程属于物理变化的是( )
A.石油裂解 B.氯乙烯聚合 C.煤的干馏 D.石油分馏
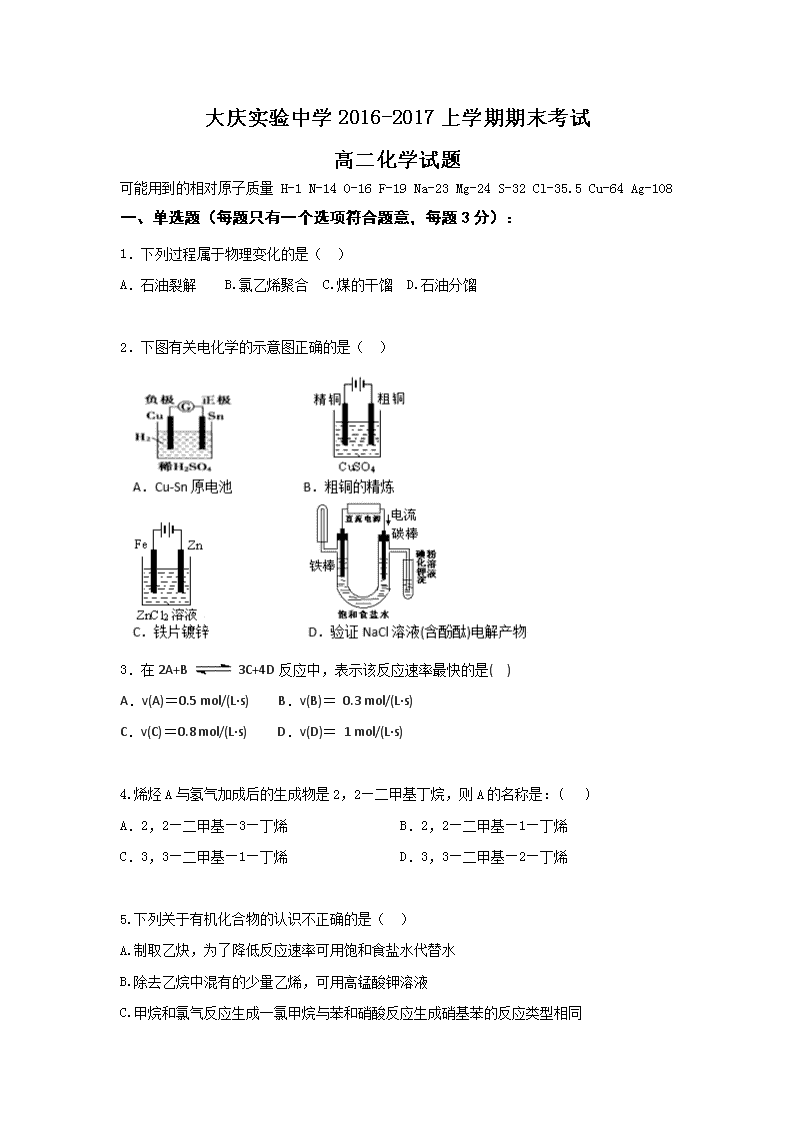
2.下图有关电化学的示意图正确的是( )
3.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L·s) B.v(B)= 0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)= 1 mol/(L·s)
4.烯烃A与氢气加成后的生成物是2,2—二甲基丁烷,则A的名称是:( )
A.2,2—二甲基—3—丁烯 B.2,2—二甲基—1—丁烯
C.3,3—二甲基—1—丁烯 D.3,3—二甲基—2—丁烯
5.下列关于有机化合物的认识不正确的是( )
A.制取乙炔,为了降低反应速率可用饱和食盐水代替水
B.除去乙烷中混有的少量乙烯,可用高锰酸钾溶液
C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
D.乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响
6.将一定量的SO2和O2充入一个容积固定的密闭容器中,在一定条件下发生反应:
2SO2(g)+O2(g)2SO3(g),下列哪个量不再变化时,并不能说明化学反应已达到平衡状态( )
A.混合气体的密度 B.混合气体的压强
C.混合气体的平均摩尔质量 D.SO2的转化率
7.常温下,1mol化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是( )
共价键
H—H
F—F
H—F
H—Cl
H—I
E/(kJ·mol-1)
436
157
568
432
298
A.432kJ·mol-1>E(H—Br)>298kJ·mol-1 B.表中最稳定的共价键是H—F键
C.H2(g)→2H(g)△H=+436kJ·mol-1 D.H2(g)+F2(g)=2HF(g)△H=-25kJ·mol-1
8.已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是( )
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
9.已知反应:A(s)+3B(g)2C(g)ΔH<0
,在体积为10L的密闭容器中发生反应的过程如图所示:下列说法正确的是( )
A.前4 min,用A表示反应速率为v(A)=0.005mol/(L·min)
B.X曲线表示B的物质的量随时间变化的关系
C.第t1 min时说明反应达到了平衡 D.第10 min时,可能采取了降温
10.在下列各说法中,正确的是( )
A.1 mol H2SO4与1 mol Ba(OH)2反应时放出的热叫做中和热
B.500℃、30MPa下,将0.5mol N2和 1.5molH2置于密闭的容器中充分反应生成NH3,放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)2NH3(g) ; △H=-38.6kJ·mol-1
C.Ba(OH)2·8H2O与NH4Cl反应是氧化还原反应,且反应的焓变大于零
D.热化学方程式中的化学计量数表示物质的量,可以是分数
11.下表是几种弱酸常温下的电离平衡常数:
CH3COOH
H2CO3
H2S
H3PO4
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
K1=7.5×10-3
K2=6.2×10-8
K3=2.2×10-13
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸 B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸,增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
12.下列离子能大量共存,且满足相应要求的是( )
选项
离子
要求
A
K+、Cl-、SO42-、MnO4-
c(K+)< c(Cl-)
B
Na+、Ca2+、I-、NO3-
c(H+)/c(OH-)=1×1014
C
Al3+、NH4+、SO42-、CH3COO-
滴加NaOH浓溶液立刻有气体产生
D
Na+、HCO3-、Cl-、SO42-
滴加Al2(SO4)3溶液立刻有沉淀和气体产生
13.下列说法合理的是( )
A.向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液,则离子方程式为:HA-+OH-=A2-+H2O
B.室温时,1.0L、pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
C.由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3—
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:
NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
14.下列说法正确的是( )
A.浓度均为0.2mol﹒L-1的 Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
B.浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a>b>c
C.NaHSO3溶液显酸性,c(Na+)>c(HSO3- )>c(H+)>c(OH-)>c(SO32-)
D.pH=3.6 的0.lmol/LHX 与0.lmol/LNaX 的混合溶液中,2c(H+)-2c(OH-)=c(X-)-c(HX)
15.在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的
Ksp=4×10-10,下列说法不正确的是( )
A.在t℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和溶液中加入K2CrO4
可使溶液由Y点到Z点
C.在t℃时,Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D.在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀
16.瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(如图甲)在煤矿巷道中的甲烷浓度达到一定值时,其传感器就可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+4O2--8e-CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
17.已知:(HF)2(g) 2HF(g) ΔH>0,且平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
A.温度:T1
va D.当=30g·mol-1时,n(HF):n[(HF)2]=2:1
18.关于下列各图的叙述,正确的是( )
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
19.二氧化氯被国际上公认为安全、无毒的绿色消毒剂,以KClO3溶液为原料,采用电解法生产二氧化氯反应原理如下:4ClO3-+2H2O 4ClO2↑+ O2↑+4OH-。下列说法正确的是( )
A.电解过程中OH-向阴极迁移 B.阳极反应式为: 4OH- -4e-= O2↑+2H2O
C.毎有l mol电子转移,生成标准状况下5.6L气体 D.电解过程中阴极区溶液的pH降低
20.下列说法不正确的是( )
A.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后
B.0.1 mol·L-1醋酸溶液中:c2(H+)=c(H+)·c(CH3COO-)+KW
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.在25 ℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02)
二、填空题(共40分):
21.( 共11分 )
I.(共4分)甲、乙、丙、丁分别是甲烷、乙烯、丙烯(CH3—CH===CH2)、苯中的一种;
甲、乙能使溴水褪色,甲分子中所有原子共平面,但乙分子不是所有原子共平面。
‚丙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色。
ƒ丁既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应。一定条件下,1 mol丁可以和3 mol H2完全加成。
请根据以上叙述完成下列填空:
(1)甲的结构简式________,丙的空间构型是_______。
(2)丁与H2在催化剂作用下发生加成反应的化学方程式____________________。
II、(共7分)某烃A的相对分子质量为84.回答下列问题:
(1)烃A的分子式为 。
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。
① A的结构简式为 名称为 。
② 链烃A与Br2的CCl4溶液反应生成B,写出由A生成B的化学方程式: 。
③ 与A互为同分异构体,且主链碳原子个数与A相同的链烃有 种(不包括A)
(3)若A不能使Br2的CCl4溶液褪色,且其一氯代物只有一种,则A的结构简式为 。
22.(共16分)
I、(共10 分)甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应: CO(g)+2H2(g)CH3OH(g) ΔH
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度
250℃
300℃
350℃
K
2.041
0.270
0.012
由表中数据判断反应I为______________热反应(填“吸”或“放”)。
‚ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从表中选择)。
(2) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3 kJ/mol
则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol(用ΔH1、ΔH2、ΔH3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72‾)时,实验室利用下图装置模拟该法:
① N电极的电极反应式为 。
② 请完成电解池中Cr2O72‾转化为Cr3+的离子反应方程式(共2分):
Cr2O7 2‾+ Fe2+ + [ ] ═ Cr3++ Fe3++ [ ]
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol•L﹣1 时,Cr3+沉淀完全,此时溶液的pH= 。 (已知, Ksp[Cr(OH)3]=6.4×10‾31,lg2=0.3)
II、(6分)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
(1)电池工作时的总反应为:LiFePO4+6CLi1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
(2)用该电池电解精炼铜。若用放电的电流强度I=2.0A的电池工作10
分钟,电解精炼铜得到铜0.32g,则电流利用效率为______________(保留小数点后一位)。
(已知:法拉第常数F=96500C/mol,电流利用效率=×100%)
23.(共13分)
现代传感信息技术在化学实验中有广泛的应用。
Ⅰ.(共3分)某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。检验三颈瓶集满NH3的方法是 。
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
Ⅱ.(共6分)测定室温下NH3•H2O的浓度及电离平衡常数Kb
(1)从三颈瓶中用 (填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据、电脑绘制滴定曲线如下图。
(2)据图,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= ,当pH=11.0时计算Kb的近似值,Kb≈ 。(Kb保留两位有效数字)
(3)关于该滴定实验的说法中,正确的是 。
A.锥形瓶中有少量蒸馏水不影响测定结果B.未滴加酸碱指示剂,实验结果不科学
C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高D.滴定终点时俯视读数会导致测得氨水的浓度偏高
III、(共4分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
(1)该反应的离子方程式为
__________________________________________________________________。
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1,每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
的浓度 / mol·L-1
溶液褪色所需时间t / min
第1次
第2次
第3次
0.01
14
13
11
0.001
6
7
7
(2)计算用0.001 mol·L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率
(忽略混合前后溶液的体积变化)。
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。(填 “行”或“不行”)
答案:
一、选择题 DDBCB ADDDD CDDDA CCDBA
二、填空题
21.I(1)CH2=CH2,正四面体;
(2) 。
II(1)C6H12;
(2)①;2,3-二甲基-2-丁烯;
②+ Br2→
③2
(3)
22.I(1)①放②80% 250℃
(2)(ΔH1-ΔH2+4ΔH3)/2
(3)①O2+4e‾+4H+=2H2O ②1Cr2O2‾7+6Fe2++14[H+]═2Cr3++6Fe3++7[H2O]
(4)5.6
II (1)Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
(2)80.4%
23.I
(1)将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满;或:将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满;
(2)D
Ⅱ.(1)碱式滴定管(或移液管);
(2)0.0450; ;2.3×10-5或2.2x10-5(都给分);
(3)AC.
III、(1)2MnO4 -+5H2C2O4 +6H+→ -2Mn2++10CO2 ↑+8H2O
(2) c(KMnO4)=,反应时间:△t=(6min+7min+7min)÷3=6.7min,所以KMnO4的平均反应速率ν(KMnO4)=
(3)不行