2018-2019学年山东省莒县第二中学高二上学期第一次月考化学试题 Word版
莒县二中高二级第一次测试
化学试题
2018.10
1.本试卷分第I卷(1~4页)和第Ⅱ卷(5~8页),全卷满分100分,考试时间为90分钟。
2.请将第I卷题目的答案用2B铅笔涂在答题卡上,第Ⅱ卷题目的答案用黑色签字笔、黑色钢笔或黑色圆珠笔填写。
3.可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Si:28 S:32 Cl:35.5 Mn:55 Fe:56 Cu:64
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,共48分;每小题只有一个选项符合题意)
1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.铅蓄电池的正极反应为PbO2+4H++2e-===Pb2++2H2O
B.以CO和O2构成的碱性燃料电池负极电极反应式为
CO+4OH--2e-===CO+2H2O
C.电解法精炼铜时,阴阳两极得失电子相同,质量变化相同
D.工业上通过电解氯化钠溶液制备金属钠和氯气
2.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
A.K值不变,平衡可能移动
B.K值变化,平衡一定移动
C.平衡移动,K值可能不变
D.平衡移动,K值一定变化
3.对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系:2v正(NH3)=3v正(H2O)
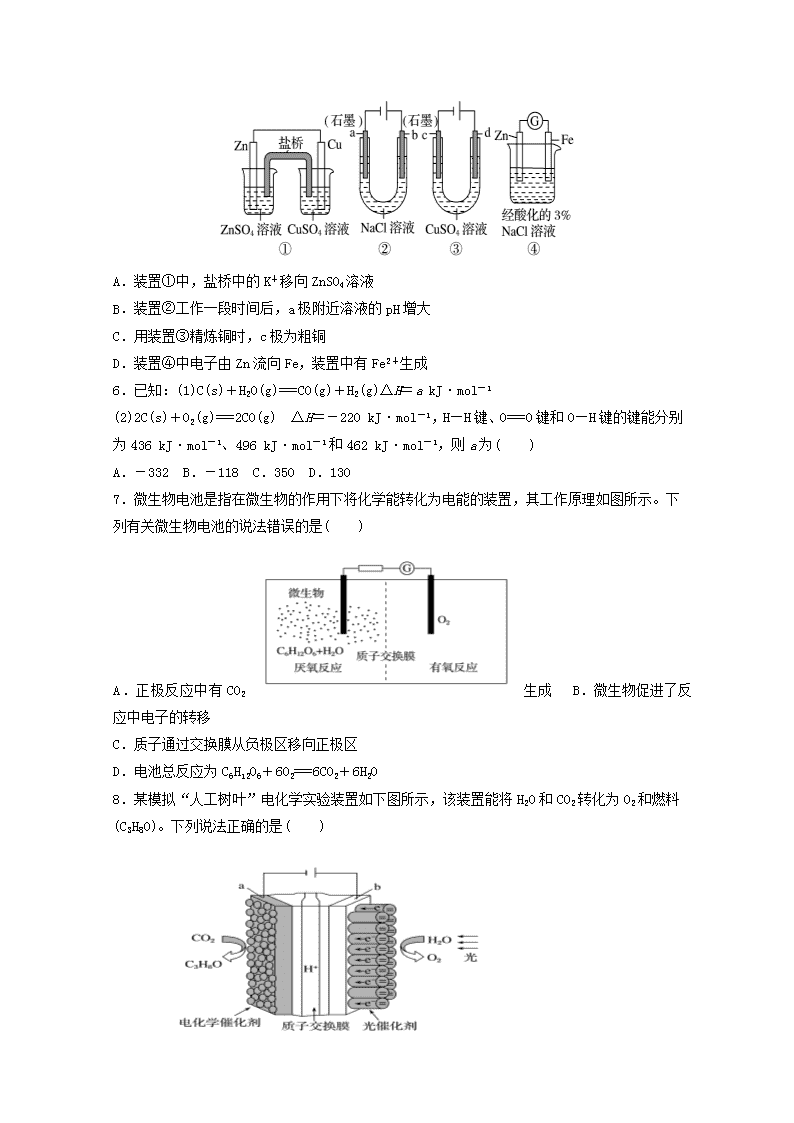
4.某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu,则( )
A. 电流方向:电极Ⅳ→→电极Ⅰ
B. B.电极Ⅰ发生还原反应
C. 电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
5.关于下列装置说法正确的是( )
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
6.已知:(1)C(s)+H2O(g)===CO(g)+H2(g)ΔH=a kJ·mol-1
(2)2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1,H—H键、O===O键和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.-332 B.-118 C.350 D.130
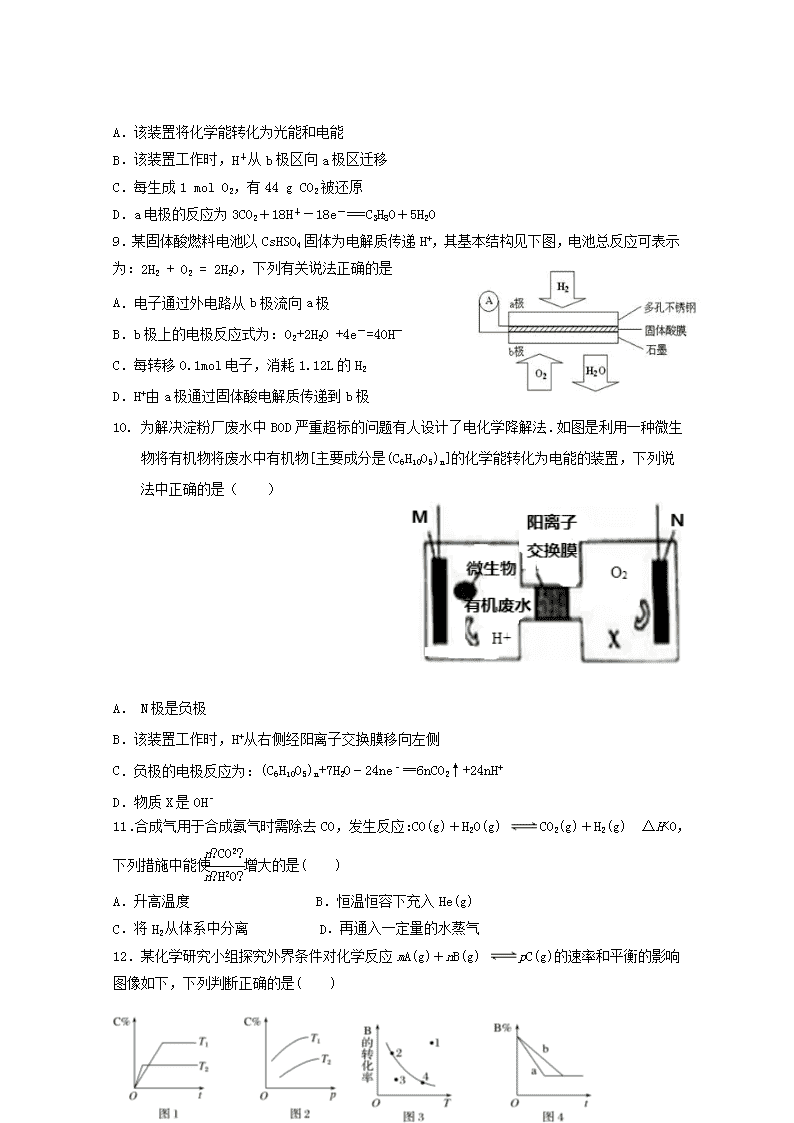
7.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成 B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2===6CO2+6H2O
8.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为3CO2+18H+-18e-===C3H8O+5H2O
9.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2 + O2 = 2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O +4e-=4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
10. 为解决淀粉厂废水中BOD严重超标的问题有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
A. N极是负极
B.该装置工作时,H+从右侧经阳离子交换膜移向左侧
C.负极的电极反应为:(C6H10O5)n+7H2O﹣24ne﹣═6nCO2↑+24nH+
D.物质X是OH﹣
11.合成气用于合成氨气时需除去CO,发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,下列措施中能使增大的是( )
A.升高温度 B.恒温恒容下充入He(g)
C.将H2从体系中分离 D.再通入一定量的水蒸气
12.某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
A.由图1可知,T1
v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
13.在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃
25
80
230
平衡常数
/mol-3·L3
5×104
2
1.9×10-5
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.在25 ℃时,反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5 mol3·L-3
C.80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆
D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
14. 恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个恒压的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g)⇌A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡,下列说法中正确的是( )
A.平均反应速度:乙>甲
B.平衡时C的物质的量甲>乙
C.平衡时C的转化率:乙<甲
D.平衡时A的物质的量甲>乙
15.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ· mol-1。
实验测得起始、平衡时的有关数据如表所示:
容器编号
起始时各物质的物质的量/ mol
达平衡时反应中的能量变化
N2
H2
NH3
①
1
3
0
放出热量a kJ
②
2
3
0
放出热量b kJ
③
2
6
0
放出热量c kJ
下列叙述正确的是( )
A.放出热量关系:a①>②
C.达平衡时氨气的体积分数:①>③ D.N2的转化率:②>①>③
16.在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法中正确的是( )
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A.反应前2 min的平均速率v(Z)=2.0×10-5 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
莒县二中高二级第一次测试
化学试题
2018.10
第Ⅱ卷(非选择题 共52分)
二、非选择题(本题包括5小题,共52分)
17.(8分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)。
已知:CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.1 kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
则反应2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g)ΔH=________。
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池,电解200 mL饱和食盐水(惰性电极),一段时间后,阴极收集到标况下的氢气2.24 L(设电解后溶液体积不变)。
①二甲醚燃料电池的负极反应式为________________________________________________________。
②请写出电解食盐水的化学方程式___________________________________________。
③电解后溶液的中氢氧根离子的浓度为________ 。
18.(14分)
1.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示:
回答下列问题:
(1)甲烷燃料电池正、负极的电极反应式分别为_______________________ 、_________________。
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是________。
(3)若电池甲烷通入量为1 L(标准状况),且反应完全,则最多能产生的氯气体积为______L(标准状况)。
(4)要用燃料电池为电源进行粗铜的精炼实验,粗铜板应与________(填“A”或“B”)极相连;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为
_____________________________________________________
_____________________________________________________。
2. 科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:
__________________________________________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。
19.(9分)科学家制造出一种使用固态电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作为惰性电极,在电极上分别通入CH4和空气,其中固态电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-===2O2-)。
(1) c电极的名称为
________,
d电极上的电极反应式为__________________________。
(2)如图2所示用惰性电极电解100 mL 0.1 mol·L-1AgNO3溶液,a电极上的电极反应式为____________________________,若a电极产生112mL(标准状况)气体,则b电极上生成物质的物质的量为________ ,若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
20.(10分)在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
时间/s
0
20
40
60
80
c(N2O4)/mol·L-1
0.100
c1
0.050
c3
c4
c(NO2)/mol·L-1
0.000
0.060
c2
0.120
0.120
(1)该反应的平衡常数表达式为__________________________;
从表中分析:c1________(填“>”“<”或“=”,下同)c2,c3________c4。
(2)在上述条件下,从反应开始直至达到化学平衡时,NO2的平均反应速率为________
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母)。
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.2 mol NO2气体,则达到平衡时NO2气体的转化率为________。
21.(11分)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。
(1)图1是CO(g)+2H2(g) CH3OH(g),反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH________(填“>”“<”或“=”)0。
②T1和T2温度下的平衡常数大小关系是K1______(填“>”“<”或“=”)K2。在T1
温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为_________________________________。
③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为____________。
莒县二中高二级第一次测试
化学试题答案
1.B 2.D 3.A 4.A 5.B 6.D 7.A 8.B 9.D 10.C 11.C 12.C 13.C
14.B 15.A 16.B
17.(8分)
(1)-122.5 kJ·mol-1(2分)
(2) CH3OCH3+3H2O-12e-===2CO2+12H+(2分)
②2NaCl+2H2O2NaOH+H2↑+Cl2↑(2分)
③1mol.L-1 (2分)
18.(14分)
1.(1)2O2+4H2O+8e-===8OH- (1分)
CH4-8e-+10OH-===CO+7H2O (2分)
(2)H2 (1分) (3)4 (2分)
(4)B (2分)
Au、Ag以单质形式存在于阳极泥中,Fe以Fe2+形式存在于电解质溶液中(2分)
2. ①SO2+2H2O-2e-===SO+4H+(2分)
②HSO+H2O-2e-===SO+3H+(2分)
19.(9分)
(1)正极 (1分) CH4+4O2--8e-===CO2+2H2O (2分)
(2)4OH--4e-===2H2O+O2↑(2分) 0.015 (2分) ac(2分)
20.(10分)
(1)K=(2分) < (1分) = (1分)
(2)0.002mol.L-1.S-1 (2分) (3)B (2分)
(4)40%(2分)
21.(11分)
(1)①<(1分) ②>(1分) 12 mol-2·L2(2分) ③b(1分) (2)270(2分) 4 mol-2·L2(2分) K1=K2
查看更多