- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高中化学 专题1课题三 硝酸钾晶体的制备教学案 苏教版选修6
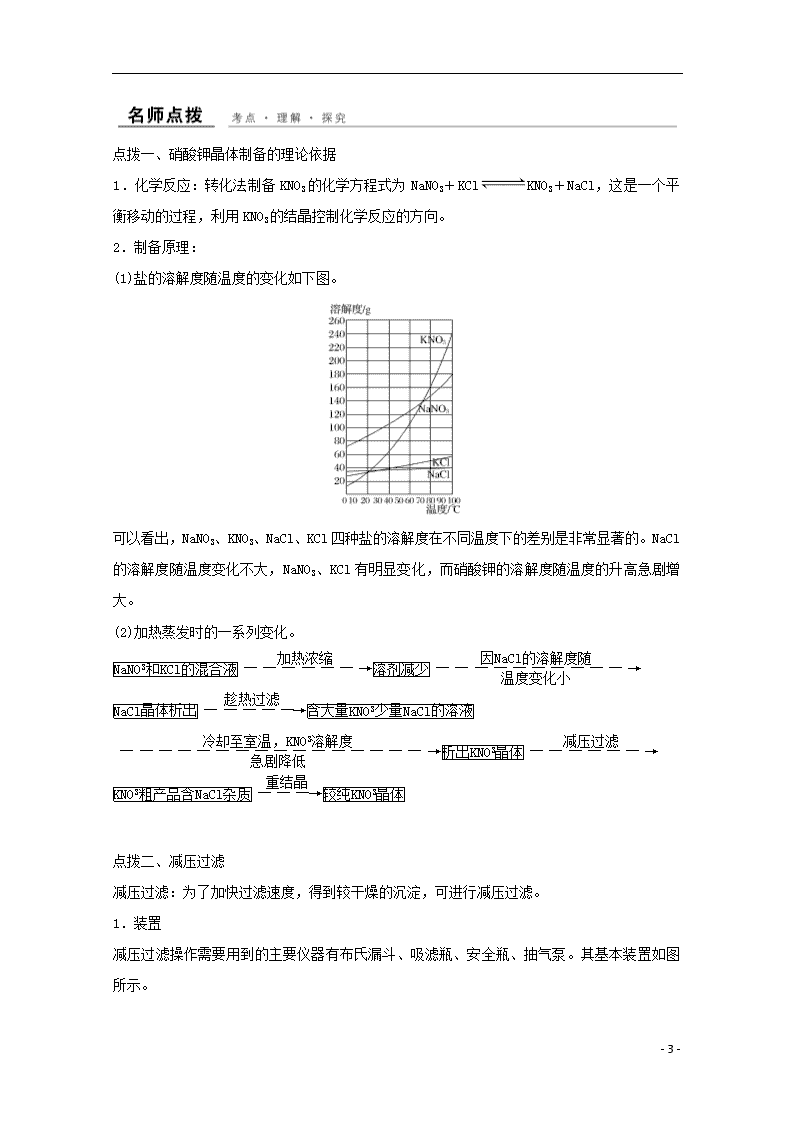
课题三 硝酸钾晶体的制备 【学考报告】 知识条目 加试要求 ①硝酸钠和氯化钾制取硝酸钾的原理及操作流程 ②结晶或重结晶的方法提纯固态物质的原理及操作 ③减压过滤的实验方法 ④晶粒生长的条件 b b a a 一、硝酸钾晶体的制备原理 1.盐的溶解度随温度的变化 氯化钠的溶解度随温度变化不大,而氯化钾、硝酸钠和硝酸钾在高温时具有较大的溶解度。温度降低时,氯化钾、硝酸钠的溶解度明显减小,而硝酸钾的溶解度则急剧下降。 本实验利用不同物质的溶解度随温度改变而发生不同变化的原理,用NaNO3和KCl通过复分解反应来制取KNO3,其反应的化学方程式为NaNO3+KClKNO3↓+NaCl。 在NaNO3和KCl的混合溶液中,同时存在Na+、K+、Cl-和NO四种离子。若将一定浓度的硝酸钠和氯化钾混合溶液加热至沸腾,使溶液浓缩,将有NaCl晶体析出。趁热过滤,即可分离出NaCl晶体。将滤液冷却至室温,可使KNO3晶体析出。经减压过滤分离出的硝酸钾粗产品可用重结晶法加以提纯。 2.结晶和重结晶 结晶是溶质从溶液中析出晶体的过程,其原理是根据混合物中各成分在某种溶剂里溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度减小,从而使晶体析出,分为蒸发结晶和冷却结晶。 将第一次结晶得到的晶体溶于少量溶剂中,然后再进行蒸发(或冷却)、结晶、过滤,如此反复的操作称为重结晶。 3.影响晶粒生成的条件 - 8 - 晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越高,或溶剂的蒸发速率越快,或溶液冷却得越快,析出的晶粒就越细小。在实际操作中,常根据需要,控制适宜的结晶条件,以得到大小合适的晶体颗粒。 当溶液发生过饱和现象时,振荡容器,用玻璃棒搅动或轻轻地摩擦器壁,或投入几粒晶体(晶种),都可促使晶体析出。 思考1:如果要制备颗粒较大的硝酸钾晶体,应该怎样选择结晶条件? 提示 溶质的溶解度越大,或溶液的浓度越小,或溶剂蒸发速率越慢,或溶液冷却得越慢,析出的晶粒就越大。 二、硝酸钾晶体的制备实验步骤 1.固体溶解 称取NaNO3 20 g,KCl 17 g,加入35 mL蒸馏水,加热至沸腾并不断搅拌,使固体溶解,在小烧杯外壁标注液面位置。用到的仪器:烧杯、玻璃棒、三脚架、石棉网、酒精灯。 2.蒸发、热过滤 继续加热、搅拌,使溶液蒸发浓缩,氯化钠晶体逐渐析出。当溶液体积减小到约为原来的一半时,迅速趁热过滤。承接滤液的烧杯应预先加2 mL蒸馏水,以防降温时氯化钠溶液达饱和而析出。用到的仪器及用品:铁架台、石棉网、烧杯、酒精灯、玻璃棒、漏斗、滤纸。 3.冷却、减压过滤 待滤液冷却至室温,进行减压过滤得到较干燥的粗产品硝酸钾晶体。用到的仪器及用品:布氏漏斗、滤纸、吸滤瓶、安全瓶、抽气泵。 思考2:冷却、减压过滤得到的KNO3晶体纯度如何?主要含有什么杂质? 提示 冷却、减压过滤得到的是KNO3粗产品,含有NaCl杂质。 4.重结晶 留下约0.1 g粗产品(作纯度对比检验用),其余按粗产品、水的质量比为2∶1混合,配成溶液,加热、搅拌,待晶体全部溶解后停止加热(若溶液沸腾时晶体还未全部溶解,可再加入少量蒸馏水使其溶解)。等溶液冷却至室温有大量晶体析出后减压过滤,得到较高纯度的硝酸钾晶体。 5.称量 晶体用干燥的滤纸吸干,放在表面皿上称量,并观察其外观。分别取0.1 g粗产品和重结晶后得到的硝酸钾晶体放入两支小试管中,各加入2 mL蒸馏水配成溶液。 6.检验Cl- 向溶液中分别滴入1滴1 mol·L-1 HNO3溶液酸化,再各滴入2滴0.1 mol·L-1 AgNO3溶液,观察到的现象是粗产品、重结晶产品的溶液中产生浑浊的程度不同。 - 8 - 点拨一、硝酸钾晶体制备的理论依据 1.化学反应:转化法制备KNO3的化学方程式为NaNO3+KClKNO3+NaCl,这是一个平衡移动的过程,利用KNO3的结晶控制化学反应的方向。 2.制备原理: (1)盐的溶解度随温度的变化如下图。 可以看出,NaNO3、KNO3、NaCl、KCl四种盐的溶解度在不同温度下的差别是非常显著的。NaCl的溶解度随温度变化不大,NaNO3、KCl有明显变化,而硝酸钾的溶解度随温度的升高急剧增大。 (2)加热蒸发时的一系列变化。 点拨二、减压过滤 减压过滤:为了加快过滤速度,得到较干燥的沉淀,可进行减压过滤。 1.装置 减压过滤操作需要用到的主要仪器有布氏漏斗、吸滤瓶、安全瓶、抽气泵。其基本装置如图所示。 - 8 - 2.原理 装置中抽气泵给吸滤瓶减压,造成瓶内与布氏漏斗液面上产生压力差,从而加快过滤速度。吸滤瓶用于承接滤液,安全瓶用于防止水泵中水产生溢流而倒灌入吸滤瓶中。 3.操作方法 (1)剪滤纸:取一张大小适中的滤纸,在布氏漏斗上轻压一下,然后沿压痕内径剪成圆形,此滤纸放入漏斗中,应是平整无皱折,且将漏斗的小孔全部盖严。注意滤纸不能大于漏斗底面。 (2)将滤纸放在漏斗中,以少量蒸馏水润湿,然后把漏斗安装在吸滤瓶上(尽量塞紧),微开水龙头,抽滤使滤纸贴紧。 (3)以玻璃棒引流,将待过滤的溶液和沉淀逐步转移到漏斗中,加溶液速度不要太快,以免将滤纸冲起。随着溶液的加入,水龙头要开大。注意布氏漏斗中的溶液不得超过漏斗容量的2/3。 (4)过滤完成(即不再有滤液滴出)时,先拔掉吸滤瓶侧口上的胶管,然后关掉水龙头。 (5)用搅拌棒轻轻揭起滤纸的边缘,取出滤纸及其上面的沉淀物。滤液则由吸滤瓶的上口倒出。 注意吸滤瓶的侧口只作连接减压装置用,不要从侧口倾倒滤液,以免弄脏溶液。如果实验中要求洗涤沉淀,洗涤方法与使用玻璃漏斗过滤时相同,但不要使洗涤液过滤太快(适当关小水龙头),以便使洗涤液充分接触沉淀,使沉淀洗得更干净。 点拨三、粗盐提纯的实验设计 思路分析:粗盐提纯步骤: 溶解→除杂→过滤→结晶→洗涤 实验设计 实验步骤 实验现象 结论与解释 ①取样 固体溶解 加热可加快溶解速度 - 8 - ②除 SO 有白色沉 淀生成 加稍过量BaCl2溶液以除去SO杂质。 Ba2++SO===BaSO4↓ ③除Ca2+、 Mg2+、Ba2+ 有白色沉 淀生成 除去Mg2+、Ca2+、Ba2+。 Mg2++2OH-===Mg(OH)2↓、 Ca2++CO===CaCO3↓,Ba2++CO===BaCO3↓ ④中和 有少量气 泡产生; pH试纸 变浅红色 除去过量的CO等。 CO+2H+===H2O+CO2↑、 OH-+H+===H2O ⑤结晶 有大量晶 体析出 ⑥检验 无明显 变化 产品中不含SO [典例剖析] 请填写下列空白。 步骤 操作 具体操作步骤 现象解释结论等 ① 溶解 取20克NaNO3和17 g KCl溶解在35 mL水中,加热至沸,并不断搅拌 NaNO3和KCl溶于水后产生四种离子,这四种离子可能组成四种物质______、______、________、________ ② 蒸发 继续加热搅拌,使溶液蒸发浓缩 有________晶体析出 ③ 当溶液体积减少到约为原来的一半时,迅速趁热过滤 滤液中的最主要成分为________ ④ 冷却 将滤液冷却至室温 有________晶体析出。尚有少量的________析出 - 8 - ⑤ 按有关要求进行操作 得到粗产品硝酸钾晶体(称量为m1) ⑥ 将得到的粗产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤 得到纯度较高的硝酸钾晶体(称量为m2) ⑦ 检验 分别取⑤、⑥得到的产品,配制成溶液后分别加入1滴1 mol/L的HNO3溶液和2滴0.1 mol/L的AgNO3溶液 可观察到⑤、⑥产品中出现的现象分别是________________________________ (1)检验所得产品中是否有Cl-的目的是_____________________________ _______________________________________________________________。 结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为____________ __________________________________________________。(不考虑损失) (2)步骤③过滤使用了保温漏斗,用如下图所示装置,其主要作用是_____________________________________________________________。 (3)步骤③过滤装置如下图所示,采用这种装置过滤的主要优点是_______________________________________________________________。 这种装置工作的主要原理是_________________________________________ ______________________________________________________________。 解析 因为NaNO3、KCl、KNO3在高温时具有较大的溶解度,温度降低时,NaNO3 - 8 - 、KCl的溶解度明显减小,而KNO3的溶解度则急剧下降;NaCl的溶解度随温度变化不大,据此可知,蒸发溶剂首先结晶出的是NaCl,冷却结晶出的是KNO3;经初次结晶出的KNO3产品中仍有少量的氯离子杂质,加入硝酸银溶液后产生白色沉淀。 答案 ①NaNO3 KCl KNO3 NaCl ②NaCl ③KNO3 ④KNO3 NaCl ⑦⑤中有白色沉淀生成,⑥中无明显现象 (1)鉴定得到的产品是否纯净 ×100% (2)在热过滤时,防止NaCl结晶析出 (3)过滤速度较快;可以得到比较干燥的固体 当自来水龙头打开时,把装置内部的气体随水流带走,导致装置内部的压强降低,使过滤的速度加快 [跟踪训练] 工业废铁屑表面常有铁锈(成分为Fe2O3),并沾有油污。某校研究性学习小组设计实验方案,按以下①~④步骤用废铁屑制备绿矾(FeSO4·7H2O)晶体。 废铁屑铁屑溶液(留有少量铁屑)滤液绿矾晶体 根据该实验方案,回答下列问题: (1)步骤①中废铁屑与NaOH溶液共热的目的是______________________ _______________________________________________________________。 (2)步骤②中烧杯底部留有少量铁屑的理由是_________________________ _______________________________________________________________。 说明剩余铁屑作用的离子方程式为________________________________ ______________________________________________________________。 - 8 - (3)在步骤③中,该小组采用如图抽气过滤(减压过滤)装置代替普通漏斗,其目的是___________________________________________________________; _____________________________________________________________。 (4)检查步骤③的滤液中没有Fe3+的方法是___________________________ _______________________________________________________________。 解析 制备FeSO4·7H2O晶体,关键是要避免Fe2+被空气氧化,利用抽气过滤,可提高过滤速率,趁热过滤还可以防止FeSO4结晶。 答案 (1)除去铁屑表面的油污 (2)防止Fe2+被氧化为Fe3+ 2Fe3++Fe===3Fe2+ (3)使吸滤瓶内的压强减小,提高过滤的速率;减少滤液与空气的接触,避免Fe2+被氧化 (4)取少许滤液,加入KSCN溶液,无血红色出现 归纳总结 抽滤操作注意事项 (1)漏斗下端斜口正对吸滤瓶支管; (2)滤纸要比漏斗底部略小且把孔覆盖; (3)过滤前先用蒸馏水润湿滤纸,抽气使滤纸紧紧贴在漏斗上; (4)把过滤混合物均匀分布在整个滤纸面上; (5)用少量滤液将黏附在容器壁上的晶体洗出,继续抽气,并用玻璃棒挤压晶体,尽量除去母液。 - 8 -查看更多