河北省沧州一中2019-2020学年高一下学期期末考试化学试题 Word版含答案
沧州一中 2019-2020 学年度高一年级下学期期末考试(化学)
命题人:李 静 审题人:高一化学组可能用到相对原子质量为:H:1 C:12 N:14 O:16 Ag:108
一、单项选择题(1-15 题,每题 2 分,共 30 分)
1.为纪念元素周期表诞生 150 周年,联合国将 2019 年定为“国际化学元素周期表年”。编制出第一张元素周期表的科学家是( )
A.门捷列夫 B.达尔文 C.牛顿 D.波义耳
2.2020 年是沧州市创建全国文明城市决胜之年。下列做法不应提倡的是( )
A.拒绝露天烧烤,合理健康饮食 B.施行垃圾分类,有效节约资源
C.推广电动汽车,践行绿色交通 D.秸秆就地焚烧,增强土壤肥效
3.科学家发现 C60 后,近年又合成了许多球形分子(富勒烯),如 C50、C70、C120、C540 等,它们互称为 ( )
A.同系物 B.同素异形体
C.同分异构体
D.同位素
4.下列属于放热反应的是 ( )
A.硝酸铵溶于水 B.氨气液化5.下列有关化学用语表示正确的是(
)
C.碳酸钙分解
D.镁条溶于盐酸
A. 次氯酸的电子式: B. Mg 原子的结构示意图:
C. 硫化钠的电子式: D. 的结构示意图为
6.下列说法不正确的是( )
A. CCl4、SiO2 都存在共价键,都是共价化合物
B.某物质在熔融状态能导电,则该物质中不一定含有离子键
C. H2O 比 H2S 稳定是因为 H2O 分子之间存在氢键
D. SO2 溶于水时,需克服共价键和分子间作用力
第 8 页,共 7 页
7.下列叙述正确的是( )
A. 电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应
B. 铅蓄电池放电时,负极质量减轻,正极质量增加
C. 马口铁(镀锡铁)镀层破损后还可以起到保护作用
D. 钢铁发生电化学腐蚀的负极反应式:Fe-2e- == Fe2+
8.下列微粒半径大小比较正确的是( )
A. Na
Cl->Na+> Mg2+ D. Na+X>Z B. X>Z>Y C. X>Y>Z D. Y>Z>X
11.反应 2CO(g)+2NO(g) 2CO2(g)+N2(g),下列反应条件的改变对该反应速率的影响正确的是A.升高温度能减慢反应速率 B.增大反应物浓度能加快反应速率 C.达到平衡时,CO 能 100%转化为 CO2 D.使用催化剂能减慢该反应的速率
12.把 6 mol A 气体和 5 mol B 气体混合充入 4 L 密闭容器中,在一定条件下发生反应:3A(g)+
B(g) 2C(g)+xD(g),经 5 s 达到平衡,此时生成 C 为 2 mol ,测得 D 的平均反应速率为 0.1 mol·L
-1·s -1,下列说法错误的是( )
A. x=2 B. B 的转化率为 20%
C. 平衡时 A 的浓度为 0.75 mol·L -1 D. 恒温达到平衡时容器内的压强为开始的 75%
13. 50mL0.5mol/L 盐酸与 50mL0.55mol/LNaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
A 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
B. 大烧杯上如不盖硬纸板,测得的中和热数值会偏大
C. 用相同浓度和体积的氨水代替 NaOH 溶液进行上述实验,测得中和热的数值会偏大
第 8 页,共 7 页
B. 实验中改用 60mL0.5mol/L 盐酸跟 50mL0.55mol/LNaOH 溶液进行反应,与上实验相比,所放出
的热量不相等,但是所求中和热相等
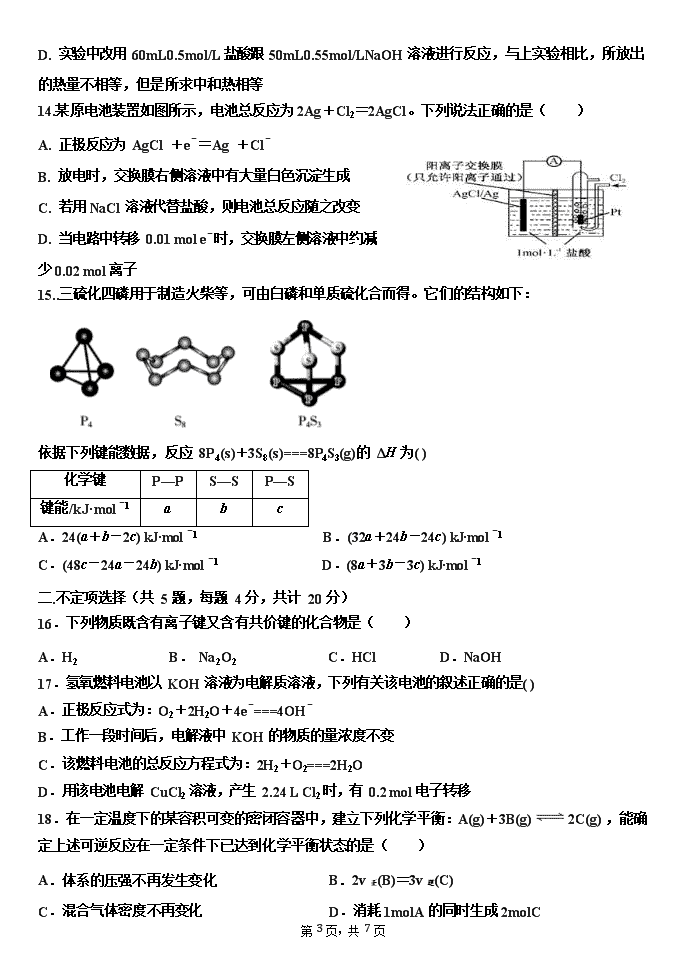
14.某原电池装置如图所示,电池总反应为 2Ag+Cl2=2AgCl。下列说法正确的是( )
A. 正极反应为 AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用 NaCl 溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移 0.01 mol e-时,交换膜左侧溶液中约减少 0.02 mol 离子
15..三硫化四磷用于制造火柴等,可由白磷和单质硫化合而得。它们的结构如下:
依据下列键能数据,反应 8P4(s)+3S8(s)===8P4S3(g)的 ΔH 为( )
化学键
P—P
S—S
P—S
键能/kJ·mol -1
a
b
c
A.24(a+b-2c) kJ·mol -1 B.(32a+24b-24c) kJ·mol -1
C.(48c-24a-24b) kJ·mol -1 D.(8a+3b-3c) kJ·mol -1
二.不定项选择(共 5 题,每题 4 分,共计 20 分)
16.下列物质既含有离子键又含有共价键的化合物是( )
A.H2 B. Na2O2 C.HCl D.NaOH 17.氢氧燃料电池以 KOH 溶液为电解质溶液,下列有关该电池的叙述正确的是( ) A.正极反应式为:O2+2H2O+4e-===4OH- B.工作一段时间后,电解液中 KOH 的物质的量浓度不变
C.该燃料电池的总反应方程式为:2H2+O2===2H2O D.用该电池电解 CuCl2 溶液,产生 2.24 L Cl2 时,有 0.2 mol 电子转移
18.在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:A(g)+3B(g) 2C(g) ,能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
A.体系的压强不再发生变化 B.2v 正(B)=3v 逆(C)
C.混合气体密度不再变化 D.消耗 1molA 的同时生成 2molC
第 8 页,共 7 页
19. 下列图示中关于铜电极的连接错误的是( )
A. 铜锌原电池 B. 电解精炼铜
C. 镀件上镀铜 D. 电解氯化铜溶液
20. 下列各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是 ( )
A.4>2>1>3>5>6 B.4>6>2>1>3>5 C.5>4>2>3>1>6 D.6>3>5>2>4>1
三、填空题(共 4 道大题,50 分)
21.(10 分)现有下列短周期元素的数据(已知 Be 的原子半径为 0.089 nm):
①
②
③
④
⑤
⑥
⑦
⑧
原子半
径/nm
0.074
0.160
0.152
0.110
0.099
0.186
0.075
0.082
最高正
化合价
+2
+1
+5
+7
+1
+5
+3
最低负
化合价
-2
-3
-1
-3
(1)⑧号元素在周期表中的位置是 ; 写出⑤的原子结构示意图 。
(2)元素①和⑥能形成两种化合物,写出其中原子个数为 1:1 的化合物与水反应的离子方程式: 。用电子式表示①和⑥形成的另一种化合物的形成过程 。
(3)含锂材料在社会中广泛应用,根据下列要求回答问题:
第 8 页,共 7 页
6Li 和7Li 作核反应堆最佳热载体,7LiH 和7LiD 用作高温堆减速剂。下列说法正确的是 (填字
3 3 3 3
母,下同)。
A.6Li 和7Li 互为同位素 B.6Li 和7Li 属于同种核素
3 3 3 3
C.7LiH 和7LiD 的化学性质不同 D.7LiH 和7LiD 是同种物质
3 3 3 3
22.(14 分)已知 31g 白磷变为 31g 红磷释放能量。试回答:
(1)上述变化属于 (填“物理”或“化学”)变化。常温常压下,白磷与红磷更稳定的是 。
(2)甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
1
第 8 页,共 7 页
②CH3OH(l)+
2
�O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
第 8 页,共 7 页
Ⅰ.表示甲醇完全燃烧热的的热化学方程式为 ; Ⅱ.反应②中的能量变化如图所示,则 ΔH2= 。(用 E1、
E2 的相关式子表示);
(3)捕碳技术(主要指捕获 CO2 在降低温室气体排放中具有重要的作用。目前 NH3 和(NH4)2CO3 已经被用作工业捕碳剂,它们与 CO2 可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) △H1 反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) △H2
反应Ⅲ: (NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) △H3
则 ΔH3 与 ΔH1 、ΔH2 与之间的关系为 ΔH3 = ;
(4) 已知反应 N2(g)+3H2(g) 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算 a 的值
_。(注明“+”或“﹣”)。
化学键
H﹣H
N﹣H
N≡N
键能/kJ/mol
436
391
945
(5)1mol H2 和 1molCH4 完全燃烧放出的热量分别为:286kJ、890kJ,等质量的 H2 和 CH4 完全燃烧放出的热量, (填化学式)放出的热量多。
23.(12 分)某温度下,在一个 2L 的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
第 8 页,共 7 页
(1)从开始至 2min,Y 的平均反应速率为 。
(2)该反应的化学方程式为 。
(3)1min 时,ν(逆) ν(正),3min 时,ν(正) ν(逆).(填“大于”或“小于”或“等于”)
(4)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(X)=9mol•L-1min-1,乙中 v(Y)
=0.5mol•L-1s-1,则 中反应更快。
(5) 若 X、Y、Z 均为气体(容器体积不变),下列能说明反应已达平衡的是 。
a.X、Y、Z 三种气体的浓度不再改变 b.气体混合物物质的量不再改变c.反应已经停止 d.反应速率 w(X):v(Y)=3:1 e.(单位时间内消耗 X 的物质的量):(单位时间内消耗 Z 的物质的量)=3:2
f.混合气体的密度不随时间变化.
24. (14 分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量), 当闭合该装置的电键 K 时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)乙池为 _(填“原电池”、“电解池”或“电镀池”),B 电极的电极反应式为 。
(2)丙池中 E 电极为 (填“正极”、“负极”、“阴极”或“阳极”),电极的电极反应式为
。该池总反应的化学方程式为 。
(3)当乙池中 C 极质量减轻 54 g 时,甲池中 B 电极理论上消耗 O2 的为 L(标准状况)。
(4)一段时间后,断开电键 K,下列物质能使丙池恢复到反应前浓度的是 (填选项字母)。A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
第 8 页,共 7 页
高一年级下学期考试(7.12)答案
一、选择题:(共 50分)
1.单选(1-15题,每题2分,共30分)2.不定项选择(16-20每题4分,共20分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
D
B
D
A
C
D
C
D
A
题号
11
12
13
14
15
16
17
18
19
20
答案
B
D
D
D
A
BD
AC
BC
C
B
三、非选择题(共50分)
21.(10分,每空2分)
(1)第二周期ⅢA族 (2分) (2分)
(2)2Na2O2+2H2O===4Na++4OH-+O2↑(2分)
(2分)
(3)①AD(2分)
22.(14分,每空2分)
(1)化学;(2分) 红磷(2分)
(2)Ⅰ. CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ/mol (2分)
Ⅱ. E1-E2 (2分) (3) 2△H2-△H1 (2分) (4) -93 (2分) (5)H2(2分)
23.(12分,每空2分)
(1)0.025mol•L-1•min-1(2分) (2)3X+Y2Z (2分)
(3)小于(2分) ;等于(2分) (4)乙(2分) (5)abe(2分)
24. (14分,每空2分)
(1)电解池 (2分) (2) O2 +4e-+2H2O = 4OH- (2分)
(3) 阳极 (2分) (4) 2H2O-4e-= O2↑+4H+ (2分)
(5) 2CuSO4 + 2H2O2Cu +O2↑+2H2SO4 (2分)
(6)2.8 (2分) (7) B(2分)
第 8 页,共 7 页
第 8 页,共 7 页