- 2021-08-06 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高二人教版化学选修三练习:1_2_1 原子结构与元素周期表含答案
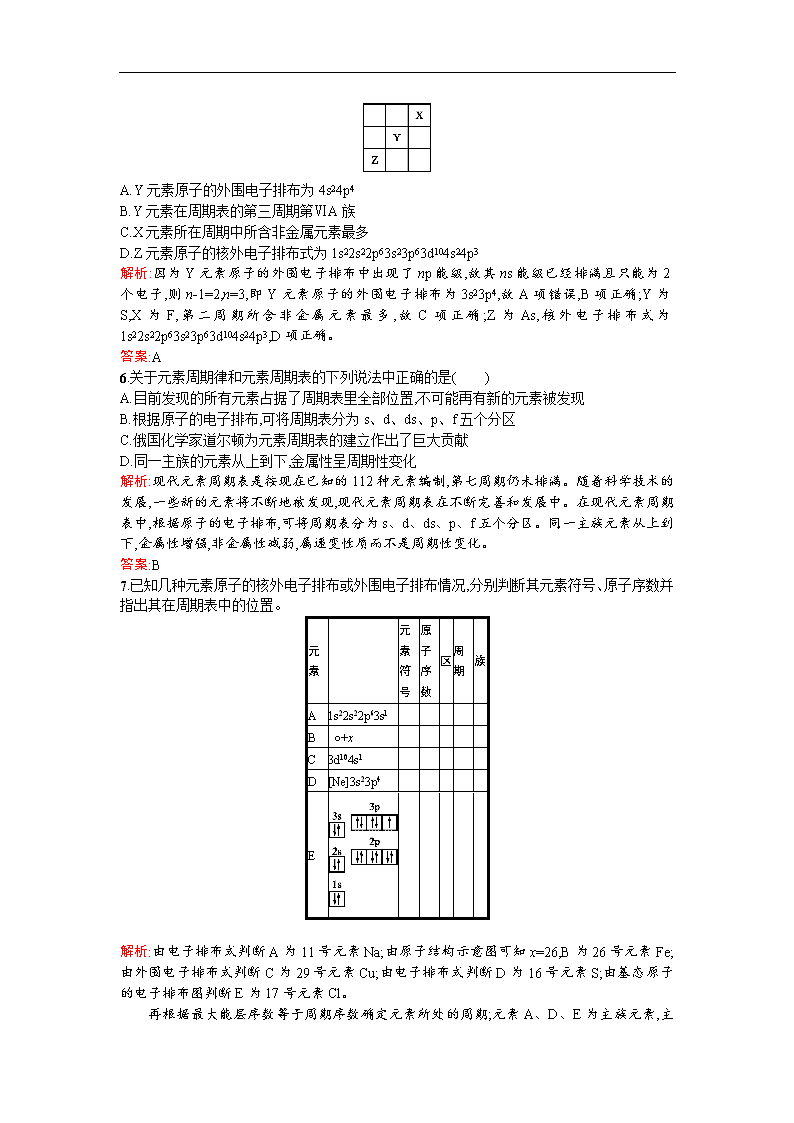
第二节 原子结构与元素的性质 第一课时 原子结构与元素周期表 课时演练·促提升 A组 1.下列说法中正确的是( ) A.s区都是金属元素 B.s区都是非金属元素 C.0族在p区 D.所有非金属元素都在p区 解析:s区中氢是非金属元素,其他都是金属元素,A、B、D三项均错误。 答案:C 2.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( ) A.电子排布式为1s22s22p63s23p63d34s2 B.该元素为V C.该元素为第ⅡA族元素 D.该元素位于d区 解析:该元素为同族元素中原子序数最小的元素,所以该元素为第二周期或第四周期元素。又因其价电子数≠最外层电子数,可推出该元素并不是第二周期元素,应为第四周期元素,价电子排布式为3d34s2,故为23号元素V,d区元素。 答案:C 3.在元素周期表里,金属与非金属元素附近能找到( ) A.制半导体的元素 B.制农药的元素 C.制催化剂的元素 D.制耐高温合金的元素 解析:半导体材料都是周期表中金属与非金属元素交界处的元素。 答案:A 4.下列说法不正确的是( ) A.元素原子的核外电子排布呈现周期性变化是形成元素周期系的根本原因 B.周期序数越大,该周期所含金属元素越多 C.所有区的名称均来自按构造原理最后填入电子的能级符号 D.周期表共18个纵列,可分为7个主族,7个副族,1个第Ⅷ族,1个零族 解析:除ds区外,区的名称均来自按构造原理最后填入电子的能级符号。 答案:C 5.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布为nsn-1npn+1,则下列说法不正确的是( ) A.Y元素原子的外围电子排布为4s24p4 B.Y元素在周期表的第三周期第ⅥA族 C.X元素所在周期中所含非金属元素最多 D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 解析:因为Y元素原子的外围电子排布中出现了np能级,故其ns能级已经排满且只能为2个电子,则n-1=2,n=3,即Y元素原子的外围电子排布为3s23p4,故A项错误,B项正确;Y为S,X为F,第二周期所含非金属元素最多,故C项正确;Z为As,核外电子排布式为1s22s22p63s23p63d104s24p3,D项正确。 答案:A 6.关于元素周期律和元素周期表的下列说法中正确的是( ) A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 B.根据原子的电子排布,可将周期表分为s、d、ds、p、f五个分区 C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 D.同一主族的元素从上到下,金属性呈周期性变化 解析:现代元素周期表是按现在已知的112种元素编制,第七周期仍未排满。随着科学技术的发展,一些新的元素将不断地被发现,现代元素周期表在不断完善和发展中。在现代元素周期表中,根据原子的电子排布,可将周期表分为s、d、ds、p、f五个分区。同一主族元素从上到下,金属性增强,非金属性减弱,属递变性质而不是周期性变化。 答案:B 7.已知几种元素原子的核外电子排布或外围电子排布情况,分别判断其元素符号、原子序数并指出其在周期表中的位置。 元素 元素 符号 原子 序数 区 周期 族 A 1s22s22p63s1 B ○+x C 3d104s1 D [Ne]3s23p4 E 解析:由电子排布式判断A为11号元素Na;由原子结构示意图可知x=26,B为26号元素Fe;由外围电子排布式判断C为29号元素Cu;由电子排布式判断D为16号元素S;由基态原子的电子排布图判断E为17号元素Cl。 再根据最大能层序数等于周期序数确定元素所处的周期;元素A、D、E为主族元素, 主族元素的价电子总数等于主族序数;C元素的外围电子排布式为3d104s1,s能级电子数为1,应为ds区的第ⅠB族。 答案:A:Na 11 s 三 ⅠA B:Fe 26 d 四 Ⅷ C:Cu 29 ds 四 ⅠB D:S 16 p 三 ⅥA E:Cl 17 p 三 ⅦA 8.已知元素周期表中共有18个纵行,下表实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自按构造原理最后填入电子的能级符号。 (1)请在上表中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影和表示d区和ds区。 (2)有的同学受这种划分的启发,认为d区内和6、7纵行的部分元素可以排在另一区,你认为应排在 区。 (3)请在元素周期表中用元素符号标出4s轨道半充满状态的元素。 解析:本题从深层次上考查了元素周期表的结构。依据构造原理最后填入的电子的能级符号将元素周期表划分为几个区。对于24号元素,其核外价电子排布根据构造原理应该是3d44s2,而实际上是3d54s1,原因是能量相同的轨道处于全空、全充满和半充满状态时能量较低,而29号元素也正是因为这一点排成3d104s1,而不是3d94s2,故将29号、30号元素所在纵行归为ds区。所以该同学认为d区内6、7纵行的部分元素可以排在ds区是有道理的。 答案:(1) (2)ds (3)见上表 9.X、Y、Z是第ⅠA~ⅦA族的三种非金属元素,它们在周期表中的位置如图所示。 X Y Z 试回答: (1)X元素单质的化学式是 。 (2)Y元素的原子结构示意图是 。Y与Na所形成化合物的电子式为 。 (3)Z元素的名称是 ,从元素原子得失电子的角度看,Z元素具有 性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是 ,其价电子排布式为 。 解析:在元素周期表中,非金属位于元素周期表中的右上方,三种元素均为非金属元素,必位于ⅤA、ⅥA、ⅦA三个主族,则可认定X必为氟,Y为硫,Z为砷。 答案:(1)F2 (2) +16 Na+[∶∶]2-Na+ (3)砷 金属性和非金属(或两) Z位于元素周期表中金属元素与非金属元素交界线附近 4s24p3 B组 1.已知某元素+3价离子的电子排布式为 1s22s22p63s23p63d5,该元素在周期表中的位置是( ) A.第三周期第Ⅷ族,p区 B.第三周期第ⅤB族,ds区 C.第四周期第Ⅷ族,d区 D.第四周期第ⅤB族,f区 解析:+3价离子的核外有23个电子,则原子核外有26个电子,26号元素是铁,位于第四周期第Ⅷ族,位于d区。 答案:C 2.下列四种元素中,其单质氧化性最强的是( ) A.原子含有未成对电子最多的第二周期元素 B.位于元素周期表中第三周期第ⅢA族的元素 C.原子最外层电子排布式为2s22p6的元素 D.原子最外层电子排布式为2s22p5的元素 解析:A项,含未成对电子最多的第二周期元素为N,B项为Al,C项为Ne,D项为F,故F2的氧化性最强。 答案:D 3.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( ) A.X的氢化物溶于水显酸性 B.Y原子的电子排布式为1s22s22p63s2 C.Z元素在周期表中的位置为第三周期第Ⅵ族 D.X和Z的最高价氧化物对应水化物都是弱酸 解析:Z原子最外层电子数是X原子内层电子数的3倍,则X原子内层应为2个电子,Z原子最外层电子数为6,根据题意,Z应在第三周期,所以Z为S。Z原子最外层电子数为Y原子最外层电子数的3倍,且Y、Z同周期,Y为Mg。根据题意,X为N。 答案:B 4.有四种短周期元素,它们的结构、性质等信息如表所述。 元素 结构、性质等信息 A A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是快中子反应堆的导热剂 B B与A同周期,其最高价氧化物的水化物呈两性 C 元素的气态氢化物极易溶于水,可用作制冷剂 D D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 请根据表中信息填写: (1)A原子的核外电子排布式: 。 (2)B元素在周期表中的位置: ;离子半径:B A(填“大于”或“小于”)。 (3)C原子的核外电子排布图是 ,其原子核外有 个未成对电子,能量最高的电子为 轨道上的电子,其电子云形状呈 形。 (4)D原子的核外电子排布式为 ,D-的结构示意图是 。 解析:根据题中信息可推出:A为Na,B为Al,C为N,D为Cl。 (1)Na核外电子排布式为1s22s22p63s1。 (2)B为Al,其在元素周期表中的位置为第三周期ⅢA族,Na+与Al3+核外电子排布相同,核电荷数Al3+大于Na+,故r(Al3+)查看更多
相关文章
- 当前文档收益归属上传用户