- 2021-08-06 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年海南省东方市八所中学高一下学期期中考试化学试题
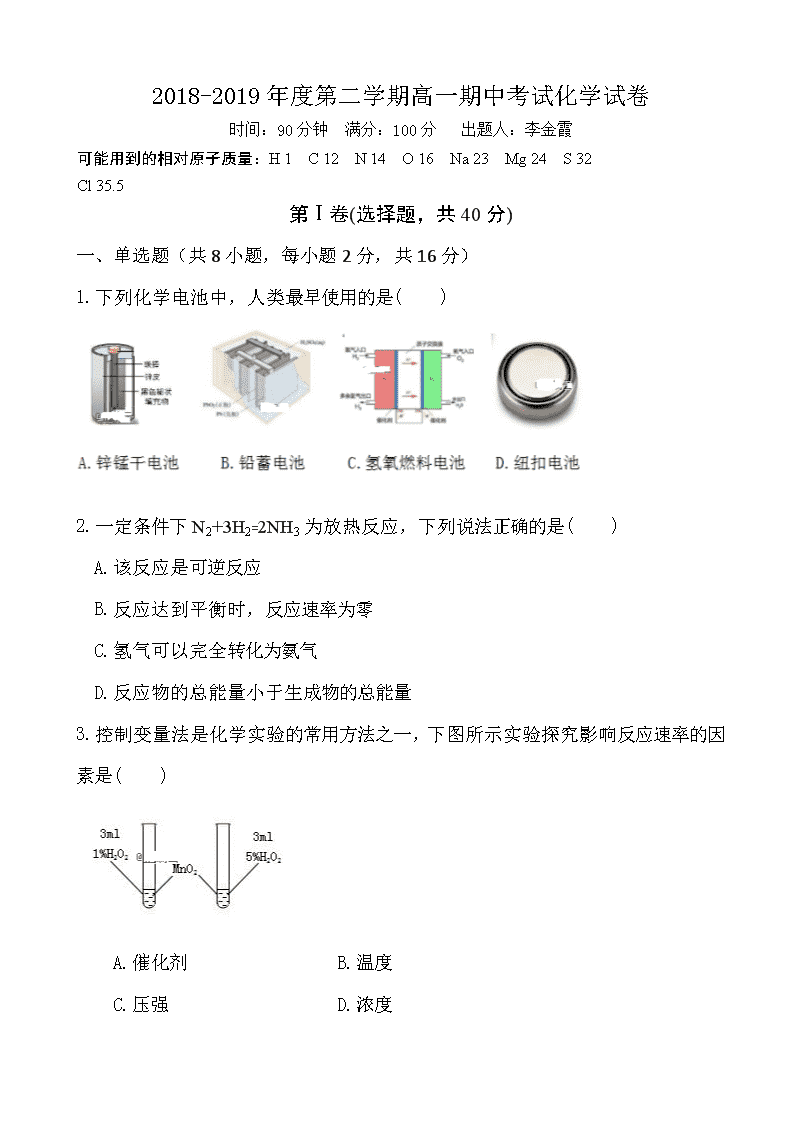
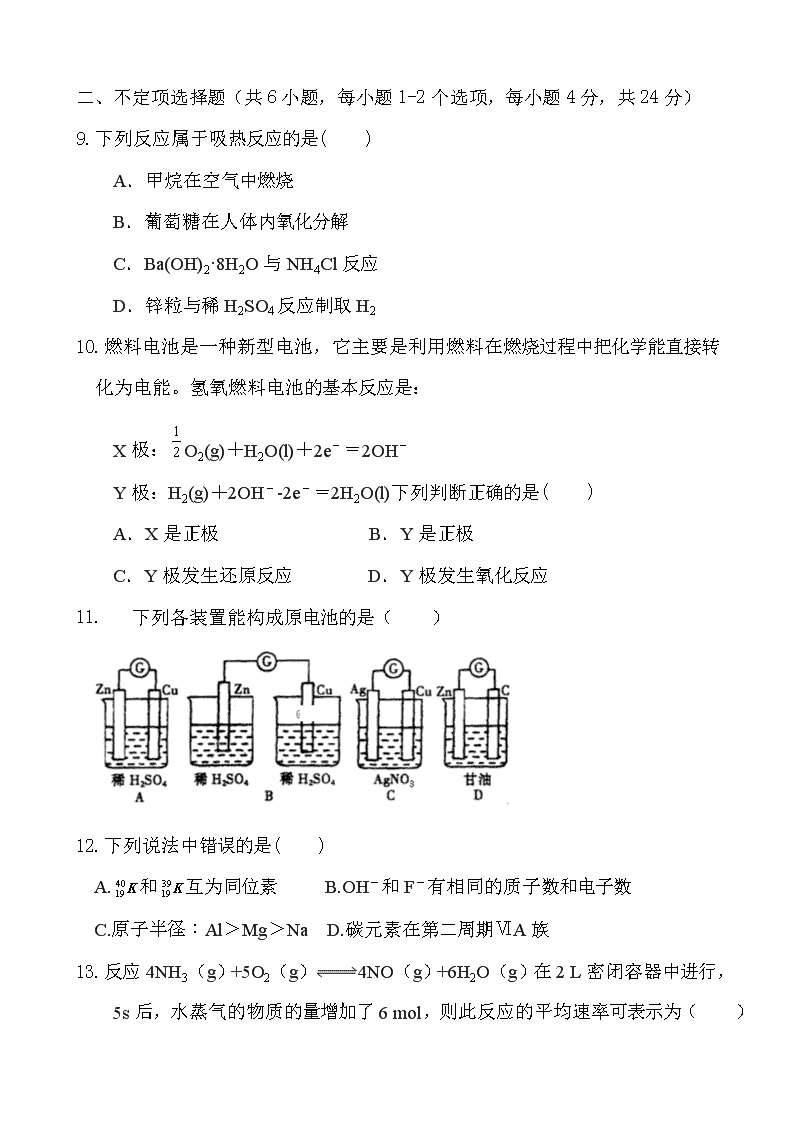
2018-2019年度第二学期高一期中考试化学试卷 时间:90分钟 满分:100分 出题人:李金霞 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Cl 35.5 第Ⅰ卷(选择题,共40分) 一、 单选题(共8小题,每小题2分,共16分) 1.下列化学电池中,人类最早使用的是( ) 2.一定条件下N2+3H2=2NH3为放热反应,下列说法正确的是( ) A.该反应是可逆反应 B.反应达到平衡时,反应速率为零 C.氢气可以完全转化为氨气 D.反应物的总能量小于生成物的总能量 3.控制变量法是化学实验的常用方法之一,下图所示实验探究影响反应速率的因素是( ) A.催化剂 B.温度 C.压强 D.浓度 4.下列物质中,属于有机物但不属于烃的是( ) A.CO2 B.CH3Cl C.Na2CO3 D.CH4 5.右图为甲烷分子的球棍模型,空间构型是( ) A.直线型 B.平面六边形 C.正四面体 D.平面四边形 6.下列有机物与异丁烷互为同分异构体的是( ) A.CH3CH3 B.CH3CH2CH3 C.CH3CH2CH2CH3 D.CH3CH2CH2CH2CH3 7.以下各说法中错误的是( ) A.丙烷是甲烷的同系物 B.甲烷能与氯气在光照条件下发生取代反应 C.甲烷分子中四个C-H键是完全等价的键 D.乙烷属于离子化合物 8.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的活动性由强到弱的顺序是( ) A.d、c、a、b B.d、a、b、c C.d、b、a、c D.b、a、d、c 一、 不定项选择题(共6小题,每小题1-2个选项,每小题4分,共24分) 9.下列反应属于吸热反应的是( ) A.甲烷在空气中燃烧 B.葡萄糖在人体内氧化分解 C.Ba(OH)2·8H2O与NH4Cl反应 D.锌粒与稀H2SO4反应制取H2 10.燃料电池是一种新型电池,它主要是利用燃料在燃烧过程中把化学能直接转化为电能。氢氧燃料电池的基本反应是: X极:O2(g)+H2O(l)+2e-=2OH- Y极:H2(g)+2OH--2e-=2H2O(l)下列判断正确的是( ) A.X是正极 B.Y是正极 C.Y极发生还原反应 D.Y极发生氧化反应 11. 下列各装置能构成原电池的是( ) 12.下列说法中错误的是( ) A.和互为同位素 B.OH-和F-有相同的质子数和电子数 C.原子半径:Al>Mg>Na D.碳元素在第二周期ⅥA族 13.反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( ) A.ν(H2O)=0.6 mol/(L·S) B.ν(O2)=0.72 mol/(L·S) C.ν(NO)==0.9 mol/(L·S) D.ν(NH3)=0.4 mol/(L·S) 14.在一容积固定的密闭容器中,可逆反应H2(g)+I2(g) 2HI(g)达到平衡时的标志是( ) A.混合气体密度恒定不变 B.混合气体的颜色不再改变 C.H2、I2、HI的浓度相等 D.I2在混合气体中体积分数不变 第Ⅱ卷 非选择题(共60分) 一、 填空题 15.(12分)原电池反应的本质是____________,直接把_____能转变为_____能,电子由____极(填“正”或“负”)经导线流向____极(填“正”或“负”);在铜锌原电池中,以稀硫酸为电解质溶液,铜片上观察到的现象是 ,锌为 极,电极上发生的是 反应(填“氧化”或“还原”),电极反应式为 ,溶液中的SO42-和H+的移动方向是 。 16.(12分)在下列事实中,各是什么因素影响了化学反应的速率。(1)黄铁矿煅烧时要粉碎成细小颗粒 ; (2)夏天的食品变霉,在冬天不易发生该现象 ; (3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体快慢程度不同______________________; (4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同 ; (5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体 ; (6)如下图,铁在海水中的腐蚀速度是②比①快 _____________________。 17.(10分)一定温度下,在2L容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,由图中数据分析,反应物是____,t2时,N的浓度是_______________;若t2=1 min,从反应开始到t2 ,M的平均反应速率为 ; 该反应的化学方程式为 ;在反应达到化学平衡时,各组分的浓度保持______(填“相等”或“不变”)且_______(填“一定”或“不一定”相等,各物质的反应速率之比_______(填“一定”或“不一定”)等于化学计量数之比。 18.(12分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白: 主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0族 2 ① ② ③ 3 ④ ⑤ ⑥ ⑦ ⑧ 4 ⑨ (1) 在这些元素中,化学性质最不活泼的是: (填元素符号),原子结构示意图为___________________ 。 (2) 在最高价氧化物的水化物中,酸性最强的化合物的化学式是_______,碱性最强的化合物的电子式是:_____________。 (3) 用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。 (4) 表示①与H的化合物的化学式 ,该化合物是由 (填“极性”“非极性”)键形成的。 19.(8分)根据组成原电池的条件,试以反应:Fe+Cu2+==Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在右边方框中)。 供选用的电解质溶液有:稀硫酸、硫酸铜溶液 供选用的电极材料有:锌片、铜片、铁片 电极材料及电极反应式: 负极材料: ,电极反应式: , 正极材料: ,电极反应式: , 电解质溶液: 。 一、 计算题 20.(6分)在一密闭的2L容器中装有2 mol N2和6mol H2,在一定条件下开始反应。2 min末测得容器中有1.2mol N2,试计算: (1)2min末N2的浓度; (2)2min内NH3的平均反应速率; 参考答案 第Ⅰ卷(选择题,共40分) 一、单选题(共8小题,每小题2分,共16分) 1 2 3 4 5 6 7 8 A A D B C C D B 二、不定项选择题(共6小题,每小题4分,共24分。每小题1-2个选项;若全选对,得4分;若只选对其中一个选项,得2分;若有选错,不得分) 9 10 11 12 13 14 C AD AC CD AD BD 第Ⅱ卷 非选择题(共60分) 一、 填空题 15. 氧化还原反应,化学,电,负,正,有气泡产生,负,氧化, Zn-2e-=Zn2+;硫酸根向负极移动,氢离子向正极移动。 16. (1)固体表面积(2)温度 (3)反应物自身的性质 (4)浓度 (5)催化剂 (6)形成原电池并作负极 17.N,2 mol/L ,1 mol/(L.min) ,2NM 不变,不一定,一定 18.(1)Ar ,(略)(2)HClO4,(略) (3)(略),离子(4)CH4,极性 19.负极材料:铁片,电极反应式: Fe-2e-=Fe2+ , 正极材料:铜片,电极反应式: Cu2++2e-=Cu , G Fe Cu 电解质溶液:硫酸铜溶液。 CuSO4溶液 20.解:(1)c(N2)=0.6 mol/L (2)0.4 mol/(L·min)查看更多