- 2021-08-06 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年山东省新泰二中高二上学期第一次月考化学试题 无答案
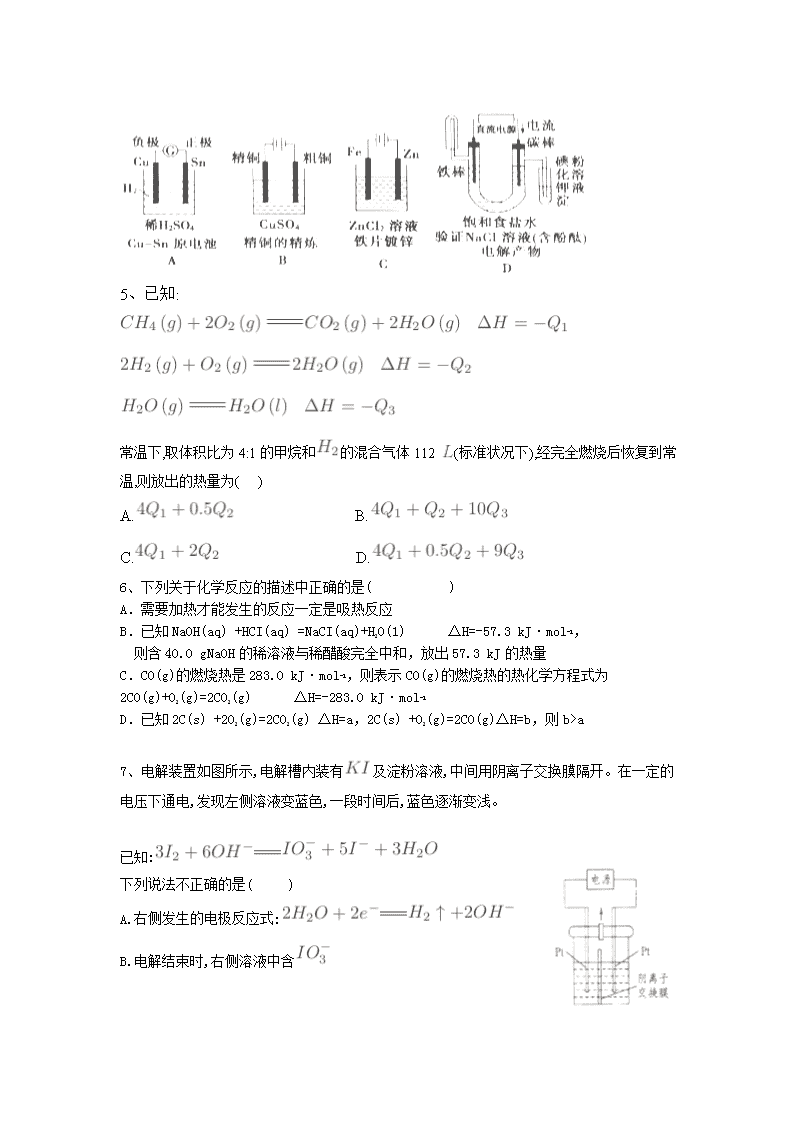
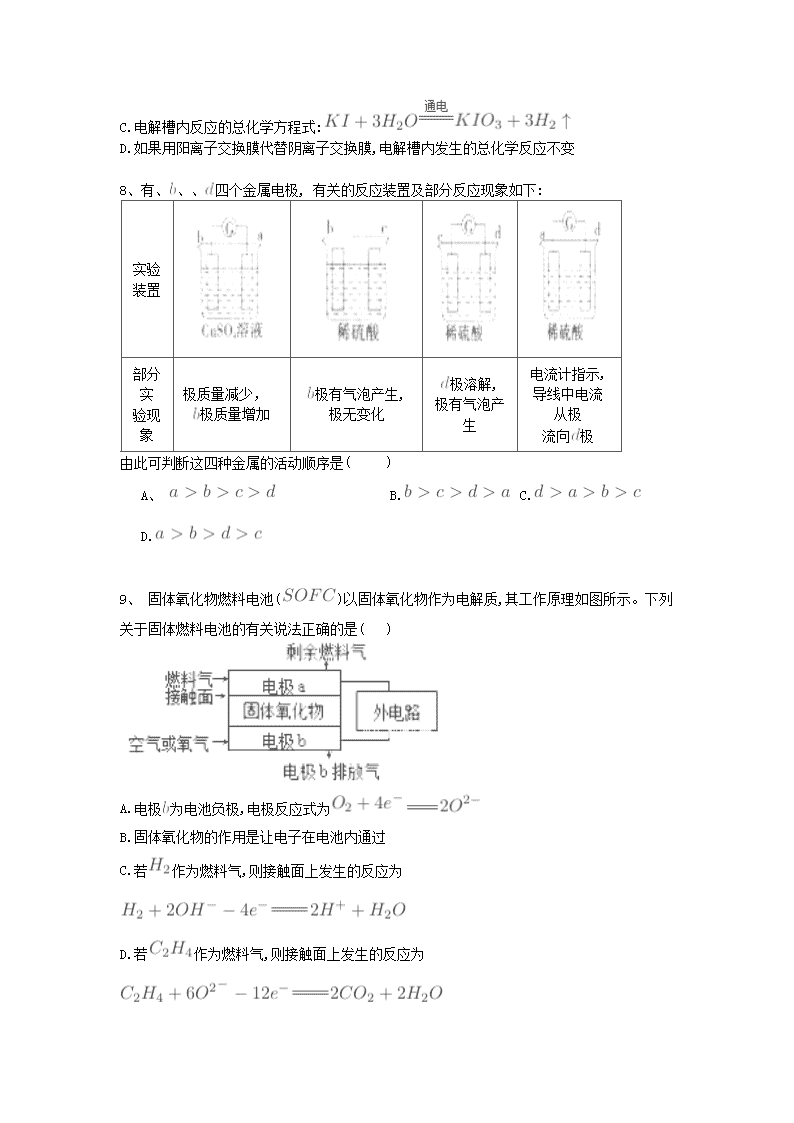
新泰市第二中学 2017-2018 学年高二上学期阶段性测试一 化学试卷 命题人:刘燕 可能用到的相对原子质量: H:1 O:16 S:32 Li: 7 Cu:64 一、选择题(每小题只有一个正确选项) 1、已知 Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是 ( ) A. 上述热化学方程式中的 ΔH 的值与反应物的用量无关 B. 该反应的化学能可以转化为电能 C.该反应中旧键断裂需要吸收能量,新键形成需放出能量,所以总能量不变 D.反应物的总能量高于生成物的总能量 2.下列关于化学能转化为电能的四种装置的说法正确的是( ) A.电池 I 中锌是正极 B.电池 II 是一次性电池 C.电池Ⅲ工作时,氢气发生还原反应 D.电池 IV 工作时电子由锌通过导线流向碳棒 3、如图所示装置中,a、b 都是惰性电极,通电一段时间后,b 极附近溶液呈红色。下列说 法正确的是( ) ① X 是正极,Y 是负极 ② ②a 是阴极,b 是阳极 ③CuSO4 溶液的 pH 值逐渐减小 ④NaCl 溶液的 pH 减小 A.①③ B.②③ C.①④ D.②④ 4、下图有关电化学的示意图正确的是() 5、已知: 常温下,取体积比为 4:1 的甲烷和 的混合气体 112 (标准状况下),经完全燃烧后恢复到常 温,则放出的热量为( ) A. B. C. D. 6、下列关于化学反应的描述中正确的是( ) A.需要加热才能发生的反应一定是吸热反应 B.已知 NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1) △H=-57.3 kJ·mol-1, 则含 40.0 gNaOH 的稀溶液与稀醋酸完全中和,放出 57.3 kJ 的热量 C.CO(g)的燃烧热是 283.0 kJ·mol-1,则表示 CO(g)的燃烧热的热化学方程式为 2CO(g)+O2(g)=2CO2(g) △H=-283.0 kJ·mol-1 D.已知 2C(s) +2O2(g)=2CO2(g) △H=a,2C(s) +O2(g)=2CO(g)△H=b,则 b>a 7、电解装置如图所示,电解槽内装有 及淀粉溶液,中间用阴离子交换膜隔开。在一定的 电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。 已知: 下列说法不正确的是( ) A.右侧发生的电极反应式: B.电解结束时,右侧溶液中含 C.电解槽内反应的总化学方程式: D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 8、有、 、、 四个金属电极, 有关的反应装置及部分反应现象如下: 实验 装置 部分 实 验现 象 极质量减少, 极质量增加 极有气泡产生, 极无变化 极溶解, 极有气泡产 生 电流计指示, 导线中电流 从极 流向 极 由此可判断这四种金属的活动顺序是( ) A、 B. C. D. 9、 固体氧化物燃料电池( )以固体氧化物作为电解质,其工作原理如图所示。下列 关于固体燃料电池的有关说法正确的是( ) A.电极 为电池负极,电极反应式为 B.固体氧化物的作用是让电子在电池内通过 C.若 作为燃料气,则接触面上发生的反应为 D.若 作为燃料气,则接触面上发生的反应为 10、室温下,将 1 的 溶于水会使溶液温度降低,热效应为 ,将 1 的 溶于水会使溶液温度升高,热效应为 , 受热分解的化学方程式为: ,热效应为 。则下列判断正确的是( ) A. B. C. D. 11、在如图所示装置中,观察到电流计指针偏转,M 棒变粗,N 棒变细,其中 P 为电解质溶液。 由此判断 M、N、P 所代表的物质可能是( ) A.A B.B C.C D.D 12、碱性硼化钒( )—空气电池工作时反应为: = 。用该电 池为电源,选用惰性电 极电解硫酸铜溶液,实验装置 如图所示。当外电路中 通过 0.04 电子时, 装 置内共收集到 0.448 气体(标准状况),则下列说法正确的是( ) A. 电极发生的电极反应为: 选项 M N P A 锌 铜 稀硫酸 B 铜 铁 稀盐酸 C 银 锌 硝酸银溶液 D 铜 铁 硝酸铁溶液 B.外电路中电子由电极流向 电极 C.电解过程中, 电极表面先有红色物质析出,然后有气泡产生 D.若 装置内的液体体积为 200 ,则 溶液的物质的量浓度为 0.05 13、镍-镉(Ni-Cd)可充电电池可以发生如下反应: Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2 由此可知,该电池充电时的阳极是( ) A.Cd B.NiO(OH) C.Cd(OH)2 D.Ni(OH)2 14、把活泼金属片 a 和 b 放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池, 一段时间后观察到区域Ⅰ变红色,则下列叙述正确的是( ) A.a 是原电池的负极 B.b 的活泼性大于 a C.无电流产生 D.b 上有气泡产生 15、电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。 测得同温同压下,气体甲与气体乙的体积比约为 1∶2,以下说法正确的是( ) A.a 极与电源的负极相连 B.a 电极反应式:2H2O+2e- H2↑+2OH- C.离子交换膜 d 为阴离子交换膜 D.产物丙为硫酸溶液 16、. 以惰性电极电解 CuSO4 溶液。一段时间后取出电极,加入 9.8 g Cu(OH)2 后溶液与电 解前相同,则电解时电路中流过的电子为 ( ) A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol 17、全固态锂硫电池是一种新型电池,其能且密度约为一般电子设备中广泛使用的锂离子电 池的 4 倍,且成本更低廉.已知锂硫电池的总反应为 2Li+S Li2S,用此电池作电源电解 足量的 AgNO3 溶液,其工作原理如下图所示。下列有关说 法正确的是( ) A.乙池溶液中的 NO3 一移向铁电极 B.乙池石墨电极反应式为 Ag++e- =Ag C.甲池充电时,锂电极发生氧化反应 D.甲池中消耗 14g 锂,乙池中产生 11.2L 氧气(标准状况下) 18、科学家已获得了极具理论研究意义的 N4 分子,其结构为正四面体(如图所示),与白磷 分子相似。气态时,已知断裂 1mol N—N 键吸收 167kJ 热量,断裂 1mol N≡N 键吸收 942kJ 热量,则( ) A.N4 与 N2 互称为同位素 B.N4 属于一种新型的化合物 C.N4 化学性质比 N2 稳定 D.1mol N4 气体转化为 N2 时要放出 882kJ 能量 二、填空题 19.CO、SO2 是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。 I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用 CO 可以合成甲醇。 (2)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将 CO2 转化 成有机物实现碳循环。如: 2CO2(g)+2H2O(l)== C2H4(g)+3O2(g)ΔH=+1411.0 kJ/mol 2CO2(g)+3H2O(l)== C2H5OH(1)+3O2(g)ΔH=+1366.8 kJ/mol 则由乙烯水化制乙醇反应的热化学方程式 。 Ⅱ.利用甲醇燃料电池设计如下图所示的装置。 (1)该装置中 b 为 极,该电极发生的电极反应式为: ,反应进行一段时间 后原电池溶液 PH (填变大或变小或不变)写出装置中电解池内发生反应的离子 方程式 , (2)当铜片的质量变化为 12.8 g 时,外电路转移的电子数目为 , a 极上消耗的 O2 在标准状况下的体积为 L。 反应完成后电解池内电解质溶液中溶质的质量分数 ( 填变大或变小或不变) 20. (I) 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为 Cu+H2SO4 = H2↑+CuSO4,试回答: (1)该装置的名称是 (填“电解池”或“原电池”) (2)A、B 中至少有一种是金属 (填名称),接电源的 (填“正极” 或“负极”)。 (3)写出该装置中发生还原反应的电极反应方程式 。 (4)若 C 溶液为 100ml 饱和食盐水,A 和 B 电极均为碳棒,该学生利用图示装置进行电解, 当放出标况下 112ml 氢气时,该溶液中 C(OH -)= 。 (II)利用右图装置,可以模拟铁的电化学防护。 若 X 为铜,为减缓铁的腐蚀,开关 K 应置于____ 处。铁棒上发生的电极 反应为______ ,该种防护方法称为_________ 若 X 为锌棒,开关 K 置于 M 处,铁棒上的电极反应为_________ 该电化 学防护法称为 。 21、如图所示,电极、 分别为 电极和 电极,电极、 都是石墨电极。通电一段时间后, 在、 两极上共收集到 336 (标准状态)气体。回答下列问题: (1)直流电源中, 为 极。 (2) 电极上生成的物质是 ,其质量为 。 (3)电源输出的电子,其物质的量与 、、 上分别生成的物质的物质的量之比 为:2: : : 。 (4) 溶液的浓度 , (填“增大”“减小”或“不变”。下同) 溶液的 。 5.若 溶液的质量分数由 5.00%变为 5.02%,则原有 5.00%的 溶液为 。查看更多