- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省雅安中学2018-2019学年高二上学期第一次月考化学试卷(解析版)
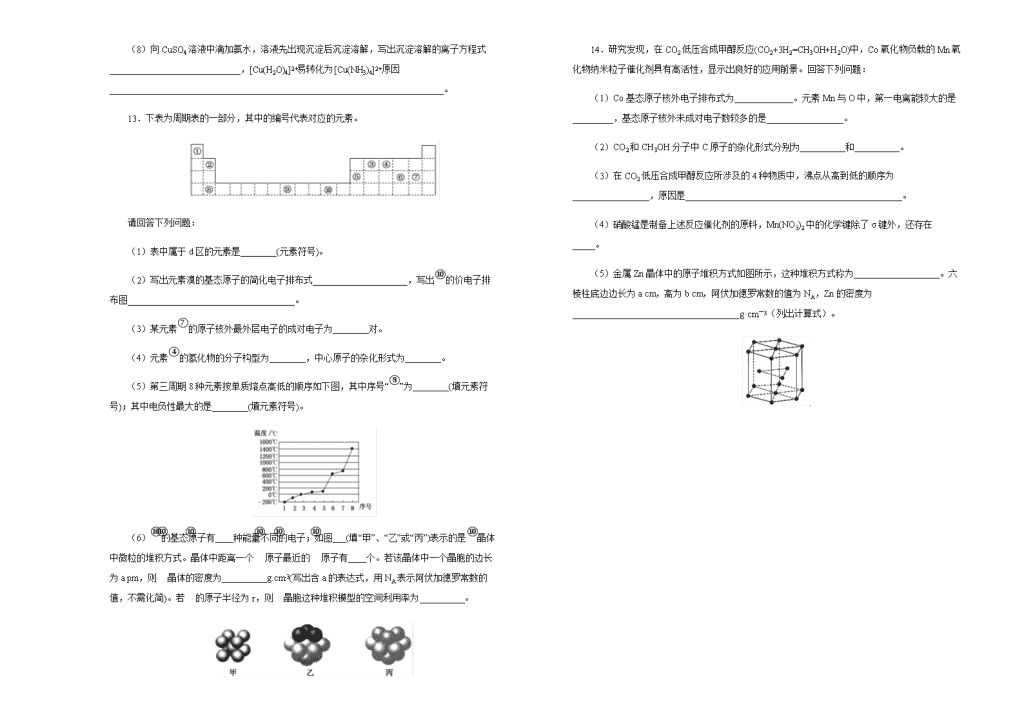
2018-2019学年四川省雅安中学 高二上学期第一次月考化学试题 化学 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。 4.考试结束后,请将本试题卷和答题卡一并上交。 一、单选题 1.下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是 A. Al、Mg、Na B. K、Na、Li C. N、O、C D. Cl、S、P 2.下列有关σ键和π键的说法正确的是 A. 含有π键的分子在反应时,π键是化学反应的积极参与者 B. 当原子形成分子时,首先形成π键,可能形成σ键 C. σ键和π键都属于共价键,均有方向性 D. 在所有分子中,σ键都比π键牢固 3.列物质中既有极性键又有非极性键的极性分子的是 A. CS2 B. CH4 C. H2O2 D. CH2=CH2 4.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是 A. 配合物中中心原子的电荷数和配位数均为6 B. 该配合物可能是平面正方形结构 C. Cl-和NH3分子均与Pt4+配位 D. 配合物中Cl-与Pt4+配位,而NH3分子不配位 5.右图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 A. H2S B. HCl C. PH3 D. SiH4 6.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的转化。在转化的各阶段被破坏的粒子间的主要相互作用依次是 A. 氢键;分子间作用力;非极性键 B. 氢键;氢键;极性键[ C. 氢键;极性键;分子间作用力 D. 分子间作用力;氢键;非极性键 7.列物质熔、沸点的高低顺序正确的是 A. 金刚石>晶体硅>二氧化硅>碳化硅 B. HI>HBr>HCl>HF C. 邻羟基苯甲酸> 对羟基苯甲酸 D. 金刚石> MgO > Mg >Na 8.列说法正确的是 A. 凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体 B. C-C的键能大于C-Si,所以C60熔点高于金刚砂SiC C. 若ABn型分子的中心原子A上没有孤对电子,则ABn为非极性分子 D. P4和CH4都是正四面体形分子且键角都为109°28′ 9.下列分子的空间构型可用sp2杂化轨道来解释的是 ①BF3 ② ③ ④C2H2 ⑤N2H4 ⑥C6H6 A. ①②③ B. ①②⑥ C. ②③⑤ D. ③④⑥ 10.下列关于晶体的说法正确的组合是 ①分子晶体中都存在共价键; ②在晶体中只要有阳离子就一定有阴离子; ③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低; ④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键; ⑤CaTiO3晶体的晶胞结构如上图所示(其中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点位置),则每个Ti4+和12个O2-相紧邻; ⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合; ⑦ H2O比H2S分子更稳定,是因为H2O分子中存在氢键; ⑧钠熔化时金属键被破坏,氯化钠熔化时离子键被破坏。 A. ①②③⑥ B. ①②④ C. ③⑤⑦ D. ③⑤⑧ 二、填空题 11.按要求填空。 (1)金刚石晶体中1个碳连接________个C原子,C杂化类型为____________,形成的六元环最多________个原子共面,12g金刚石中含有________molC-C键。 (2)石墨晶体为层状结构,其中一个C连接______个C,C杂化类型为_______;12g石墨中含有______mol C-C键,12g石墨中含有平面六元环的个数为_______。 (3)SiO2晶体中一个Si连接______个O,Si杂化类型为___________;Si与O个数比______,60g SiO2晶体中含有______mol Si-O键。 (4)黄铜主要由Zn和Cu组成。第一电离能Ⅰ1 (Zn)________Ⅰ1 (Cu)(填“大于”或“小于”)。原因是__________________________________________________。 三、综合题 12.按要求完成下列问题。 (1)利用VSEPR推断分子或离子的空间构型:PO43-___________;SeO3__________。 (2)与SeO3互为等电子体的一种离子为_____(填化学式)。SCN-电子式_______。 (3)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是__。 (4)硒、溴与砷同周期,三种元素的第一电离能从大到小顺序为__________(用元素符号比较)。 (5) 已知常温下Ni(CO)4是无色液体,其构型为正四面体。则配位原子是______,晶体类型为__________,推测其______(填“难”或“易”)溶于水。 (6)CO2晶胞中,与CO2紧邻的CO2有_______个。 (7)酸性比较:H2SeO3______H2SeO4 ,原因_________________________________。 (8)向CuSO4溶液中滴加氨水,溶液先出现沉淀后沉淀溶解,写出沉淀溶解的离子方程式_____________________________,[Cu(H2O)4]2+易转化为[Cu(NH3)4]2+原因__________________________________________________________________________。 13.下表为周期表的一部分,其中的编号代表对应的元素。 请回答下列问题: (1)表中属于d区的元素是________(元素符号)。 (2)写出元素溴的基态原子的简化电子排布式_____________________,写出⑩的价电子排布图_____________________________________。 (3)某元素⑦的原子核外最外层电子的成对电子为________对。 (4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。 (5)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“⑧”为________(填元素符号);其中电负性最大的是________(填元素符号)。 (6)⑩的基态原子有____种能量不同的电子;如图___(填“甲”、“乙”或“丙”)表示的是⑩晶体中微粒的堆积方式。晶体中距离一个⑩原子最近的⑩原子有____个。若该晶体中一个晶胞的边长为a pm,则⑩晶体的密度为__________g.cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值,不需化简)。若⑩的原子半径为r,则⑩晶胞这种堆积模型的空间利用率为__________。 14.研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题: (1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。 (2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。 (3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________________,原因是________________________________________________。 (4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在_____。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___________________。六棱柱底边边长为a cm,高为b cm,阿伏加德罗常数的值为NA,Zn的密度为_____________________________________g·cm-3(列出计算式)。 . 2018-2019学年四川省雅安中学 高二上学期第一次月考化学试题 化学 答 案 参考答案 1.B 【解析】 【详解】 A项,同一周期内元素的第一电离能在总体增大的趋势中有些曲折,当外围电子在能量相等的轨道上形成全空、半满或全满结构时,原子的能量较低,元素的第一电离能较大, Mg的最外层电子s轨道全满,第一电离能比Al 和Na 都高,所以第一电离能Na < Al< Mg,故A项错误; B项,同一主族元素从上到下,原子半径增加,有效核电荷增加不多,则原子半径增大的影响起主要作用,第一电离能由大变小,所以第一电离能K查看更多