- 2021-07-09 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省晋江市南侨中学2018-2019学年高二下学期第二次月考化学试题
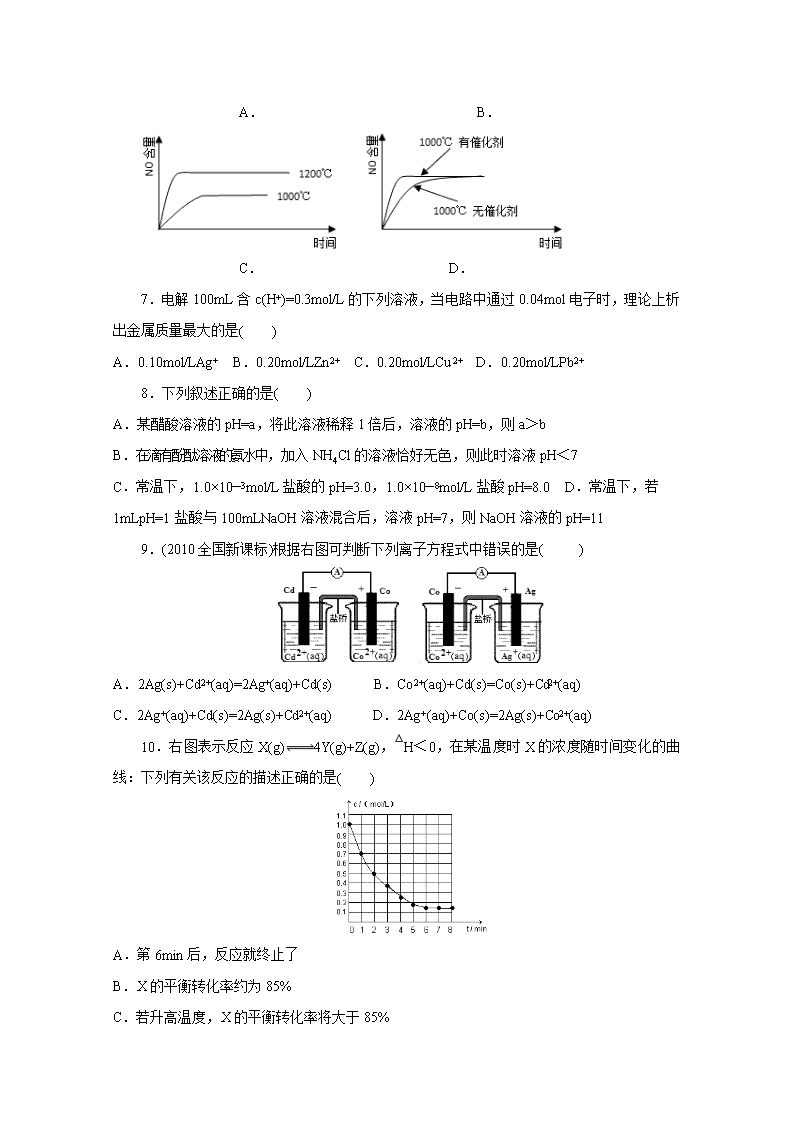
2019年春季南侨中学高二年段第二阶段考试理科 化学试题 命题人:吴允雄 审核人:吴巧勤 满分:100分 考试时间:90分钟 可能用到的原子量 H:1 K:39 Cl:35.5 Ag:108 Zn:65 Cu:64 Pb:207 一、 选择题(本题共有16小题,每小题3分,共48分,每小题只有一个选项) 1.心脏搏动产生电流传导到体表,使体表不同部位产生电位差。做心电图时在仪器与病人皮肤接触部位应该擦( ) A.医用酒精 B.氯化钠溶液 C.葡萄糖溶液 D.碘酒 2.某学生提供的实验数据如下,其中肯定错误的是 ①用100毫升的量筒量取67.60 mL的液体 ②用托盘天平称取22.5 g KCl ③酸碱中和滴定时,消耗0.100 0 mol/L的盐酸23.25 mL ④用广泛pH试纸测得某溶液的pH=4.4 A.①② B.②③ C.③④ D.①④ 3.等浓度的下列稀溶液:①乙酸 Ka:1.76×10—5、②HClO Ka:2.95×10—8、③碳酸 Ka1:4.30×10—7、④乙醇,它们的pH由小到大排列正确的是( ) A.④②③① B.③①②④ C.①②③④ D.①③②④ 4.已知:HCN(aq)与NaOH(aq)反应的ΔH = -12.1kJ /mol;HCl(aq)与NaOH(aq)反应的ΔH = -55.6kJ/ mol。则HCN在水溶液中电离的H等于( ) A.-67.7 kJ /mol B.-43.5kJ /mol C.+43.5 kJ/ mol D.+67.7 kJ/ mol 5.在容积可变的密闭容器中,2mol N2和8mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于( ) A.5% B.10% C.15% D.20% 6.已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),△H= -1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( ) A. B. C. D. 7.电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( ) A.0.10mol/LAg+ B.0.20mol/LZn2+ C.0.20mol/LCu2+ D.0.20mol/LPb2+ 8.下列叙述正确的是( ) A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7 C.常温下,1.0×10—3mol/L盐酸的pH=3.0,1.0×10—8mol/L盐酸pH=8.0 D.常温下,若1mLpH=1盐酸与100mLNaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11 9.(2010全国新课标)根据右图可判断下列离子方程式中错误的是( ) A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq) C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq) 10.右图表示反应X(g)4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:下列有关该反应的描述正确的是( ) A.第6min后,反应就终止了 B.X的平衡转化率约为85% C.若升高温度,X的平衡转化率将大于85% D.若降低温度,v正和v逆将以同样倍数减小 11.用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( ) A.c(NH4+)>c(Cl-),c(OH-)>c(H+) B.c(NH4+)=c(Cl-),c(OH-)=c(H+) C.c(Cl-)>c(NH4+),c(OH-)>c(H+) D.c(Cl-)>c(NH4+),c(H+)>c(OH-) 12.电解NO制备 NH4NO3的工作原理如图所示,X、 Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是 A.物质A为NH3 B.X电极为电解池阳极 C.Y电极上发生了还原反应 D.Y电极反应式为 NO-3e-+4OH- == NO+2H2O 13.下列图示与对应的叙述相符的是 A.图甲表示催化剂能改变化学反应的焓变 B.图乙表示向氨水中加水时溶液导电性的变化情况,且溶液c(OH—)大小:aO,且 a=2 D.图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化情况 14.常温下,电解质溶液的性质与变化是多样的,下列说法正确的是 A.pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③ B.往稀氨水中加水,的值变小 C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式: c(Na+)+c(H+) = C(OH—)+2c(S2—) D.Ca(ClO) 2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强 15.常温下,向20mL0.05mol•L—1的某稀酸H2B溶液中滴入0.1mol•L—1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( ) A.NaHB溶液可能为酸性,也可能为碱性 B.A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大 C.E溶液中离子浓度大小关系:c(NH4+)>c(B2—)>c(OH—)>c(H+) D.F点溶液c(NH4+)=2c(B2—) 16.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图,下列说法正确的是( ) A.283 K时,图中a点对应的溶液是不饱和溶液 B.三个不同温度下,363 K时Ksp(SrSO4)最大 C.温度一定时,Ksp(SrSO4)随c(SO)的增大而减小 D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 二、非选择题(本题共有4小题,共52分) 17.(14分)已知K、Ka、Kb、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。 (1)有关上述常数的说法正确的是________。 a.它们都能反映一定条件下对应变化进行的程度 b.它们的大小都随温度的升高而增大 c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh (2)25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=________。 (3)高炉炼铁中发生的反应有FeO(s)+CO(g) Fe(s)+CO2(g) ΔH<0。 该反应的平衡常数表达式K=________; 已知1 100 ℃时,K=0.25,则平衡时CO的转化率为________; 在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是v(正)________v(逆)(填“>”“<”或“=”)。 (4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是___ ___(已知lg 2=0.3)。 18.(12分)某学生用邻苯二甲酸氢钾,(分子式为 相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。 (1)写出邻苯二甲酸氢钾与NaOH反应的化学方程式: _____________________________________________________________ (2)将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂__________________(从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是________________________________。 (3)该实验要用到的主要玻璃仪器____________、____________。 (4)该学生进行三次实验,所取固体的质量均相同,填写下表: 实验 编号 邻苯二甲酸氢钾的质量(g) 待测NaOH溶液的体积(mL) 1 0.4488 22.24 2 20.04 3 19.96 滴定中误差较大的是第_________次实验,造成这种误差的可能原因是_________ a.滴定时有NaOH溶液滴到锥形瓶外面; b.未用NaOH溶液润洗滴定管; c.NaOH溶液在“0”刻度线以上,未予调整就开始滴定; d.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视; e.酚酞指示剂由无色变为红色时立即停止滴定。 (5)NaOH溶液的物质的量浓度为____________。 19.(12分) (1)CO 还原脱硝技术可有效降低烟气中的NOx 的排放量。回答下列问题: CO 还原NO 的脱硝反应:2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H 已知:CO(g)+NO2(g)⇌CO2(g)+NO(g) △H1=—226kJ•mol—1 N2(g)+2O2(g)⇌2NO2(g) △H2=+68kJ•mol—1 N2(g)+O2(g)⇌2NO(g) △H3=+183kJ•mol—1 脱硝反应△H= ,该反应向正反应方向自发进行的倾向很大,其原因是 , 有利于提高NO 平衡转化率的条件是(写出两条) 、 。 (2) 直接供氨式燃料电池是以NaOH溶液为电解质的.电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。 (3) 用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑.写出阳电极的电极反应式 。 20.(14分)在含有弱电解质的溶液中,往往有多个化学平衡共存. (1)一定温度下,向1L 0.1mol•L﹣1CH3COOH溶液中加入0.1mol CH3COONa固体,平衡后则溶液中 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式: (2)常温下向20mL 0.1mol•L﹣1Na2CO3溶液中逐滴加入0.1mol•L﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下: 回答下列问题: ①在同一溶液中,H2CO3、HCO3﹣、CO32﹣ (填“能”或“不能”)大量共存; ②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ; ③已知在25℃时,CO32﹣水解反应的平衡常数即水解常数Kh═2×10﹣4 mol•L﹣1 ,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,溶液的pH= . 2019年春季南侨中学高二年段第二阶段考试理科 化学试题答案 命题人:吴允雄 审核人:徐阳钦 满分:100分 考试时间:90分钟 1 2 3 4 5 6 7 8 B D D C C C D A 9 10 11 12 13 14 15 16 A B C A C A D A 17.(14分)[答案] (1)ad (2)中 (3) 20% > (4)3.3≤pH<9 18.(12分) (1)邻苯二甲酸氢钾与NaOH生成邻苯二甲酸钠钾和水,其反应方程为:; 故答案为:; (2)邻苯二甲酸氢钾为弱酸,终点时溶液的pH约为9.1,滴定终点的pH要在指示剂的变色范围之内,所以选用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点, 故答案为:酚酞;无色溶液变成浅红色,且半分钟内不褪色; (3)该实验要用碱式滴定管盛放氢氧化钠溶液,用锥形瓶盛放邻苯二甲酸氢钾,故主要玻璃仪器为:碱式滴定管、锥形瓶, 故答案为:碱式滴定管、锥形瓶; (4)根据表中数据分析,第1次操作与另外两次数据差别较大;造成这种误差的可能原因是滴定时有NaOH溶液滴到锥形瓶外面或未用NaOH溶液润洗滴定管,故答案为:1;滴定时有NaOH溶液滴到锥形瓶外面、未用NaOH溶液润洗滴定管; (5)邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,即邻苯二甲酸氢钾与氢氧化钠的物质的量相等, n(邻苯二甲酸氢钾)= m M =0.0022mol, V(NaOH)= 20.04+19.96 2 ×10-3=0.020L 所以氢氧化钠溶液物质的量浓度为c(NaOH)= n V =0.11mol/L, 故答案为:0.11mol/L. 19. 2NH3+6OH——6e—=N2+6H2O . 故答案为: 2Cu+2OH﹣﹣2e﹣=Cu2O+H2O。 20 【解答】解:(1)一定温度下,向1L 0.1mol•L﹣1CH3COOH溶液中加入0.1mol CH3COONa固体,由于温度不变,Ka=只与温度有关,所以不变;溶液中存在电荷守恒为:c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+); 故答案为:不变;c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+); (2)土壤中Na2CO3含量较高时,pH可以高达10.5,因为Na2CO3为强碱弱酸盐,水解显碱性,其水解的离子方程式为:CO32﹣+H2O⇌HCO3﹣+OH﹣; 故答案为:CO32﹣+H2O⇌HCO3﹣+OH﹣; (3)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水, ①由反应及图象可知,在同一溶液中,H2CO3、HCO3﹣、CO32﹣不能大量共存, 故答案为:不能; ②由图象可知,pH=7时,溶液中含碳元素的主要微粒为HCO3﹣、H2CO3,电荷守恒可知c(Na+)+c(H+)=c(Cl﹣)+c(HCO3﹣)+c(OH﹣),则c(Na+)>c(Cl﹣),因HCO3﹣水解,则c(Na+)>c(Cl﹣)>c(HCO3﹣), 故答案为:HCO3﹣、H2CO3;c(Na+)>c(Cl﹣)>c(HCO3﹣); ③CO32﹣的水解常数Kh==2×10﹣4,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,c(OH﹣)=10﹣4mol/L,由Kw可知,c(H+)=10﹣10mol/L,所以pH=10, 故答案为:10.查看更多