- 2021-07-09 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
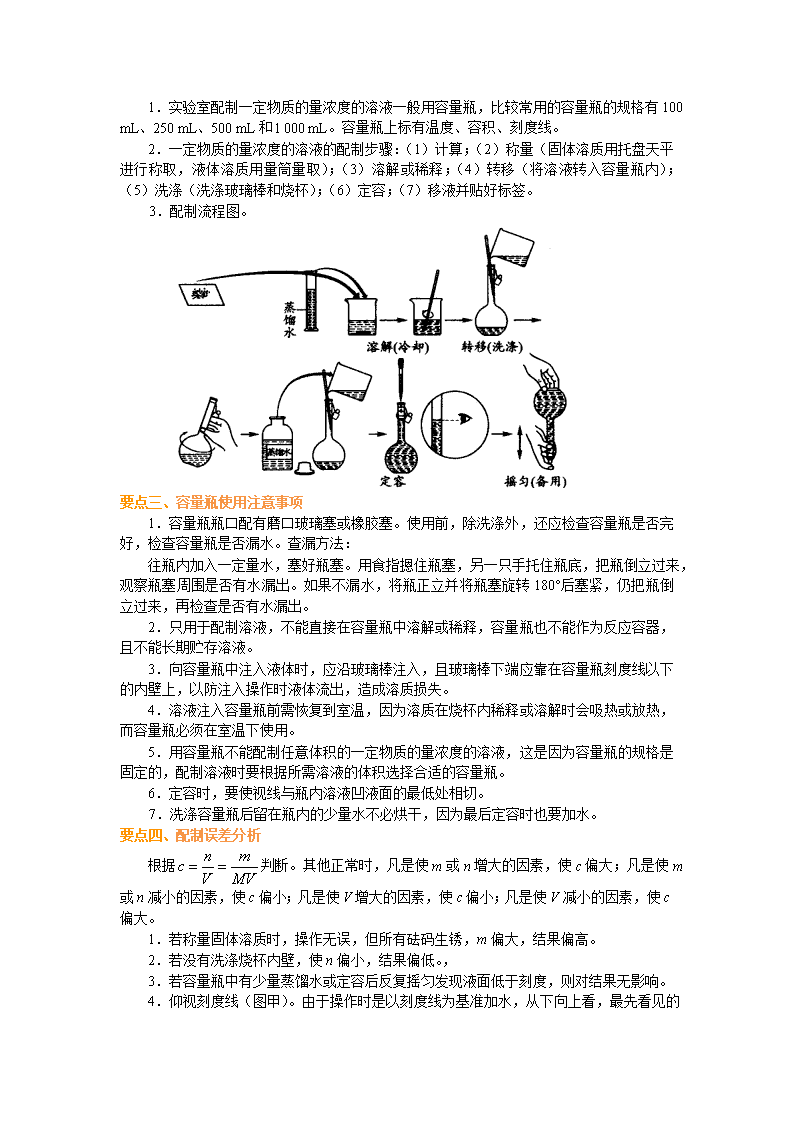
2018届二轮复习配制一定物质的量浓度溶液学案(全国通用)
配制一定物质的量浓度溶液 【学习目标】 1.掌握一定物质的量浓度溶液的配制方法和应用; 2.了解容量瓶使用注意事项; 3.配制一定物质的量浓度溶液的误差分析。 要点一、一定物质的量浓度溶液配制的注意事项 由固体配制溶液(需确定溶质的质量)和由浓溶液配制稀溶液(需确定要量取的浓溶液体积)。整个过程可细化为八个步骤:计算、称量、溶解或稀释、转移、洗涤、转移、定容、摇匀。 1.仪器通常有: 容量瓶(注意规格)、托盘天平(固体配制溶液)或滴定管(用浓溶液配制稀溶液)、量筒(用于量取溶剂)、烧杯(溶解)、玻璃棒(搅拌、引流)、胶头滴管(用于定容)、药匙(溶质是固体时使用)。 2.容量瓶为细颈、梨形玻璃容器,带有磨口玻璃塞。 容量瓶上标有刻度线、适用温度、容量。使用前一定要检查容量瓶是否漏液,方法是:向瓶内加一定量水,塞好瓶塞,用左手食指顶住瓶塞,右手托住瓶底,将容量瓶倒置,看是否有水漏出。如不漏水,再将瓶塞旋转180°,重复上述操作,两次均不漏水的容量瓶才能使用。 3.注意事项: (1)称量时一般用托盘天平,量取时一般用量筒,它们只能准确到小数点后一位(0.1 g或0.1 mL),因此计算所用溶质的质量或体积时保留到小数点后一位。 (2)称量时左物右码,有吸湿性和腐蚀性的药品放在烧杯中快速称量;用量筒量取的液体倒入烧杯后,量筒内壁附着的溶质不要洗涤到烧杯中。 (3)溶解时一般先在烧杯中加入溶质,后加溶剂进行溶解。浓硫酸的稀释一定要注意将浓硫酸沿烧杯内壁慢慢倒入水中,且边加边用玻璃棒搅拌。 (4)配制一定物质的量浓度的溶液,是将一定质量或体积的溶质按溶液的体积在选定的容量瓶中定容,因而完全不需要计算水的用量。 (5)不能配制任意体积的溶液,因为配制过程中是用容量瓶来定容的,而容量瓶的规格又是特定值。常用容量瓶的规格有100 mL、250 mL、500 mL、1000 mL等。 (6)不能用容量瓶溶解、稀释或久贮溶液(尤其碱性溶液),更不可在容量瓶中进行化学反应。配制完溶液后,应将溶液倒入干燥、洁净的试剂瓶中。 (7)溶液注入容量瓶前要使其温度恢复到室温,这是因为热的溶液转入容量瓶会使所配的溶液的体积偏小(玻璃的膨胀系数小于液体),所配溶液浓度偏大。 (8)溶液转移至容量瓶时,要用玻璃棒引流,并用蒸馏水洗涤烧杯及玻璃棒(上面粘有少量溶质)2~3次,将洗涤液移入容量瓶。 (9)当容量瓶中液面上升到离刻度线1~2 cm处,要改用胶头滴管加入蒸馏水,防止液面超过刻度线。若加水定容时超过刻度线,必须重新配制。 (10)定容后的溶液要注意反复摇匀。静置后若发现液面下降,稍低于标线,不要再加蒸馏水,否则会引起结果偏低。如果摇匀后洒出几滴,溶液的浓度不变。 要点二、一定物质的量浓度的溶液配制方法 1.实验室配制一定物质的量浓度的溶液一般用容量瓶,比较常用的容量瓶的规格有100 mL、250 mL、500 mL和l 000 mL。容量瓶上标有温度、容积、刻度线。 2.一定物质的量浓度的溶液的配制步骤:(1)计算;(2)称量(固体溶质用托盘天平进行称取,液体溶质用量筒量取);(3)溶解或稀释;(4)转移(将溶液转入容量瓶内);(5)洗涤(洗涤玻璃棒和烧杯);(6)定容;(7)移液并贴好标签。 3.配制流程图。 要点三、容量瓶使用注意事项 1.容量瓶瓶口配有磨口玻璃塞或橡胶塞。使用前,除洗涤外,还应检查容量瓶是否完好,检查容量瓶是否漏水。查漏方法: 往瓶内加入一定量水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出。如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否有水漏出。 2.只用于配制溶液,不能直接在容量瓶中溶解或稀释,容量瓶也不能作为反应容器,且不能长期贮存溶液。 3.向容量瓶中注入液体时,应沿玻璃棒注入,且玻璃棒下端应靠在容量瓶刻度线以下的内壁上,以防注入操作时液体流出,造成溶质损失。 4.溶液注入容量瓶前需恢复到室温,因为溶质在烧杯内稀释或溶解时会吸热或放热,而容量瓶必须在室温下使用。 5.用容量瓶不能配制任意体积的一定物质的量浓度的溶液,这是因为容量瓶的规格是固定的,配制溶液时要根据所需溶液的体积选择合适的容量瓶。 6.定容时,要使视线与瓶内溶液凹液面的最低处相切。 7.洗涤容量瓶后留在瓶内的少量水不必烘干,因为最后定容时也要加水。 要点四、配制误差分析 根据判断。其他正常时,凡是使m或n增大的因素,使c偏大;凡是使m或n减小的因素,使c偏小;凡是使V增大的因素,使c偏小;凡是使V减小的因素,使c偏大。 1.若称量固体溶质时,操作无误,但所有砝码生锈,m偏大,结果偏高。 2.若没有洗涤烧杯内壁,使n偏小,结果偏低。, 3.若容量瓶中有少量蒸馏水或定容后反复摇匀发现液面低于刻度,则对结果无影响。 4 .仰视刻度线(图甲)。由于操作时是以刻度线为基准加水,从下向上看,最先看见的是刻度线,刻度线低于液面的实际刻度,故加水量偏多,导致溶液体积偏大,结果偏低。 5.俯视刻度线(图乙)。恰好与(4)相反,刻度线高于液面的实际刻度,使得加水量偏小,结果偏高。 以配制一定物质的量浓度的NaOH溶液为例分析以下操作: 能引起误差的一些操作 过程分析 对c 的影响 m V 称量时间过长 减小 不变 偏低 用滤纸称NaOH 减小 不变 偏低 向容量瓶注液时少量流出 减小 不变 偏低 未洗烧杯和玻璃棒 减小 不变 偏低 定容时,水加多后用滴管吸出 减少 不变 偏低 定容摇匀时液面下降再加水 不变 增大 偏低 定容时俯视读数(读刻度) 不变 减小 偏高 定容时仰视读刻度 不变 增大 偏低 方法引导 定容误差的判断方法 定容的目标是容量瓶的容积,相关主要方法是以平视式、以容量瓶的刻度线为目标、观察液面与刻度的位置关系,标准是液面的最低点与刻度线齐平时,液体体积恰好等于容量瓶的容积。 (A)仰视观察,溶液体积偏大。如图(a) (B)俯视观察,溶液体积偏小。如图(b) 【高清课堂】 类型一、一定物质的量浓度溶液配制的注意事项 例1.欲配制250mL 1mol/L 稀硫酸,用量筒量取 ______mL 98%密度为1.84g/cm3 的浓硫酸,再用______取适量蒸馏水,将______缓慢注入到 ______中,并用______不断搅拌,待溶液______后,将溶液沿玻璃棒移入______中,用少量蒸馏水洗涤______和______ 2-3次,将洗涤液移入______中。向容量瓶中注入蒸馏水至距刻度线______ 时,改用______ 小心加水至溶液液面最低处与刻度线相切。最后盖好瓶塞, 将配好的溶液转移到______中并贴好贴签。 【答案】13.6 烧杯 浓硫酸 水 玻璃棒 冷至室温 容量瓶 烧杯 玻璃棒 容量瓶 1-2 cm 胶头滴管 试剂瓶 【解析】V =0. 25L×1mol/L× 98g /mol÷98% ÷1.84g /cm3 =13.6 mL 【总结升华】掌握配制溶液的注意事项 举一反三: 【变式1】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( ) A.950 mL 111.2 g B.500 mL 117 g C.1000 mL 117 g D.任意规格 111.2 g 【答案】 C 类型二:一定物质的量浓度的溶液配制方法 例2.用经过准确称量的NaOH固体配制250 mL 0.2 mol/L NaOH溶液。 (1)在下列实验仪器中,不必使用的是________(填代号)。 A.托盘天平 B.500 mL试剂瓶 C.500 mL容量瓶 D.250 mL烧杯 E.胶头滴管 (2)除上述仪器中可使用的以外,还缺少的仪器是________;在该实验中的用途是________________________________________________________________________。 (3)使用容量瓶前必须进行的一步操作是________。 (4)配制时经以下操作步骤,正确的顺序是________。 A.用适量的蒸馏水加入盛NaOH的烧杯中完全溶解,冷却至室温 B.将烧杯中的溶液小心转移到容量瓶中 C.继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至凹液面底部与刻度线相切 D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心注入容量瓶,并轻轻振荡 E.将容量瓶塞塞紧,充分摇匀 (5)下列情况会使所配溶液浓度偏高的是________。 a.定容时俯视标线 b.没有进行上述操作步骤D c.加蒸馏水不慎超过刻度线 d.容量瓶使用前内壁沾有水珠 e.砝码上有杂质 【答案】(1)AC (2)玻璃棒、250 ml容量瓶 玻璃棒的作用:溶解NaOH固体时起搅拌作用,加速固体的溶解;将烧杯中溶解的NaOH溶液转移到容量瓶中时起引流作用,以防液体洒在瓶外及沾在瓶的刻度线上方而引起体积不准确。250 mL容量瓶的作用:准确配制溶液 (3)检查容量瓶是否漏水 (4)ABDCE (5)ae 【解析】 (1)配制一定物质的量浓度的溶液,所用仪器根据实验步骤选择,因为NaOH固体是经过准确称量的,故不再需托盘天平进行称量,固体需溶解,故需用250 mL烧杯,又因是配制250 mL的溶液,故不需要500 mL容量瓶,而应使用250 mL容量瓶,又因容量瓶不能用来长期保存试剂,故需500 mL试剂瓶来盛装溶液。(2)除了上述仪器中可使用的以外,还需玻璃棒,主要是用来溶解和引流。(3)使用容量瓶前必须检查容量瓶是否漏水。 【总结升华】配制一定物质的量浓度溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀,误差分析:根据c==中,m、n、V的变化分析 a.俯视使V减小,c偏高 b.未洗涤,使n减小,c偏低 c.使V增大,c偏低 d.无影响 e.使m增大,c偏高 举一反三: 【变式1】配制100 mL 1 mol·L-1 Na2CO3溶液,下列操作正确的是( ) A.称取10.6 g无水碳酸钠,加入到100 mL容量瓶中,加水溶解、定容 B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 D.定容后,塞好瓶塞,反复倒转,摇匀 【答案】 D 【解析】 A选项错,不能在容量瓶中溶解物质;B选项错,因为要配制100 mL溶液,加入100 mL蒸馏水溶解Na2CO3所得溶液已接近100 mL,但并不是100 mL;C选项未用玻璃棒引流,错。 类型三:容量瓶使用注意事项 例3.在容量瓶的使用方法中,下列操作不正确的是________(填写标号)。 A.使用容量瓶前检查它是否漏水 B.容量瓶用蒸馏水洗净后,再用待配液润洗 C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线 D.配制溶液时,如果试样是液体,用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线 E.浓硫酸稀释后,应马上转移到容量瓶中,缓慢加入蒸馏水到接近刻度线 1~2 cm 处用胶头滴管滴加蒸馏水至刻度线 F.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次 【答案】 BCDE 【解析】 容量瓶使用前一定要检查是否漏水,但不能用待配液润洗。配制溶液时,无论试样是固体,还是液体,都不能直接倒入容量瓶中,要经过在烧杯中溶解或稀释后,冷却至室温方可转移到容量瓶中。瓶上的刻度是在标定温度下的容积,温度改变,体积也要改变,在将液体转移入容量瓶之前,一定要让被转移的液体冷却到规定温度,以确保所得体积的准确度。 【总结升华】注意容量瓶使用方法 举一反三: 【变式1】实验室配制500 mL 0.2 mol·L-1的FeSO4溶液,实验操作步骤有: ①在天平上称出27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解 ②把制得的溶液小心地注入500 mL容量瓶中 ③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切 ④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀 ⑤将容量瓶塞塞紧,充分摇匀 请填写下列空白: (1)操作步骤的正确顺序为(填序号)_________________ __________________。 (2)本实验用到的基本仪器有__________________________________________。 (3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响? 会________(填“偏高”、“偏低”或“无影响”)。 (4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会________;加蒸馏水时不慎超过了刻度,会________。 (5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应 __________________________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应________________________。 【答案】 (1)①②④③⑤ (2)天平、药匙、烧杯、玻璃棒、500 mL容量瓶、胶头滴管 (3)偏高 (4)偏低 偏低 (5)宣告实验失败,从头重新做 宣告实验失败,从头重做 类型四:配制误差分析 例4.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( ) A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线 C.有少量NaOH溶液残留在烧杯里 D.用带游码的托盘天平称2.4 g NaOH时误用了“左码右物”的方法 【答案】B 【解析】 本题考查一定物质的量浓度溶液配制中误差分析。潮解的NaOH中含有水分,称取一定质量的这种NaOH,其中的NaOH就少了,配制的溶液浓度将偏低;定容时,加水未到刻度线,显然溶液的体积不足,溶液浓度偏高;溶解后的溶液未完全转入容量瓶中,造成最终溶液浓度偏低;称量时砝码和重物放反了位置,又使用了游码,则:砝码的质量=重物的质量+游码的质量,称得的重物不足,配制的溶液结果偏低。 【总结升华】把握用天平称量重物的原理:重物质量(左盘)=砝码质量(右盘)+游码质量,当物、码放反时,必然出现:砝码质量=重物质量+游码质量,这样称得的物体质量一定比要称得的质量少了。 举一反三: 【变式1】 实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题: (1)写出该实验的实验步骤。 ①________;②________;③________;④________;⑤________。 (2)所需仪器为:容量瓶(规格为________)、托盘天平,还需要________________(填实验仪器名称)才能完成该实验。 (3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。 ①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。对所配溶液浓度的影响是________________,原因是________________________。 ②定容后,加盖倒转摇匀,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响是________,原因是________________________。 【答案】 (1)①计算 ②称量 ③溶解 ④转移 ⑤定容摇匀 (2)500 mL 烧杯、药匙、玻璃棒、胶头滴管、量筒 (3)①偏高 恢复到室温时,溶液的体积将小于500 mL ②偏低 溶液体积大于500 mL查看更多