- 2021-07-09 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年广东省佛山市第一中学高二上学期期中考试 化学(选考) Word版
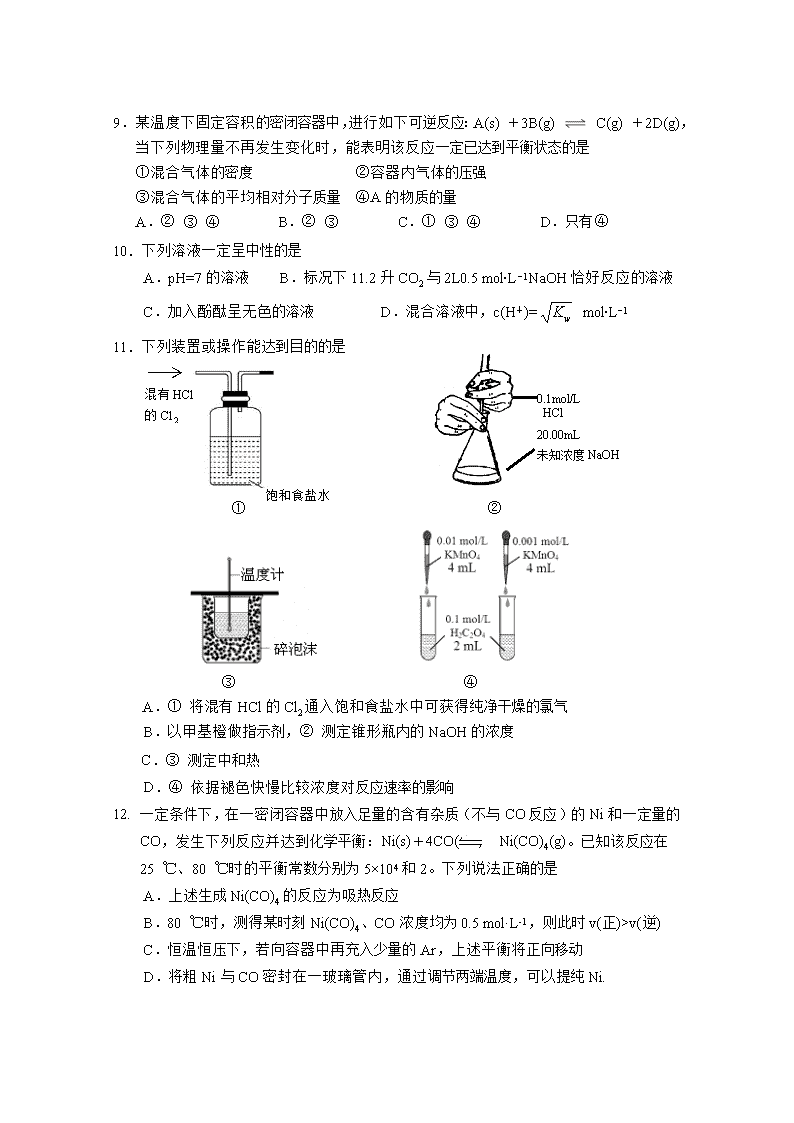
2019-2020 学年上学期高二级期中考试题 化学(选考) 命题人: 彭余凤 审题人: 梅枫 本试卷共 7 页,20 小题,满分 100 分,考试时间为 90 分钟。 注意事项: 1.答题前,考生务必用黑色笔迹的钢笔或签字笔将自己的姓名、考号填写在答题卷上。 2.每小题选出答案后,用 2B 铅笔把答题卷上对应题目选项的答案信息点涂黑;如需改 动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。非选择题必须用黑色 字迹的钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内相应位置上;如需 改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上 要求作答的答案无效。 3.作答选做题时,请先用 2B 铅笔填涂选做题的题组号对应的信息点,再作答。漏涂、 错涂、多涂的,答案无效。 可能用到的相对原子质量: H:1 N:14 O:16 K:39 Cl:35.5 C:12 第一部分 选择题(共 48 分) 一、单项选择题:本大题共 16 小题,每小题 3 分共 48 分。在每小题给出的四个选项中,只 有一个选项符合题目要求,选对的得 3 分,选错或不答的得 0 分。 1.氢气是人类未来的清洁燃料,以水为原料大量制取氢气的最理想的途径是 A.利用太阳能和合适催化剂使水分解产生氢气 B.以焦炭和水制取水煤气(含 CO 和 H2)后分离出氢气 C.用铁和盐酸反应放出氢气 D.由火电站提供电力电解水产生氢气 2. 下列反应中活化能最低的是 A.氢气在氧气中燃烧 B.碳酸钙受热分解 C.盐酸与硝酸银溶液混合 D.草酸使酸性高锰酸钾溶液褪色 3.下列各组热化学方程式中,化学反应的 △ H 前者小于后者的是 ①C(s)+O2(g)====CO2(g); △ H1 C(s)+1 2O2(g)====CO(g); △ H2 ②S(s)+O2(g)====SO2(g); △ H3 S(g)+O2(g)====SO2(g); △ H4 ③H2(g)+1 2O2(g)====H2O(l); △ H5 2H(g)+O(g)====H2O(l); △ H6 ④CaCO3(s)====CaO(s)+CO2(g); △ H7 CaO(s)+H2O(l)====Ca(OH)2(s); △ H8 A.①④ B.① C.②③④ D.①③ 4. 下列电离方程式正确的是 A. KHSO4(熔融) ====K+ +HSO4- B. HCO3 -+H2O ==== CO32- +H3O+ C. H2CO3 CO32- +2H+ D. BaSO4 Ba2+ +SO42- 5. 下列说法正确的是 A.1 mol 盐酸与 1 mol Mg(OH)2 完全中和所放出的热量为 57. 3kJ.mol-1 B.25℃、101 kPa 时,1 mol H2 和 2 mol H2 燃烧生成液态水,求出的燃烧热相等 C.CO 是不稳定的氧化物,它能继续和氧气反应生成稳定的 CO2,所以 C 燃烧生成 CO 反应一定是吸热反应 D.25℃时, 1 mol 甲烷燃烧所放出的热量为甲烷的燃烧热 6. 下列说法中正确的是 ①将 Cl2 通入水中溶液能导电,但是 Cl2 是非电解质 ②氨溶于水得到的溶液氨水能导电,所以氨水是电解质 ③液态 HCl 不导电,液态的纯硝酸也不导电 ④固态的离子化合物不导电,熔融态的离子化合物也不导电 ⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 A.⑤ B.①②⑤ C.①②③ D.③ 7. 用水稀释 0.1 mol/LHA 酸溶液时,溶液中随水量的增加而减小的是 A.c(A-)/c(HA) B.c(HA)/c(H+) C.c(H+).c(A-) /c(HA) D.n(A-) 8. 通常人们把拆开 1 mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估 算化学反应的反应热(ΔH),化学反应的ΔH 等于反应中断裂旧化学键的键能之和与反应中 形成新化学键的键能之和的差. 化学键 H—H Cl—Cl H—Cl 生成 1 mol 化学键时放出的能量 436 kJ/mol 243 kJ/mol 431 kJ/mol 则下列热化学方程式不.正确的是 A.1 2H2(g)+1 2Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol C.1 2H2(g)+1 2Cl2(g)===HCl(g) ΔH=+91.5 kJ/mol D.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol 9.某温度下固定容积的密闭容器中,进行如下可逆反应:A(s) +3B(g) C(g) +2D(g), 当下列物理量不再发生变化时,能表明该反应一定已达到平衡状态的是 0.1mol/L HCl 20.00mL 未知浓度 NaOH ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④A 的物质的量 A.② ③ ④ B.② ③ C.① ③ ④ D.只有④ 10.下列溶液一定呈中性的是 A.pH=7 的溶液 B.标况下 11.2 升 CO2 与 2L0.5 mol∙L−1NaOH 恰好反应的溶液 C.加入酚酞呈无色的溶液 D.混合溶液中,c(H+)= wK mol∙L−1 11.下列装置或操作能达到目的的是 ① ② ③ ④ A.① 将混有 HCl 的 Cl2 通入饱和食盐水中可获得纯净干燥的氯气 B.以甲基橙做指示剂,② 测定锥形瓶内的 NaOH 的浓度 C.③ 测定中和热 D.④ 依据褪色快慢比较浓度对反应速率的影响 12. 一定条件下,在一密闭容器中放入足量的含有杂质(不与 CO 反应)的 Ni 和一定量的 CO,发生下列反应并达到化学平衡:Ni(s)+4CO(g) Ni(CO)4(g)。已知该反应在 25 ℃、80 ℃时的平衡常数分别为 5×104 和 2。下列说法正确的是 A.上述生成 Ni(CO)4 的反应为吸热反应 B.80 ℃时,测得某时刻 Ni(CO)4、CO 浓度均为 0.5 mol·L-1,则此时 v(正)>v(逆) C.恒温恒压下,若向容器中再充入少量的 Ar,上述平衡将正向移动 D.将粗 Ni 与 CO 密封在一玻璃管内,通过调节两端温度,可以提纯 Ni. 13.在容积固定不变的密闭容器中加入 1mol N2 和 3mol H2 发生反应: N2(g)+3H2(g) 2NH3(g) △H= -92.4 kJ·mol-1,下列结论正确的是 饱和食盐水 混有 HCl 的 Cl2 A.该反应达到平衡时,放出的热量等于 92.4KJ B.达到平衡前后,混合气体的平均分子量和密度均不变 C.降低温度和缩小容器体积均可使该反应的平衡常数增大 D.若达到平衡时 N2 的转化率为 20%,则平衡时容器内的压强是起始时的 90% 14.右图是可逆反应 X2 + 3Y2 2Z2 在反应过程中的反应速率(Ʋ)与时间(t)的关系曲 线,下列叙述正确的是 A.t1 时,只有正方向反应 B.t2 时,反应停止 C.t2- t3,平均反应速率为零 D.t2- t3,各物质的百分含量相等 15. 实验室将 I2 溶于 KI 溶液中,配制浓度较大的碘水,主要是因为发生了反应: I2(aq)+I-(aq) I- 3 (aq),上述平衡体系中,I - 3 的物质的量浓度 c(I- 3 ) 与温度 T 的关系如图所示(曲线上的任何一点都表示平衡状态, 温度对速率的影响比浓度大得多),下列说法不.正确的是 A.该反应的正反应是放热反应 B.A 点与 C 点的化学反应速率 v(A)查看更多