2017-2018学年江西省奉新县第一中学高二上学期第一次月考化学试题
奉新一中2017-2018学年高二上学期第一次月考化学试卷
命题人:左凯华 2017.10
相对原子质量:H-1 N-14 O-16 Na-23 Cl-35.5 Al-27 Fe-56 Cu-64
一.选择题(16题,每小题3分,共48分)
1.工业生产水煤气的反应为:C(s)+H2O(g)→CO(g)+H2(g)-131.4 kJ,下列判断正确的是( )
A.水煤气反应中生成1 mol H2(g)吸收131.4 KJ热量B.CO(g)+H2(g)→C(s)+H2O(l)+131.4kJ
C.反应物能量总和大于生成物能量总和D.水煤气反应中生成1体积CO吸收131.4KJ热量
2. N2H4是一种高效清洁的火箭燃料,8 g N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程式中正确的是( )
A. N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+267 kJ•mol﹣1
B. N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534 kJ•mol﹣1
C. N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ•mol﹣1
D. N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=﹣133.5 kJ•mol﹣1
3.物质A在一定条件下可发生如右图转化,下列关系错误的是( )
A. A→F,ΔH=-ΔH6
B. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
C. C→F,|ΔH|=|ΔH1+ΔH2-ΔH6|
D. |ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
4. N2(g)+3H2(g)⇌2NH3(g),已知反应过程中某一时刻N2,H2,NH3的浓度分别为0.1mol/L,0.2mol/L,0.2mol/L。当反应达到平衡时,可能存在的数据是( )
A.N2:0.2mol/L,H2:0.5mol/L B.N2,H2均为0.16mol/L C.N2:0.12mol/L D.NH3:0.4mol/L
5.为探究锌与稀硫酸反应速率(v(H2)表示),向反应混合溶液中加入下列物质,正确的是( )
A.加入NH4HSO4固体,v(H2)不变 B.加入少量锌,v(H2)增大
C.加入CH3COONa固体,v(H2)减小 D.滴加少量CuSO4溶液,v(H2)减小
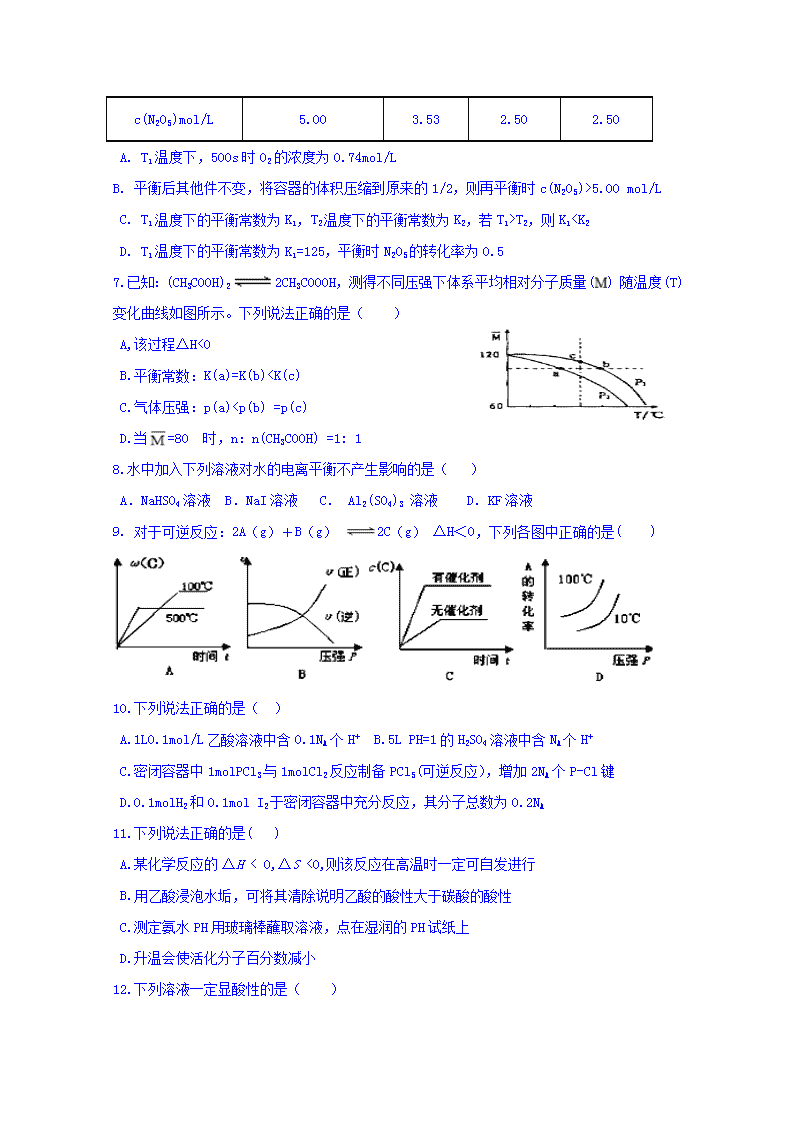
6. N2O5可发生以下反应:2N2O5(g) 4NO2(g)+O2(g)△H>0,T1温度时,向密闭容器中通入N2O5,实验数据见下表,下列说法不正确的是( )
时间/s
0
500
1000
1500
c(N2O5)mol/L
5.00
3.53
2.50
2.50
A. T1温度下,500s时O2的浓度为0.74mol/L
B. 平衡后其他件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5)>5.00 mol/L
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1
”、“<”或“=”);
(5)B的起始物质的量是
(6)平衡时体系内的压强为初始状态的___________倍。
18.(16分)25℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.7×10﹣5
K1=4.3×10﹣7 K2=5.6×10﹣11
3.0×10﹣8
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式: .
(3)CH3COOH溶液加水稀释过程中,下列数据变化情况(填“变大”、“变小”或“不变”)
① ;
② ;
③ ;
④ .
(4) pH=2的醋酸与HX分别加水稀释100倍,pH变化如上图,
则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的电离平衡常数:
理由是 .
19.(14分)用0.2000mol•L﹣1标准NaOH溶液滴定未知浓度盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.请回答:
(1)以上操作步骤中有一步有错误,请指出编号 ,该错误操作会导致测定
结果 (填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,NaOH溶液注入 中.(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是: (填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)到达滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变.
(5)以下是实验数据记录表:
滴定次数
盐酸体积(ml)
NaOH溶液体积读数(ml)
滴定前
滴定后
1
20.00
0.00
16.30
2
20.00
0.00
16.22
通过计算可得,该盐酸浓度为: mol•L﹣1(计算结果保留2位小数).
20.(8分)已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是 .
(2)若操作时分几次注入反应液,求得的反应热数值 (填“偏大”“偏小”或“无影响”).
(3)量取0.5mol/L的盐酸和0.55mol/L的NaOH溶液各50mL进行实验,测得盐酸和NaOH溶液起始平均温度为t1℃,混合反应后最高温度为t2℃,设溶液密度均为1g/mL,生成溶液的比热容c=4.18J/g•℃.请列式计算中和热:△H= kJ/mol(列出表达式不用化简).
(4)已知:HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H1=a kJ/mol
HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l)△H2=b kJ/mol
则NH3•H2O(aq)⇌NH4+(aq)+OH﹣(aq)△H3= kJ/mol(用a、b表示)
高二上学期第一次月考化学试卷参考答案
一. 选择题:(16题,每小题3分,共48分)
ABCCC CCBAD BDBDD C
二. 客观题(5题,共52分)
17. (14分)
(1). 2 (2). 0.004 mol·L-1·s-1 (3). 3A B+2C
(4). 60% > (5). . 0.04 mol (6). 1
18.(16分)
(1)CH3COOH>H2CO3>HClO;
(2)ClO﹣+CO2+H2O=HCO3﹣+HClO
(3)变小 不变 变大 不变
(4)大于;
当完全电离时应该是PH=4,现在PH值HX>CH3COOH,说明原来HX电离更多,故HX的电离平衡常数>醋酸的电离平衡常数
19.(14分)(1)①;偏大(2)乙(3)BC(4)无;浅红(5)0.16
20.(8分)
(1)减少实验过程中的热量损失(2)偏小
(3)﹣
(4)b﹣a