- 2021-07-09 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年北京市第四中学高二上学期期中考试化学试题 缺答案
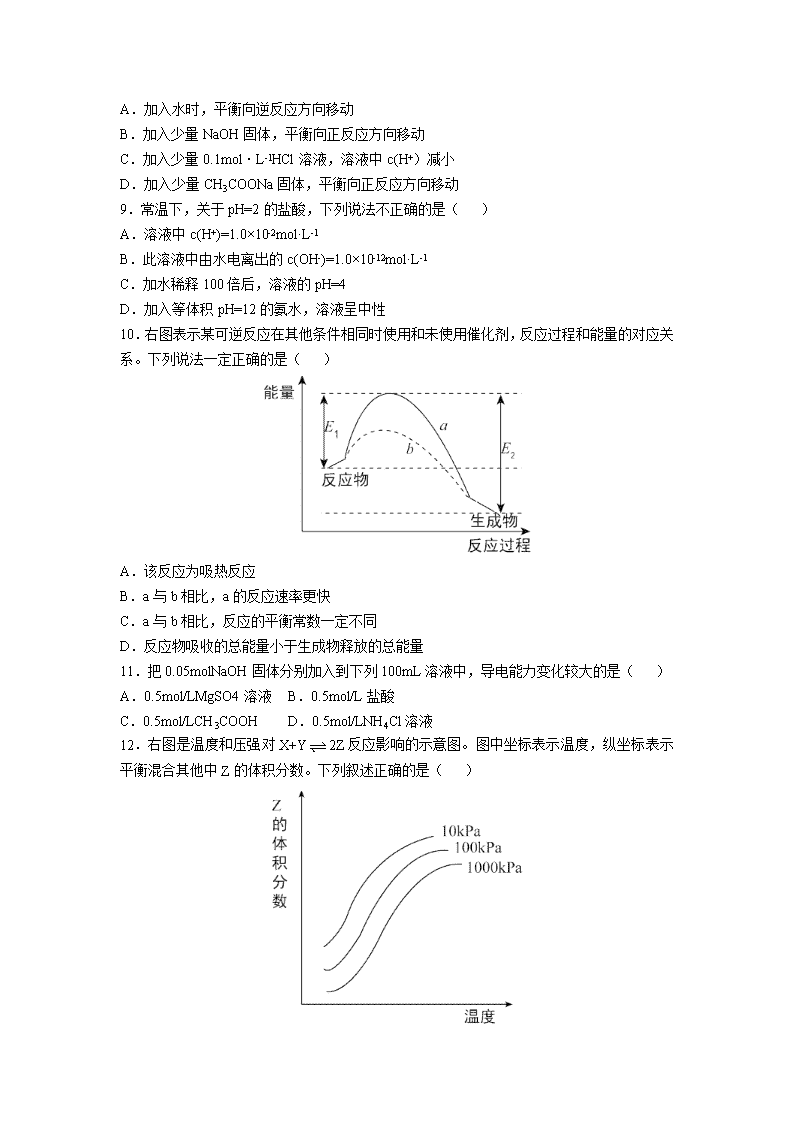
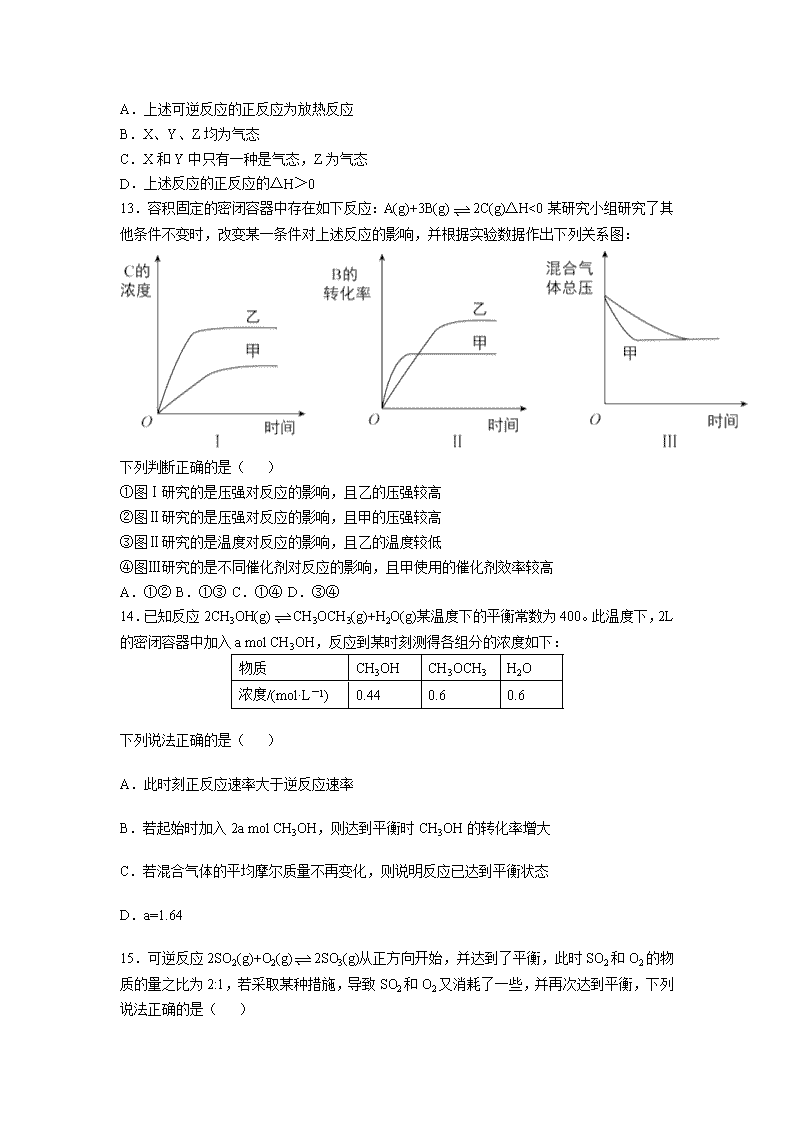
2017-2018学年北京市第四中学高二上学期期中考试化学试题 (试卷满分为100分,考试时间为100分钟) Ⅰ卷(选择题 答案填涂在机读卡上) 选择题(每小题只有1个选项符合题意。每小题2分,共44分。) 1.下列溶液中导电性最强的是( ) A. 1L0.1mol/L醋酸 B. 0.1L0.1mol/LH2SO4溶液 C. 0.5L0.1mol/L盐酸 D. 2L0.1mol/LH2SO3溶液 2.100℃时,KW=1×10-12,对纯水的叙述正确的是( ) A.pH=6显弱酸性 B.C(H+)=10-6mol/L,溶液为中性 C.KW是常温时的10-2倍 D.常温下,pH=6的溶液为中性 3.下列离子反应方程式中,不属于水解反应的是( ) A.NH4++H2OHN3·H2O+H+ B.HSO3+H2OH2SO3+OH- C.HCO3-+H2OH3O++CO32- D.AlO2+2HOAl(OH)3+OH- 4.醋酸的下列性质中,可以证明它是弱电解质的是( ) A.1mol / L醋酸溶液的pH约为2 B.醋酸能与水以任何比例互溶 C.10mL 1mol / L醋酸恰好与10mL 1mol / L NaOH溶液完全反应 D.在相同条件下,醋酸溶液的导电性比强酸溶液的弱 5.常温下,要使水的电离程度增大,并使c(H+)增大,应加入的物质是( ) A.NaHSO4 B.KAl(SO4)2 C.NaHCO3 D.CH3COONa 6.在一定条件下发生反应2A(g)=2B(g)+C(g),将2molA通入2L体积恒定的密闭容器甲中,若维持容器内温度不变,5min末测得A的物质的量为0.8mol。用C的浓度变化来表示反应的速率为( ) A.0.24mol/(L•min)B.0.12mol/(L•min) C.0.08mol/(L•min)D.0.06mol/(L•min) 7.物质的量浓度相同的下列各溶液,由水电离出的c(OH-)由大到小的顺序正确的是( ) ①NaHCO3 ②NaHSO4 ③Na2SO4 ④Na2CO3 A.①②③④ B.④③①② C.④①③② D.①④③② 8.在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是( ) A.加入水时,平衡向逆反应方向移动 B.加入少量NaOH固体,平衡向正反应方向移动 C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小 D.加入少量CH3COONa固体,平衡向正反应方向移动 9.常温下,关于pH=2的盐酸,下列说法不正确的是( ) A.溶液中c(H+)=1.0×10-2mol·L-1 B.此溶液中由水电离出的c(OH-)=1.0×10-12mol·L-1 C.加水稀释100倍后,溶液的pH=4 D.加入等体积pH=12的氨水,溶液呈中性 10.右图表示某可逆反应在其他条件相同时使用和未使用催化剂,反应过程和能量的对应关系。下列说法一定正确的是( ) A.该反应为吸热反应 B.a与b相比,a的反应速率更快 C.a与b相比,反应的平衡常数一定不同 D.反应物吸收的总能量小于生成物释放的总能量 11.把0.05molNaOH固体分别加入到下列100mL溶液中,导电能力变化较大的是( ) A.0.5mol/LMgSO4溶液 B.0.5mol/L盐酸 C.0.5mol/LCH3COOH D.0.5mol/LNH4Cl溶液 12.右图是温度和压强对X+Y2Z反应影响的示意图。图中坐标表示温度,纵坐标表示平衡混合其他中Z的体积分数。下列叙述正确的是( ) A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气态 C.X和Y中只有一种是气态,Z为气态 D.上述反应的正反应的△H>0 13.容积固定的密闭容器中存在如下反应:A(g)+3B(g)2C(g)△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: 下列判断正确的是( ) ①图Ⅰ研究的是压强对反应的影响,且乙的压强较高 ②图Ⅱ研究的是压强对反应的影响,且甲的压强较高 ③图Ⅱ研究的是温度对反应的影响,且乙的温度较低 ④图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 A.①② B.①③ C.①④ D.③④ 14.已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,2L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下: 物质 CH3OH CH3OCH3 H2O 浓度/(mol·L-1) 0.44 0.6 0.6 下列说法正确的是( ) A.此时刻正反应速率大于逆反应速率 B.若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大 C.若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 D.a=1.64 15.可逆反应2SO2(g)+O2(g)2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2:1,若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( ) A.新平衡体系中,SO2和O2物质的量之比仍为2:1 B.平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小 C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大 D.若所采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1:1 16.某温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)△H>0.当反应达平衡时,测得容器中各物质均为nmol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是( ) A.升高温度 B.加入催化剂 C.再加入n mol CO和n mol H2O D.再加入2n mol CO2和2n mol H2 17.在pH相同,体积相等的盐酸A和醋酸溶液B中,分别加入等质量的锌,若反应停止后,有一份溶液中锌有剩余,则正确的判断是( ) ①生成等量H2时反应所需时间B>A ②开始时反应速度 ③参加反应的锌的质量 ④整个反应阶段平均速度 ⑤盐酸中锌有剩余 ⑥乙酸溶液中锌有剩余 ⑦盐酸中放氢气多 ⑧乙酸溶液中放氢气多 A.③④⑤⑥ B.①③⑥⑦ C.①②③⑥ D.②③④⑤ 18.常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( ) A.甲中由水电离出来的H+的物质的量浓度是乙中水电离处理的H+的物质的量浓度的10 B.物质的量浓度c(甲)=10c(乙) C.中和等物质的量的NaOH溶液需甲、乙两种酸的体积,10V(甲)> V(乙) D.甲中的c(OH-)为乙中的c(OH-)的10倍 19.同温度、同物质的量浓度的下列溶液,下列说法正确的是( ) A.NH4Cl溶液和(NH4)2SO4溶液,NH4Cl溶液的pH小 B.Na2CO3溶液和NaHCO3溶液,Na2CO3溶液的pH大 C.NH4Cl溶液和NH4HSO4溶液,c(NH4+)相同 D.NH4Cl溶液和(NH4)2SO4溶液,c(NH4+)之比为1/2 20.常温下,有关①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液,四种溶液的比较中,正确的是( ) A.水电离的c(H+):①=②=③=④ B.将②、③溶液混合后pH=7,则消耗溶液的体积:②=③ C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 D.向溶液中加入100mL水后,溶液的pH:③>④>①>② 21.常温下下列是几种弱酸的电离平衡常数: CH3COOH H2S HClO 1.8×10-5 K1=1.3×10-7 K2=7.1×10-15 4.69×10-11 下列说法正确的是( ) A.同物质的量浓度的Na2S、NaClO、CH3COONa溶液,pH最大的是NaClO溶液 B.同物质的量浓度的H2S、HClO、CH3COOH溶液,酸性最强的是CH3COOH C.同物质的量浓度的S2-、HS-、ClO、CH3COO-结合H+能力最强的是ClO- D.CH3COOH溶液与Na2S溶液不能反应生成NaHS 22.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( ) A.反应I2(aq)+I-(aq)=I3-(aq)的△H>0 B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 C.若反应进行到状态D时,一定有v正>v逆 D.状态a与状态b相比,状态b时I2的转化率更高 Ⅱ卷(非选择题,共56分,答案填写在答题纸上) 23.(5分)通常状况下,下列物质中①硫酸钡;②醋酸;③氯化氢;④三氧化硫;⑤氯气;⑥碳酸氢钠;⑦铜;⑧硫酸溶液;⑨氢氧化钾;⑩乙醇(下列各空填序号) (1)属于强电解质的是:__________。 (2)属于弱电解质的是:__________。 (3)能导电的是:__________。 (4)属于非电解质的是:__________。 24.(8分)在2HI(g)H2(g)+I2(g)中三种分子化学键断裂时能量变化如图1所示。其他条件相同,1molHI在不同温度分解达平衡时,测得体系中I2物质的量随温度变化的曲线如图2所示。 (1)比较2a__________b+c(填“<”、“>”或“=”)理由是____________________。 (2)某温度下该反应平衡常数为1/64,达平衡时,1molHI分解的转化率为__________。 (3)若利用此反应制备I2,则提高HI转化率的措施是__________(填字母序号)。 a.移走I2 b.加压 c.升高 d.增大HI浓度 25.(14分)温下,关于下列两个反应: a.0.1mol/L醋酸溶液:CH3COOHCH3COO-+H+ b.0.1mol/L醋酸钠溶液:CH3COO-+H2OCH3COOH+OH- (1)两式到达平衡后,在a中加入一定量的水后,平衡向右移动是__________,溶液的pH增大的是__________。 (2)向b中加入同浓度的醋酸钠溶液,溶液的pH将__________(填增大、减小、不变”),若加入浓度的醋酸钠溶液,溶液的pH将__________(填增大、减小、不变)。 (3)若向a反应中加入少量的醋酸钠固体,溶液的pH将__________,电离程度将__________,溶液的导电性将__________(填增大、减小、不变)。 26.(14分)硫酸是重要的化工材料,二氧化硫生成三氧化硫是共有制硫酸的重要反应之一。 (1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。 ①从平衡角度分析采用过量O2的目的是____________; ②计算该条件下反应的平衡常数K=___________。 ③已知:K(300℃)>K(350℃),该反应是________热反应。若反应温度升高,SO2的转化率_______(填“增大”、“减小”或“不变”)。 (2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。 (3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。 ①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲______乙。 ②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲____乙。 27.(8分) Ⅰ.常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下: 组别 一元酸 NaOH 混合溶液的pH 甲 c(H+)=0.1mol/L的HX酸 0.1 pH=a 乙 c(HY)=c1mol/L 0.1 pH=7 丙 c(HZ)=0.1mol/L 0.1 pH=9 (1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”),混合溶液中离子浓度由大到小顺序为__________。 (2)乙组实验中HY为强酸,则HY溶液的pH=__________。 (3)丙组实验发生反应的离子方程式为__________,所得溶液中由水电离出的c(OH-)=______mol/L。 Ⅱ.将0.1mol·L-1NaOH溶液分别滴入体积均为20mL、浓度均为0.1mol·L-1HCl溶液和HA溶液,溶液的pH随加入NaOH溶液体积变化如图: (1)HA为__________酸(填“强”或“弱”)。 (2)N点pH>7的原因是(用离子方程式表示)__________。 (3)下列说法正确的是__________(填字母)。 a.M点c(HA)查看更多
相关文章
- 当前文档收益归属上传用户