- 2021-07-09 发布 |
- 37.5 KB |
- 15页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高中化学必修1课件:第1章 第2节 高中化学计量在实验中的应用(3)
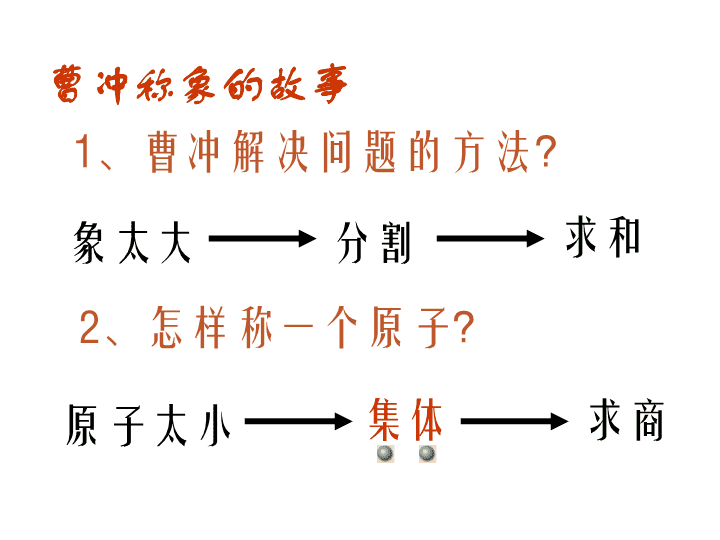
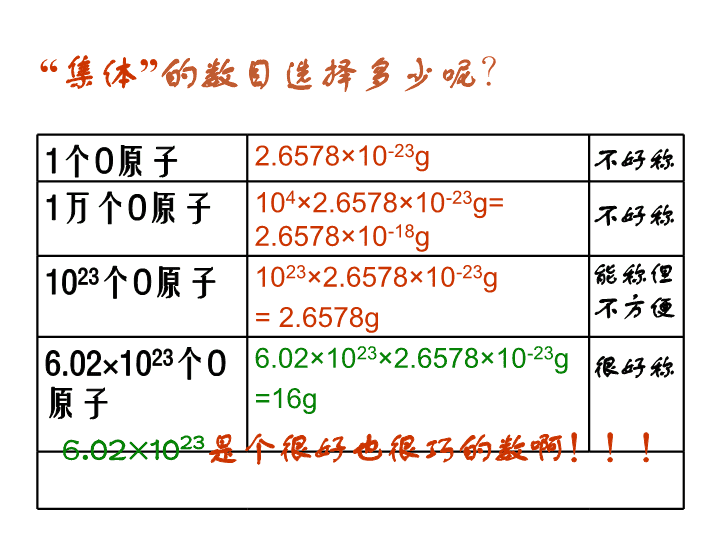
第 二节 化学计量在实验中的应用 曹冲称象的故事 1、曹冲解决问题的方法? 2、怎样称一个原子? 象太大 分割 求和 原子太小 集体 求商 1个O原子 2.6578×10-23g 1万个O原子 104×2.6578×10-23g= 2.6578×10-18g 1023个O原子 1023×2.6578×10-23g = 2.6578g 6.02×1023个O 原子 6.02×1023×2.6578×10- 23g =16g “集体”的数目选择多少呢? 不好称 不好称 能称但 不方便 很好称 6.02×1023是个很好也很巧的数啊!!! 6.02×1023 个H的质量 6.02×1023 个O的质量 6.02×1023 个Fe的质量 6.02×1023 个C的质量 6.02×1023 个OH-的质量 6.02×1023 个SO42-的质量 那么其他的微粒呢? 1g 16g 56g 12g 17g 96g 6.02×1023 个微粒称作1摩尔(1mol) 6.02×1023个O 6.02×1023个C 3.01×1023个H2O 9.03×1023个H 9.03×1023个H+ 1.204×1024个NaCl 1.806×1024个SO42- 1mol O 1molC 0.5mol H2O 1.5mol H 1.5mol H+ 2mol NaCl 3mol SO42- 16 g 12 g 9 g 1.5 g 1.5 g 117 g 288 g 一、物质的量: 衡量物质所含微粒多少的物理量。单位是摩尔(mol) •每摩尔物质含有6.02×1023个该物质的微粒 •含有6.02×1023个时,该物质的物质的量为1mol 物质所含微粒数 物质的量(mol) ÷ 6.02×1023 6.02×1023× •6.02×1023mol-1 叫做阿伏加德罗常数,符号NA •使用摩尔时,必须指明粒子(原子、分子等)的种类 练习1:6.02×1023 个H的“物质的量”是_____ 练习2: 1.204×1024 个H+的“物质的量”是_____ 练习3: 1.806×1024 个e-的“物质的量”是_____ 练习4: 2.107×1024 个H2O中 水的“物质的量”是_________, 氢原子的“物质的量”是________, 氧原子的“物质的量”是_________。 1 mol 2 mol 3 mol 3.5 mol 7 mol 3.5 mol 练习1:1 mol C中约含有————————个碳原子 练习2:1.5 mol H2O中约含有———————个水分 子 练习3:0.5 mol SO42-中约含有————————个SO42-离子 练习4: 1 mol 的Na2CO3中 含有———————— 个Na+ 含有———————— 个CO32-离子, 总共含有———————— 个离子。 6.02×1023 9.03×1023 3.01×1023 1.806 ×1024 1.204×1024 6.02×1023 二、摩尔质量 1mol物质的质量称为该物质的摩尔质量,单位是g ● mol- 1.摩尔质量在数值上等于原子量或分子量、离子的式量。 Fe的摩尔质量是__________ 水的摩尔质量是__________ NaCl的摩尔质量是_________ OH-的摩尔质量是_________ 2.摩尔质量的数学计算: 摩尔质量(g ● mol -) 质量(g) 物质的量(mol) = 56 g · mol- 18 g · mol- 58.5 g · mol- 17 g · mol- 练习1:已知1.5 mol某气体的质量是48 g (1)求这种气体的摩尔质量 (2)这种气体是_____ A.CO2 B.SO2 C.O2 D.NO 解:已知n=1.5 mol m=48 g molgmol g n mM ·325.1 48 ∴这种气体是O2 练习2: (1)已知2.5 mol某物质的质量是75 g,其摩尔质量是 __________ (2)已知2 mol某物质的质量是142g ,其摩尔质量是 __________ 30 g . mol- 71 g . mol- 练习2: (1)1.5molCl2的质量是___________ (2)3molH2的质量是___________ (3)2.5molO2的质量是___________ (4)0.5molNaOH的质量是___________ (5)2molNaCl的质量是___________ (1)解:已知n=1.5 mol,M(Cl2) =71g ·mol- gmolgmolMnm cl 5.106715.12 106.5 g 6 g 80 g 20 g 117 g 练习3: (1) 142 g Cl2的物质的量是___________ (2) 24 g O2的物质的量是___________ (3) 60 g NaOH的物质的量是___________ (4) 80 g CuSO4的物质的量是___________ (5) 49 g H2SO4的物质的量是___________ 解(1):已知m=142g M( Cl2 )=71g·mol- molmolg g M mn cl 271 142 2 2mol 0.75mol 1.5mol 0.5mol 0.5mol 物质所含微粒数 物质的量(mol) ÷ 6.02×1023 6.02×1023× 一、物质的量: 衡量物质所含微粒多少的物理量。单位是摩尔(mol) 二、摩尔质量 1mol物质的质量称为该物质的摩尔质量,单位是g ● mol- 1.摩尔质量在数值上等于原子量或分子量、离子的式量。 2.摩尔质量的数学计算: 摩尔质量(g ● mol-) 质量(g) 物质的量(mol)= 阿伏加德罗常数 NA = 6.02×1023 mol- 用NA表示 微粒数(N) 物质的量(n) ÷ NA NA× 质量(m) ×M(g·mol-) M(g·mol-) ÷ 要先求物质的量 要先求物质的量 例题:求1.204×1023个SO2的质量 解: molnSO 2.01002.6 10204.1 23 23 2 gmolgmolomSO 8.12642.2 练习: 1.求1.806 ×1023个CO2的质量;2.求9.03 ×1023个H2SO4的质量 例题:求32gSO2中氧原子的个数 解: mol5.0molg64 g32n 2SO mol1mol5.02n2n 2SOO 练习: 1.求49 g硫酸中氧原子的个数;2.求48 g甲烷中氢原子的个数 2323 10026100261 ..NnN AOO查看更多