- 2021-07-09 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习(苏教版)原电池 化学电源作业
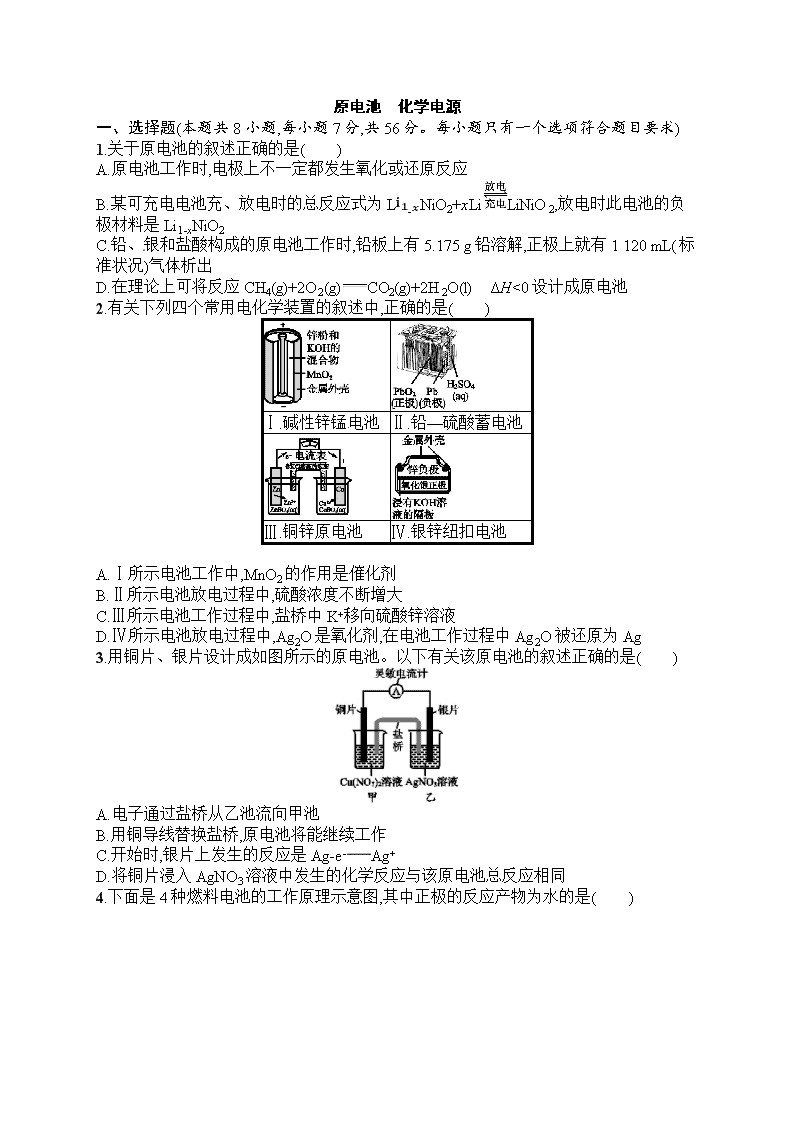
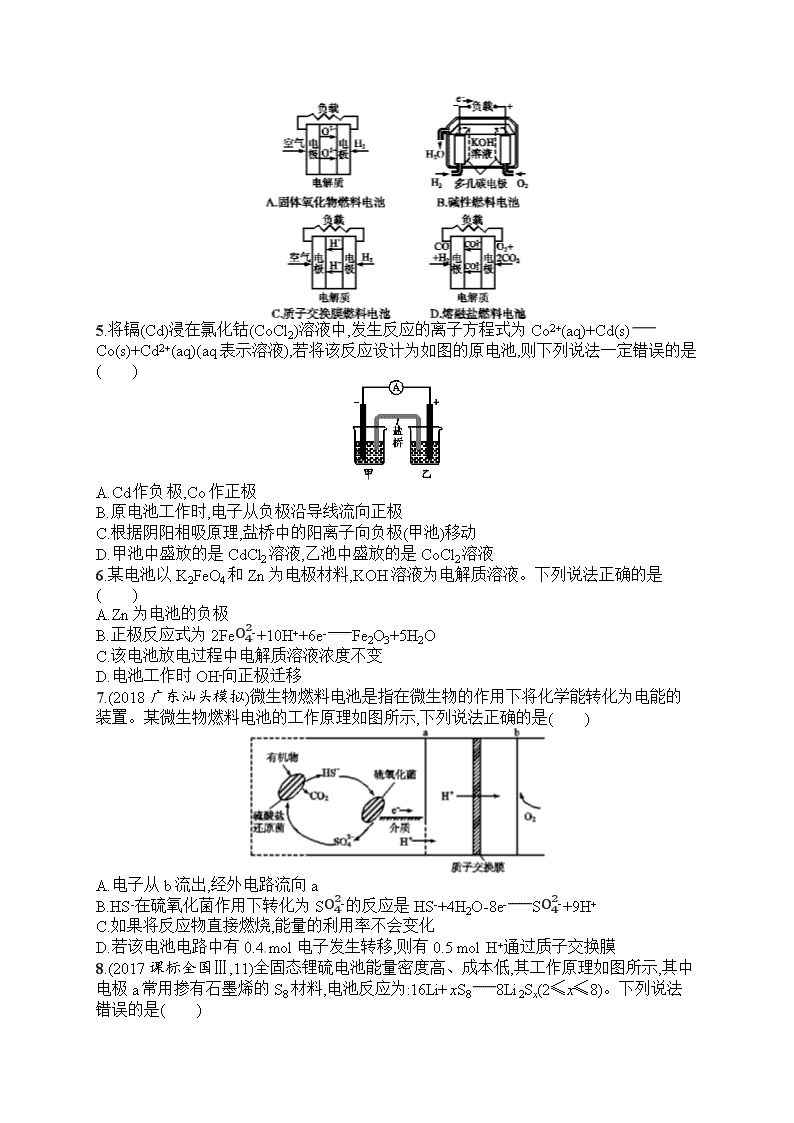
原电池 化学电源 一、选择题(本题共8小题,每小题7分,共56分。每小题只有一个选项符合题目要求) 1.关于原电池的叙述正确的是( ) A.原电池工作时,电极上不一定都发生氧化或还原反应 B.某可充电电池充、放电时的总反应式为Li1-xNiO2+xLiLiNiO2,放电时此电池的负极材料是Li1-xNiO2 C.铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1 120 mL(标准状况)气体析出 D.在理论上可将反应CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH<0设计成原电池 2.有关下列四个常用电化学装置的叙述中,正确的是( ) Ⅰ.碱性锌锰电池 Ⅱ.铅—硫酸蓄电池 Ⅲ.铜锌原电池 Ⅳ.银锌纽扣电池 A.Ⅰ所示电池工作中,MnO2的作用是催化剂 B.Ⅱ所示电池放电过程中,硫酸浓度不断增大 C.Ⅲ所示电池工作过程中,盐桥中K+移向硫酸锌溶液 D.Ⅳ所示电池放电过程中,Ag2O是氧化剂,在电池工作过程中Ag2O被还原为Ag 3.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( ) A.电子通过盐桥从乙池流向甲池 B.用铜导线替换盐桥,原电池将能继续工作 C.开始时,银片上发生的反应是Ag-e-Ag+ D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 4.下面是4种燃料电池的工作原理示意图,其中正极的反应产物为水的是( ) 5.将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为Co2+(aq)+Cd(s)Co(s)+Cd2+(aq)(aq表示溶液),若将该反应设计为如图的原电池,则下列说法一定错误的是( ) A.Cd作负极,Co作正极 B.原电池工作时,电子从负极沿导线流向正极 C.根据阴阳相吸原理,盐桥中的阳离子向负极(甲池)移动 D.甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液 6.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法正确的是( ) A.Zn为电池的负极 B.正极反应式为2FeO42-+10H++6e-Fe2O3+5H2O C.该电池放电过程中电解质溶液浓度不变 D.电池工作时OH-向正极迁移 7.(2018广东汕头模拟)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( ) A.电子从b流出,经外电路流向a B.HS-在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-SO42-+9H+ C.如果将反应物直接燃烧,能量的利用率不会变化 D.若该电池电路中有0.4 mol电子发生转移,则有0.5 mol H+通过质子交换膜 8.(2017课标全国Ⅲ,11)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS88Li2Sx(2≤x≤8)。下列说法错误的是( ) A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-3Li2S4 B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C.石墨烯的作用主要是提高电极a的导电性 D.电池充电时间越长,电池中Li2S2的量越多 二、非选择题(本题共3小题,共44分) 9.(14分)(1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为 ,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH会 (填“升高”“降低”或“基本不变”)。 (2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是 (填化学名称),负极反应为 ;正极反应为 。 (3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32--4e-4CO2,则正极反应式为 ,电池总反应式为 。 10.(15分)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题: (1)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。 已知:①N2(g)+2O2(g)N2O4(l) ΔH1=-19.5 kJ·mol-1 ②N2H4(l)+O2(g)N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1 写出肼和N2O4反应的热化学方程式: 。 (2)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为 。 (3)科研人员开发出一种由甲醇和氧气构成,以强碱溶液作电解质溶液的新型手机电池,充一次电可供手机连续使用一个月,则通入甲醇的是 (填“正”或“负”)极,写出该电池的负极反应式: 。 (4)Zn-MnO2干电池应用广泛,电解质溶液是ZnCl2和NH4Cl的混合溶液。 ①该电池的负极材料是 (填名称)。电池工作时,电子流向 (填“正极”或“负极”)。 ②若ZnCl2和NH4Cl混合溶液中含有杂质Cu2+,则会加速某电极的腐蚀,其主要原因是 。 ③MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式为 。若电路中通过4 mol电子,标准状况下产生气体的物质的量为 。 11.(15分)SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。 (1)利用电化学原理将CO、SO2转化为重要的化工原料,装置如图所示: ①若A为CO,B为H2,C为CH3OH,则通入CO的一极为 极。 ②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 。 ③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为 。 (2)某碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图所示。 ①电池总反应为 。 ②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为 L。若电解后溶液体积为2 L,溶液的pH约为 。 (3)某研究小组利用下列装置用N2O4生产新型硝化剂N2O5。 ①现以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。在该电极上同时还引入CO2的目的是 。 ②电解过程中,生成N2O5的电极反应方程式为 。 课时规范练17 原电池 化学电源 1.D A中原电池工作时电极上一定都发生氧化反应或还原反应;B中电池放电时,负极材料是Li;C中通过计算知正极上生成的气体在标准状况下的体积应为560 mL。 2.D 碱性锌锰电池中二氧化锰为氧化剂,A项错误;铅蓄电池放电时电池反应为Pb+PbO2+2H2SO42PbSO4+2H2O,H2SO4浓度减小,B项错误;原电池中阳离子向正极移动,故盐桥中K+移向硫酸铜溶液,C项错误;该原电池中,正极上氧化银得电子生成银,所以Ag2O作氧化剂,D项正确。 3.D 题给原电池负极铜失电子,正极上Ag+得电子,电子从负极沿导线流向正极,电解质溶液通过离子的定向移动形成电流,所以电子不会经过电解质溶液,故A项错误;用铜线代替盐桥,乙池是原电池,甲池是电解池发生电镀,所以不是原来的原电池反应原理,故B项错误;银片是原电池的正极,溶液中的银离子得到电子发生还原反应,电极反应为Ag++e-Ag,故C项错误;铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应都是Cu+2Ag+2Ag+Cu2+,故D项正确。 4.C A项,通空气的电极作正极,正极反应式为O2+4e-2O2-,不符合题意;B项,通入氧气的一极作正极,电解质溶液是碱性溶液,电极反应式为O2+2H2O+4e-4OH-,不符合题意;C项,通入空气的一极作正极,电解质传递H+,正极反应式为O2+4H++4e-2H2O,符合题意;D项,通入氧气的一极作正极,依据电池内部传递CO32-,正极反应式为O2+2CO2+4e-2CO32-,不符合题意。 5.C 在电池反应中,Co2+得电子发生还原反应,则Co作正极、Cd作负极;放电时,电子从负极Cd沿导线流向正极Co;盐桥中阳离子向正极区域乙移动、阴离子向负极区域甲移动;甲中电极失电子发生氧化反应,电解质溶液为CdCl2溶液,乙池中盛放的是CoCl2溶液。 6.A 根据化合价升降判断,Zn化合价只能上升,故为负极材料,K2FeO4为正极材料,A项正确;KOH溶液为电解质溶液,则正极电极反应式为2FeO42-+6e-+8H2O2Fe(OH)3+10OH-,B项错误;由电池总反应式3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH可得,放电过程中电解质溶液浓度发生变化,C项错误;电池工作时阴离子OH-向负极迁移,D项错误。 7.B b电极通入氧气,是正极,a电极是负极,电子从a电极流出,经外电路流向b电极,A错误;a电极是负极,发生失去电子的氧化反应,即HS-在硫氧化菌作用下转化为SO42-,电极反应为HS-+4H2O-8e-SO42-+9H+,B正确;如果将反应物直接燃烧,会有部分化学能转化为光能,因此能量的利用率会变化,C错误;若该电池电路中有0.4 mol电子发生转移,根据电荷守恒可知有0.4 mol H+通过质子交换膜与0.1 mol氧气结合转化为水,D错误。 8.D A项,在该电池中电极a为正极,发生的反应依次为: S8+2Li++2e-Li2S8 3Li2S8+2Li++2e-4Li2S6 2Li2S6+2Li++2e-3Li2S4 Li2S4+2Li++2e-2Li2S2,故A正确;B项,原电池工作时,转移0.02 mol电子时,被氧化的Li的物质的量为0.02 mol,质量减少0.14 g,正确;C项,石墨烯能导电,利用石墨烯作电极,可提高电极a的导电性,正确;D项,电池充电时由于Li+得到电子生成Li,则电池充电时间越长,电池中Li2S2的量越少,错误。 9.答案 (1)4H++2NO3-+2e-2NO2↑+2H2O Cu-2e-Cu2+ 升高 (2)铝 4Al-12e-4Al3+ 3O2+6H2O+12e-12OH- (3)O2+2CO2+4e-2CO32- 2CO+O22CO2 解析 (1)Fe在浓硝酸中发生钝化,作正极,B电极的电极反应式为4H++2NO3-+2e-2NO2↑+2H2O,A电极的电极反应式为Cu-2e-Cu2+;反应消耗H+,反应进行一段时间后溶液C的pH会升高。(2)电源的负极材料是铝,负极反应为4Al-12e-4Al3+;正极反应为3O2+6H2O+12e-12OH-。(3)正极反应式为O2+2CO2+4e-2CO32-,电池总反应式为2CO+O22CO2。 10.答案 (1)2N2H4(l)+N2O4(l)3N2(g)+4H2O(g) ΔH=-1 048.9 kJ·mol-1 (2)N2H4-4e-+4OH-N2↑+4H2O (3)负 CH3OH-6e-+8OH-CO32-+6H2O (4)①锌 正极 ②Zn与Cu2+反应生成Cu,Zn、Cu形成原电池而加快Zn的腐蚀 ③Mn2+-2e-+2H2OMnO2+4H+ 2 mol 解析 (1)根据盖斯定律,由2×②-①得肼与N2O4反应的热化学方程式:2N2H4(l)+N2O4(l)3N2(g)+4H2O(g) ΔH=2ΔH2-ΔH1=-1 048.9 kJ·mol-1。(2)肼在负极上参加反应,根据反应②以及环境是碱性,可知电极反应式为N2H4+4OH--4e-N2↑+4H2O。(3)根据燃料电池的原理可知,通入甲醇的一极为负极,其电极反应式为CH3OH-6e-+8OH-CO32-+6H2O。(4)①锌是活泼金属,因此锌为负极,根据原电池的工作原理,电子从负极经外电路流向正极;②锌比铜活泼,能把铜置换出来,锌、铜与电解质溶液构成原电池,可加快锌的腐蚀;③阳极失电子发生氧化反应,因此阳极的电极反应式为Mn2++2H2O-2e-MnO2+4H+,阴极的电极反应式为2H++2e-H2↑,因此电路中通过4 mol e-,生成氢气的物质的量为2 mol。 11.答案 (1)①正 ②SO2-2e-+2H2OSO42-+4H+ ③O2+4e-+4H+2H2O (2)①CO+H2+O2CO2+H2O ②1.12 1 (3)①在电极上与O2共同转化为CO32-,保持熔融盐成分不变 ②N2O4+2HNO3-2e-2N2O5+2H+ 解析 (1)一氧化碳和氢气反应转化为甲醇的过程中氢元素的化合价升高,碳元素的化合价降低,因此氢气被氧化在负极反应,一氧化碳被还原在正极反应。二氧化硫、氧气和水反应生成硫酸过程中,硫元素化合价升高,二氧化硫被氧化在负极反应。二氧化氮、氧气和水反应生成硝酸过程中,氧元素的化合价降低,氧气被还原在正极反应。(2)一氧化碳和氢气按物质的量1∶1混合,再与氧气反应生成二氧化碳和水。电解硝酸银溶液时阴极反应为Ag++e-Ag,阳极反应为4OH--4e-2H2O+O2↑,生成21.6 g银时转移0.2 mol电子,根据电子守恒可知,阳极生成氧气0.05 mol,其在标准状况下的体积为1.12 L。生成氢离子0.2 mol,则氢离子的浓度为0.2mol2 L=0.1 mol·L-1,因此溶液的pH=1。(3)燃料电池工作时燃料失电子,在负极反应,因此氢气在负极失去电子被氧化,转化为氢离子,氢离子和碳酸根离子结合,最终转化为二氧化碳和水。氧气在正极反应,得到电子被还原,转化为氧负离子,氧负离子和二氧化碳结合,最终转化为碳酸根离子,进而保证了电解质熔融盐成分不变。二氧化氮转化为五氧化二氮,氮元素化合价升高,发生失电子的氧化反应。查看更多