- 2021-07-09 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第2讲 原电池 化学电源-热点模型7 盐桥原电池
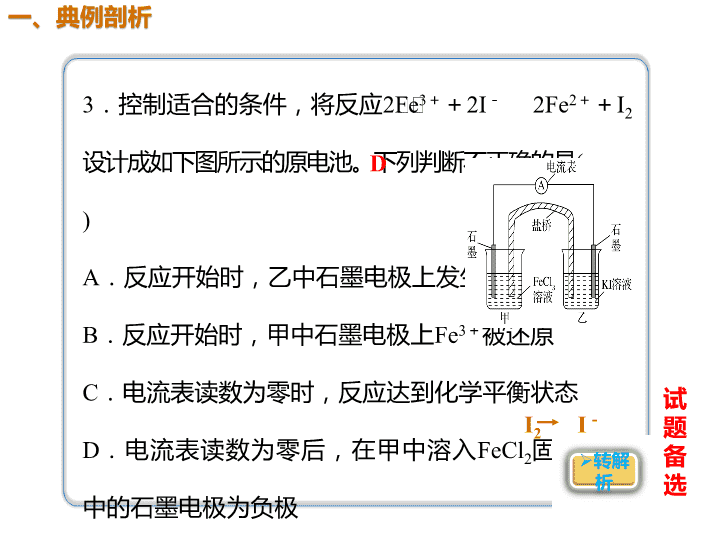
3.控制适合的条件,将反应2Fe3++2I- 2Fe2++I2 设计成如下图所示的原电池。下列判断不正确的是( ) A.反应开始时,乙中石墨电极上发生氧化反应 B.反应开始时,甲中石墨电极上Fe3+被还原 C.电流表读数为零时,反应达到化学平衡状态 D.电流表读数为零后,在甲中溶入FeCl2固体,乙 中的石墨电极为负极 试 题 备 选 D I2 I- 解析 由图示结合原电池原理分析可知,Fe3+得 电子变成Fe2+被还原,I-失去电子变成I2被氧化, 所以A、B正确;电流表读数为零时,Fe3+得电子 速率等于Fe2+失电子速率,反应达到平衡状态,C 正确;D项,在甲中溶入FeCl2固体,平衡向左移 动,I2被还原为I-,乙中石墨为正极,D不正确。 (2017·浙江省高三六校联考)将反应IO3-+5I-+6H+ 3I2 +3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少 量浓硫酸,电流表指针发生偏转,一段时间后,电流表指针回 到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流表指针再次 发生偏转。下列判断不正确的是( ) A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入 淀粉溶液,只有乙烧杯中溶液变蓝 C.电流表读数为零时,反应达到化学平衡状态 D.两次电流表指针偏转方向相反 B 加入少量浓H2SO4时,电极反应式: 负极:10I--10e-===5I2 正极:2IO3-+10e-+12H+===I2+ 6H2O 两个烧杯都变 蓝 【试题备选】 解析 加入少量浓H2SO4时,电极反应式: 负极:10I--10e-===5I2 正极:2IO3-+10e-+12H+===I2+6H2O 加入几滴浓NaOH溶液时,电极反应式: 负极:5I2+10e-===10I- 正极:I2-10e-+12OH-===2IO3-+6H2O B项,根据电极反应可以看出,甲、乙烧杯 中均有I2生成, 所以甲、乙烧杯中溶液均变蓝。查看更多