- 2021-07-09 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版碳、硅及无机非金属材料学案
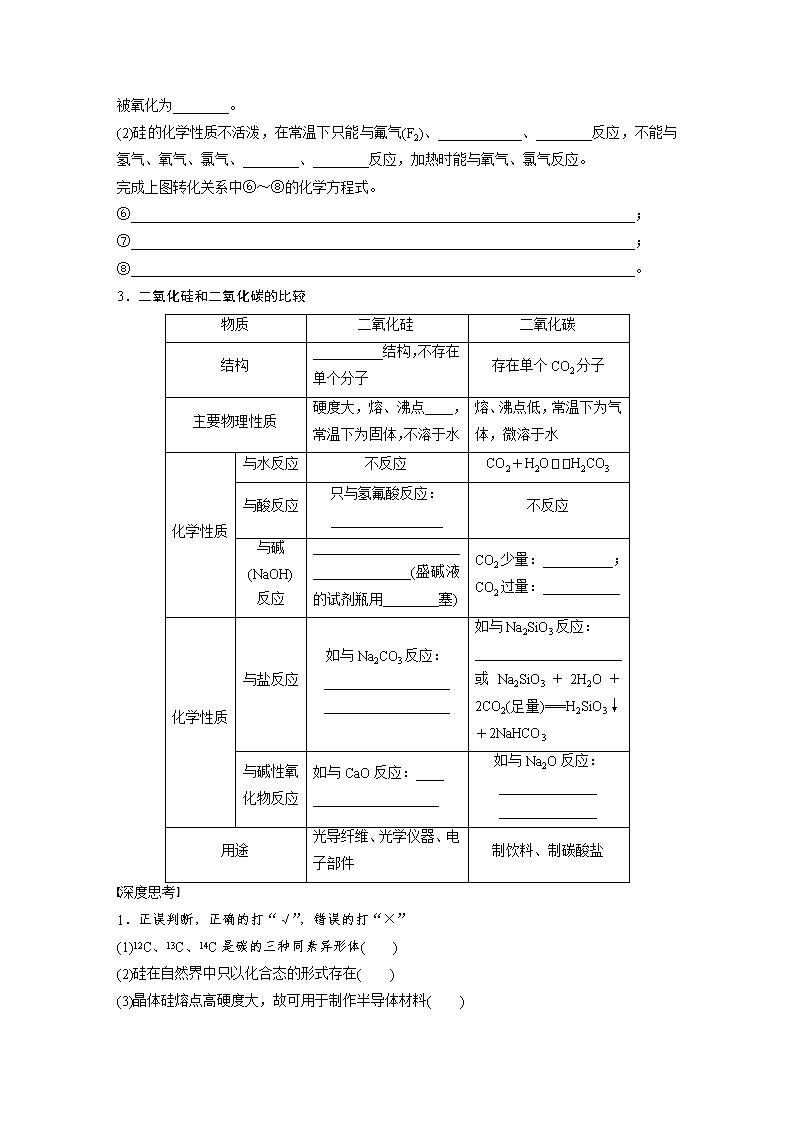
碳、硅及无机非金属材料 考点一 碳、硅单质及氧化物 【基础知识梳理】 1.C、Si单质的存在形态、物理性质及用途 (1)自然界中的碳元素既有游离态,又有化合态,而硅元素因有亲氧性,所以仅有________态。碳单质主要有金刚石、石墨、C60等同素异形体,硅单质主要有__________和____________两大类。 (2)单质的结构、物理性质与用途比较 碳 硅 结构 金刚石:__________结构,石墨:层状结构 晶体硅:与金刚石类似的____________结构 物理 性质 金刚石熔点高、硬度大 石墨熔点高、质____,有滑腻感 晶体硅为灰黑色固体,有金属光泽、硬度大、熔点______ 用途 金刚石用作切割刀具,________用作电极、铅笔芯 晶体硅用作________材料、硅芯片和硅太阳能电池 2.碳、硅单质的化学性质——还原性 碳、硅的最外层都是________个电子,位于元素周期表的第________族,不容易失也不容易得电子,通常化学性质稳定,但在一定条件下也能与许多物质发生化学反应,一般表现为还原性(如图)。 (1)碳的还原性 碳有重要的用途,除了在氧气中燃烧利用其热能外,还能用于金属冶炼(如铜)、制取粗硅、生产水煤气等,完成上图转化关系中①~④的化学方程式。 ①________________________________________________________________________; ②________________________________________________________________________; ③________________________________________________________________________; ④________________________________________________________________________。 碳的还原性还表现为可将强氧化性的浓硫酸、浓硝酸分别还原为________和________, 本身被氧化为________。 (2)硅的化学性质不活泼,在常温下只能与氟气(F2)、____________、________反应,不能与氢气、氧气、氯气、________、________反应,加热时能与氧气、氯气反应。 完成上图转化关系中⑥~⑧的化学方程式。 ⑥________________________________________________________________________; ⑦________________________________________________________________________; ⑧________________________________________________________________________。 3.二氧化硅和二氧化碳的比较 物质 二氧化硅 二氧化碳 结构 __________结构,不存在单个分子 存在单个CO2分子 主要物理性质 硬度大,熔、沸点____,常温下为固体,不溶于水 熔、沸点低,常温下为气体,微溶于水 化学性质 与水反应 不反应 CO2+H2OH2CO3 与酸反应 只与氢氟酸反应: ________________ 不反应 与碱 (NaOH)反应 ___________________________________(盛碱液的试剂瓶用________塞) CO2少量:__________; CO2过量:___________ 化学性质 与盐反应 如与Na2CO3反应: __________________ __________________ 如与Na2SiO3反应: _____________________或Na2SiO3+2H2O+2CO2(足量)===H2SiO3↓+2NaHCO3 与碱性氧化物反应 如与CaO反应:____ __________________ 如与Na2O反应:______________ ______________ 用途 光导纤维、光学仪器、电子部件 制饮料、制碳酸盐 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)12C、13C、14C是碳的三种同素异形体( ) (2)硅在自然界中只以化合态的形式存在( ) (3)晶体硅熔点高硬度大,故可用于制作半导体材料( ) (4)Si和SiO2都可用于制造光导纤维( ) (5)非金属性:C>Si,则热稳定性:CH4>SiH4( ) (6)SiO2是酸性氧化物,可溶于强碱(NaOH),不溶于任何酸( ) 2.从元素周期表的位置看,碳和硅均为ⅣA族元素,自然界中有碳的多种单质存在,自然界中有硅的单质吗?为什么? ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 3.写出除去下列气体中混有的杂质(括号内为杂质)可采取的方法: (1)CO(CO2):____________________________________________________________。 (2)CO2(CO):____________________________________________________________。 (3)CO2(HCl):___________________________________________________________。 4.写出除去下列固体粉末中混有杂质(括号内为杂质)可采取的方法,写出有关反应的方程式。 (1)CaCO3(SiO2)_________________________________________________________________ ______________________________________________________________________________。 (2)SiO2(CaCO3)__________________________________________________________________ ______________________________________________________________________________。 (3)SiO2(NH4Cl)___________________________________________________________________ ______________________________________________________________________________。 【解题探究】 题组一 碳及氧化物的性质及应用 1.近年来科学家制造出大量的新物质,对下列三种物质的相关说法错误的是( ) 石墨烯:从石墨中分离出来,是最薄、最坚硬的纳米材料 石墨炔:平面网状结构的全碳分子,具有优良的化学稳定性 纳米碳管:具有优良的场发射性能,制作阴极显像管、储氢材料 A.石墨烯具有良好的导电性 B.上述三种物质与金刚石互为同素异形体 C.石墨炔孔径略大于H2分子的直径,可作H2的提纯薄膜 D.上述三种物质与浓硫酸都能发生反应,但反应产物不同 2.(2016·石家庄质检)下列关于碳和碳的化合物的说法不正确的是( ) A.过多CO2排放会导致“温室效应”,应提倡“低碳生活” B.一氧化碳易与血液中的血红蛋白结合 C.金刚石和石墨都是碳单质,但原子排列方式不同,物理性质差别很大 D.石墨转变为金刚石的反应属于氧化还原反应 题组二 硅和二氧化硅的特性 3.(2016·广州模拟)硅及其化合物的应用范围很广。下列说法正确的是( ) A.硅是人类将太阳能转换为电能的常用材料 B.粗硅制备单晶硅不涉及氧化还原反应 C.反应Si+2NaOH+H2O===Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂 D.硅能与氢氟酸反应,则硅可以与盐酸反应 4.(2016·樟树一模)由下列实验事实得出的结论正确的是( ) A.由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐 B.由SiO2+2CSi+2CO↑,可知碳的非金属性大于硅 C.CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 D.SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物 5.二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行的判断,其中正确的是( ) ①SiO2+2NaOH===Na2SiO3+H2O ②SiO2+2CSi+2CO↑ ③SiO2+4HF===SiF4↑+2H2O ④Na2CO3+SiO2Na2SiO3+CO2↑ ⑤SiO2+3CSiC+2CO↑ a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃 b.反应②中SiO2表现出氧化性 c.反应③中SiO2表现了酸性氧化物的通性 d.反应④符合用难挥发性的酸酐制取易挥发性的酸酐的道理 e.反应⑤中SiO2未参加氧化还原反应 A.aceB.bdeC.cdeD.ab 【归纳总结】 熟记硅及其化合物的特殊性质 (1)硅单质的特殊性 ①Si的还原性大于C,但C却能在高温下还原出Si:SiO2+2CSi+2CO↑; ②非金属单质一般不跟非氧化性酸反应,但Si能与HF反应:Si+4HF===SiF4↑+2H2↑; ③非金属单质大多为非导体,但Si为半导体。 (2)含硅化合物的特殊性 ①SiO2是H2SiO3的酸酐,但它不溶于水,不能直接与水作用制备H2SiO3; ②酸性氧化物一般不与酸反应,但SiO2能跟HF反应:SiO2+4HF===SiF4↑+2H2O; ③无机酸一般易溶于水,但H2SiO3难溶于水; ④因H2CO3的酸性大于H2SiO3,所以在Na2SiO3溶液中通入少量CO2能发生下列反应:Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,但在高温下SiO2+Na2CO3Na2SiO3+CO2↑也能发生。 题组三 硅的制取方法 6.从石英砂制取高纯硅的主要化学反应如下: ①SiO2+2CSi(粗)+2CO↑ ②Si(粗)+2Cl2SiCl4 ③SiCl4+2H2Si(纯)+4HCl 关于上述反应的叙述不正确的是( ) A.①③是置换反应,②是化合反应 B.高温下,焦炭与氢气的还原性均强于硅 C.任一反应中,每消耗或生成28g硅,均转移4mol电子 D.高温下在炉子里将石英砂、焦炭、氯气、氢气按比例混合就能得到高纯硅 7.硅单质及其化合物应用范围很广。请回答下列问题: (1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: ①写出由纯SiHCl3制备高纯硅的化学反应方程式:________________________________ ________________________________________________________________________。 ②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:__________________________________________________; H2还原SiHCl3过程中若混有O2,可能引起的后果是_________________________________ ______________________________________________________________________________。 (2)化学研究性学习小组在探究硅的制取方法时,从资料查阅到下列信息: Ⅰ.Mg在高温条件下可与SiO2反应; Ⅱ.金属硅化物与稀H2SO4反应生成硫酸盐和SiH4; Ⅲ.SiH4在空气中自燃。 他们根据信息进行实验,当用足量稀H2SO4溶解第①步实验获得的固体产物时,发现有爆鸣声和火花;然后过滤、洗涤、干燥;最后称量、计算,测得其产率只有预期值的63%左右。 ①第Ⅰ步实验发生反应的化学方程式是___________________________________________ _____________________________________________________________________________。 ②用稀H2SO4溶解第Ⅰ步实验获得固体产物时,产生爆鸣声和火花的原因是 _____________________________________________________________________________ _____________________________________________________________________________。 【反思归纳】 在设计制备纯硅的实验题中,常遇到的知识点有: (1)高温下用碳还原二氧化硅制得粗硅: SiO2+2CSi(粗)+2CO↑ (2)粗硅与干燥HCl气体反应制得SiHCl3: Si+3HClSiHCl3+H2 (3)粗硅与干燥Cl2反应制得SiCl4: Si(粗)+2Cl2SiCl4 (4)SiHCl3与过量H2在高温下反应制得纯硅: SiHCl3+H2Si(纯)+3HCl (5)SiCl4与过量H2在高温下反应制得纯硅: SiCl4+2H2Si(纯)+4HCl (6)SiO2+2Mg2MgO+Si (7)SiHCl3、SiCl4能与水发生反应: SiHCl3+3H2O===H2SiO3↓+3HCl+H2↑ SiCl4+3H2O===H2SiO3↓+4HCl (8)SiH4在空气中易自燃: SiH4+2O2===SiO2+2H2O 考点二 硅酸盐及无机非金属材料 【基础知识梳理】 1.硅酸和硅酸钠 (1)硅酸 硅酸不溶于水,其酸性比碳酸弱,硅酸________(填“能”或“不能”) 使紫色石蕊溶液变红色。 ①硅酸不稳定,受热易分解:______________________________________________________。 ②硅酸能与碱溶液反应,如与NaOH溶液反应的化学方程式为 ________________________________________________________________________。 ③硅酸在水中易聚合形成胶体。硅胶吸附水分能力强,常用作干燥剂。 (2)硅酸钠(Na2SiO3) ①白色、可溶于水的粉末状固体,其水溶液俗称________,有黏性,水溶液显碱性。 ②它能与酸性比硅酸强的酸反应,分别写出以下化学方程式: 与盐酸反应:_______________________________________________________________。 与CO2水溶液反应:_________________________________________________________ ________________________________________________________________________。 ③用途:黏合剂(矿物胶),耐火阻燃材料。 2.无机非金属材料 (1)传统无机非金属材料,如水泥、玻璃、陶瓷等硅酸盐材料。 ①常见硅酸盐材料比较 水泥 玻璃 陶瓷 生产原料 石灰石、黏土 纯碱、石灰石、石英 黏土 主要设备 水泥回转窑 玻璃窑 陶瓷窑 ②玻璃生产中的两个重要反应:Na2CO3+SiO2__________________;CaCO3+SiO2________________________________________________________________________。 (2)新型无机非金属材料,如高温结构陶瓷、光导纤维、生物陶瓷、压电陶瓷等。 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)玻璃是一种晶体,有较高的熔点( ) (2)水玻璃是一种特殊的玻璃,泡花碱属于碱( ) (3)传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料( ) (4)光导纤维、碳纳米管、氮化硅结构陶瓷等都是新型无机非金属材料( ) (5)高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点( ) (6)普通玻璃、石英玻璃、水泥、玛瑙都属于硅酸盐产品( ) 2.玻璃生产中的两个重要反应:Na2CO3+SiO2Na2SiO3+CO2↑;CaCO3+SiO2CaSiO3+CO2↑。由上述两个反应能说明H2SiO3的酸性比碳酸强吗?为什么? ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 3.实验室中要熔化烧碱固体,现有三种坩埚:石英坩埚、陶瓷坩埚、铁坩埚。你认为选哪一种?简述选择的依据。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 【解题探究】 题组一 无机非金属材料的组成性质及应用 1.下列关于硅材料的说法不正确的是( ) A.钢化玻璃与普通玻璃的主要成分基本相同 B.制普通玻璃的原料是石灰石、纯碱和石英砂 C.陶瓷是人类应用很早的硅酸盐材料 D.水玻璃是纯净物,可用于生产黏合剂和防火剂 2.硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是( ) A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4 B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承 C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2 D.二氧化硅为立体网状结构,其晶体中硅原子和硅氧单键个数之比为1∶2 3.化学家Seidel指出Si与NaOH溶液的反应,首先是Si与OH-反应,生成SiO,然后SiO迅速水解生成H4SiO4。下列有关说法正确的是( ) A.原硅酸钠(Na4SiO4)能迅速水解,且水解后呈碱性,故Na4SiO4为弱电解质 B.石英玻璃、普通玻璃、陶瓷及水泥均属于硅酸盐产品 C.2HCl+Na2SiO3===H2SiO3↓+2NaCl说明Cl的非金属性强于Si D.半导体工业所说的“从沙滩到用户”是指将二氧化硅制成晶体硅 题组二 复杂硅酸盐的成分及性质 4.和田玉在我国至少有7000年的历史,也称为软玉,是我国玉文化的主体。和田玉是一种具有链状结构的含水钙镁硅酸盐,某种和田玉的化学成分为Ca2Mg3Fe2(Si4O11)2(OH)2,下列有关叙述正确的是( ) A.其化学式改写为氧化物的形式为2CaO·3MgO·Fe2O3·8SiO2·H2O B.它能够抵抗任何酸碱的腐蚀 C.其中铁元素的化合价为+3 D.其中铁元素的化合价为+2 5.(2016·新疆伊犁质检)寿山石主要成分为叶蜡石,叶蜡石组成为Al2O3·4SiO2·H2O,下列观点不正确的是( ) A.寿山石雕刻作品要避免与酸、碱接触 B.寿山石颜色丰富多彩是因为含有不同形态的金属氧化物 C.潮湿的空气可能导致寿山石作品表面溶解变质 D.久置于干燥空气中可能会导致寿山石作品脱水变质 6.硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成黏性的硅 酸盐而无法打开,发生反应的化学方程式为__________________________________ ________________________________________________________________________。 长石是铝硅酸盐的,不同类长石其氧原子的物质的量分数相同。由钠长石的化学式NaAlSi3O8可推知钙长石的化学式为________________。 硅酸盐改写成氧化物形式的方法 (1)氧化物的书写顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水,不同氧化物间以“·”隔开。 (2)各元素的化合价保持不变,且满足化合价代数和为零,各元素原子个数比符合原来的组成。 (3)当计量数配置出现分数时应化为整数。如正长石:KAlSi3O8不能写成K2O·Al2O3·3SiO2,应写成K2O·Al2O3·6SiO2。 答案精析 考点一 基础知识梳理 1.(1)化合 晶体硅 无定形硅 (2)(从左到右,从上到下)空间网状 空间网状 软 高 石墨 半导体 2.4 ⅣA (1)①CO2+C2CO ②SiO2+2CSi+2CO↑ ③C+H2O(g)CO+H2 ④2CuO+C2Cu+CO2↑ SO2 NO2 CO2 (2)氢氟酸(HF) 强碱 硫酸 硝酸 ⑥Si+2Cl2SiCl4 ⑦Si+2F2===SiF4 ⑧Si+2NaOH+H2O===Na2SiO3+2H2↑ 3.(从左到右,从上到下)立体网状 高 SiO2+4HF===SiF4↑+2H2O SiO2+2NaOH===Na2SiO3+H2O 橡胶 CO2+2NaOH===Na2CO3+H2O CO2+NaOH===NaHCO3 SiO2+Na2CO3Na2SiO3+CO2↑ Na2SiO3+H2O+CO2(不足)===H2SiO3↓+Na2CO3 SiO2+CaOCaSiO3 Na2O+CO2===Na2CO3 深度思考 1.(1)× (2)√ (3)× (4)× (5)√ (6)× 2.没有,因为硅有很强的亲氧性,在地壳形成时硅与氧易结合,难分离,因而硅在自然界中主要以氧化物和硅酸盐的形式存在。 3.(1)通过盛有浓NaOH溶液的洗气瓶 (2)通过盛放灼热CuO的硬质玻璃管 (3)通过盛有饱和NaHCO3溶液的洗气瓶 4.(1)在固体混合物中加入足量氢氧化钠溶液,充分反应后,过滤、洗涤。SiO2+2NaOH===Na2SiO3+H2O (2)在固体混合物中加入足量稀盐酸,充分反应后,过滤、洗涤。CaCO3+2HCl===CaCl2+CO2↑+H2O (3)方法一:在固体中加入适量水溶解、过滤。 方法二:将固体混合物在坩埚中充分灼烧,除去NH4Cl。NH4ClNH3↑+HCl↑ 解析 (1)可根据SiO2可溶于NaOH溶液除去。(2)可根据CaCO3可溶于盐酸除去。(3)可根据NH4Cl的热稳定性,或NH4Cl易溶于水的性质除去。 解题探究 1.D 2.D 3.A 4.C 5.B [通常用氢氟酸来刻蚀玻璃,与之对应的反应是③,因此a、c判断错误;反应②是一个置换反应,其中二氧化硅被还原,表现出氧化性,b判断正确;反应④是一个复分解反应,用难挥发的二氧化硅制取易挥发的二氧化碳,d判断正确;反应⑤中碳的化合价由0价变为-4和+2价,硅的化合价和氧的化合价都没有改变,因此二氧化硅没有参加氧化还原反应,e判断也正确。] 6.D [在氧化还原反应中,还原剂的还原性比还原产物的还原性强,B正确;根据元素化合价的变化,每消耗或生成28 g(1 mol)硅,均转移4 mol电子,C正确;题中的三个反应是在三个不同反应器中发生,D错误。] 7.(1)①SiHCl3+H2Si+3HCl ②SiHCl3+3H2O===H2SiO3↓+H2↑+3HCl 高温下,H2遇O2发生爆炸 (2)①2Mg+SiO22MgO+Si、2Mg+SiMg2Si ②硅化镁与稀硫酸反应生成的SiH4可自燃,即发生反应Mg2Si+2H2SO4===2MgSO4+SiH4↑,SiH4+2O2===SiO2+2H2O 解析 (1)在SiHCl3中,把硅考虑为+4价,则氢为-1价,氯为-1价,SiHCl3水解时,-1价氢还原水中+1价的氢,生成氢气。 考点二 基础知识梳理 1.(1)不能 ①H2SiO3SiO2+H2O ②H2SiO3+2NaOH===Na2SiO3+2H2O (2)①水玻璃 ②Na2SiO3+2HCl===2NaCl+H2SiO3↓ Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3 2.②Na2SiO3+CO2↑ CaSiO3+CO2↑ 深度思考 1.(1)× (2)× (3)√ (4)√ (5)√ (6)× 2.不能;此反应中生成的CO2气体脱离反应体系有利于反应向右进行,与其氧化物对应酸的强弱无关;强酸制弱酸的规律一般适用于在溶液中发生的反应。 3.选择铁坩埚。依据:铁不与烧碱反应,而石英坩埚、陶瓷坩埚中都含有SiO2,能与NaOH反应使得坩埚受损。 解题探究 1.D 2.D 3.D 4.D [假设和田玉中铁元素的化合价为+x,根据化合物中各元素的化合价代数和为零,可得:(+2)×2+(+2)×3+(+x)×2+(+4)×8+(-2)×22+(-1)×2=0,即x=2,所以其化学式改写为氧化物的形式为2CaO·3MgO·2FeO·8SiO2·H2O;硅酸盐一般耐酸碱的腐蚀,但不是所有的酸碱都不能腐蚀它,如氢氟酸可以和其中的硅元素反应生成SiF4气体,浓硝酸可以将其中所含的Fe2+氧化成Fe3+。] 5.C 6.SiO2+2NaOH===Na2SiO3+H2O CaAl2Si2O8 解析 根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是0可写出钙长石的化学式。查看更多