- 2021-07-09 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习苏教版选修小专题突破17 物质结构与性质综合题难点突破学案(江苏专用)
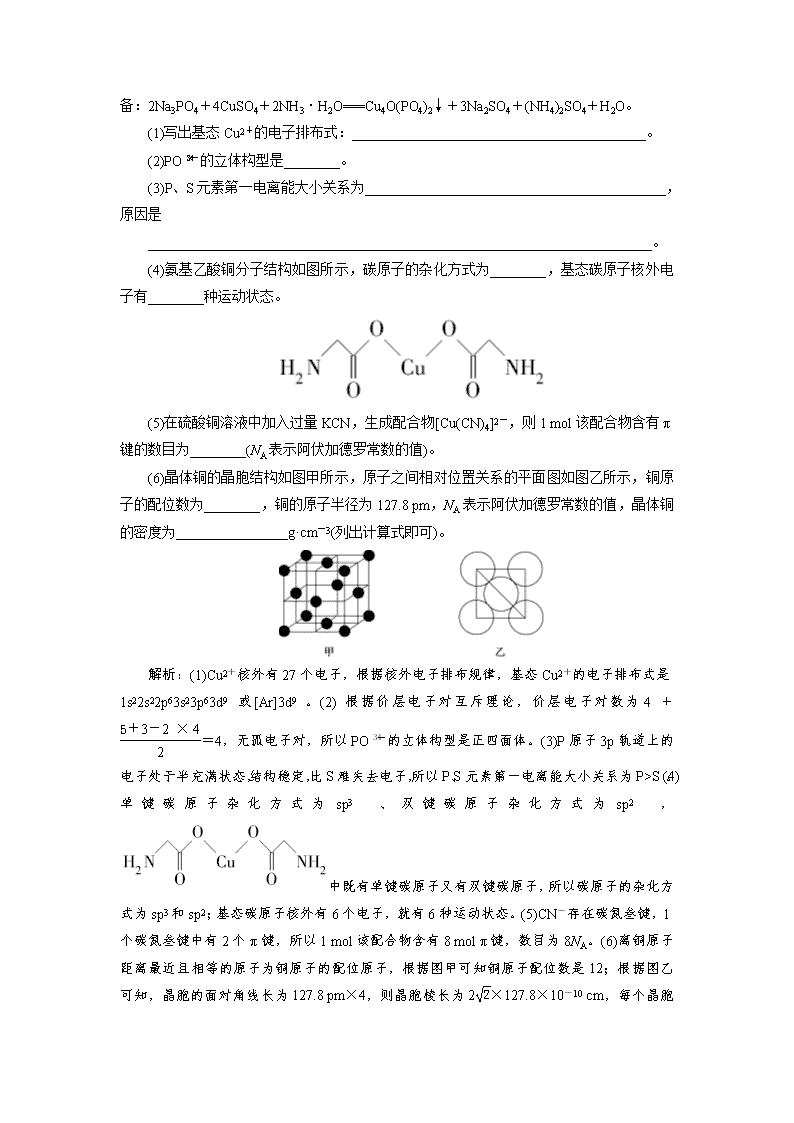
小专题突破17 物质结构与性质综合题难点突破 [专题精讲] 1.判断σ键和π键及其个数 共价单键全为σ键,双键中有一个σ键和一个π键,叁键中有一个σ键和两个π键。 2.判断中心原子的杂化轨道类型 (1)根据价层电子对数判断。 价层电子对数 杂化轨道类型 2 sp 3 sp2 4 sp3 (2)有机物中上的C原子都是sp2杂化,—C≡C—中的C原子是sp杂化,中的C原子是sp3杂化。 3.判断分子或离子的立体构型 (1)根据价层电子对互斥理论判断。 (2)有机物中CH2===CH2、为平面形结构,CH≡CH为直线形结构,HCHO为平面三角形结构。 4.晶体结构中的有关计算 (1)根据晶体晶胞的结构特点确定晶体的化学式。 晶胞中粒子数目的计算(均摊法): 详情请见第三单元学习任务2相关内容。 ①当晶胞为六棱柱时,其顶点上的粒子被6个晶胞共用,每个粒子属于该晶胞的部分为,而不是。 ②审题时一定要注意是“分子结构”还是“晶胞结构”,若是分子结构,其化学式由图中所有实际存在的原子个数决定,且原子个数可以不互质(即原子个数比可以不约简)。 (2)根据晶体晶胞的结构特点和有关数据,求算晶体的密度或晶体晶胞的体积或晶胞参数a(晶胞边长)。 对于立方晶胞,可建立如下求算途径: 得关系式:ρ=(ρ表示密度,a表示晶胞边长,NA表示阿伏加德罗常数的数值,n表示1 mol晶胞所含基本粒子或特定组合的物质的量,M表示摩尔质量)。 [专题精练] 1.(2020·福州质检)锌是人体必需的微量元素,明朝《天工开物》中有世界上最早的关于炼锌技术的记载。回答下列问题: (1)基态Zn原子的价电子排布式为____________________________________, 在周期表中的位置为________。 (2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。 ①组成[Zn(NH3)4]SO4的元素中,除H外其余元素的第一电离能由大到小顺序为________________________________________________________________________。 ②在[Zn(NH3)4]SO4溶液中滴加NaOH溶液,未出现浑浊,其原因是________________________________________________________________________。 ③已知[Zn(NH3)4]2+的立体构型与SO相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________。 ④以下作用力在[Zn(NH3)4]SO4晶体中存在的有________。 A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.范德华力 F.金属键 (3)ZnS晶胞结构如图(已知a为硫离子,b为锌离子)所示,ZnS晶体的熔点约为1 700 ℃。 ①已知晶体密度为ρ g·cm-3,NA为阿伏加德罗常数的值。则1个ZnS晶胞的体积为________cm3。 ②ZnO与ZnS结构相似,熔点为1 975 ℃,其熔点较高的原因是________________________________________________________________________ ________________________________________________________________________。 答案:(1)3d104s2 第4周期ⅡB族 (2)①N>O>S>Zn ②[Zn(NH3)4]2+难电离出Zn2+,溶液中Zn2+浓度很小,无法产生沉淀 ③sp3 ④ABD (3)① ②O2-的半径比S2-的小,ZnO离子键的键能较大 2.(2020·试题调研)锂磷酸氧铜电池正极的活性物质是Cu4O(PO4)2, 可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。 (1)写出基态Cu2+的电子排布式:__________________________________________。 (2)PO的立体构型是________。 (3)P、S元素第一电离能大小关系为___________________________________________,原因是 ________________________________________________________________________。 (4)氨基乙酸铜分子结构如图所示,碳原子的杂化方式为________,基态碳原子核外电子有________种运动状态。 (5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol该配合物含有π键的数目为________(NA表示阿伏加德罗常数的值)。 (6)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为________,铜的原子半径为127.8 pm,NA表示阿伏加德罗常数的值,晶体铜的密度为________________g·cm-3(列出计算式即可)。 解析:(1)Cu2+核外有27个电子,根据核外电子排布规律,基态Cu2+的电子排布式是1s22s22p63s23p63d9或[Ar]3d9。(2)根据价层电子对互斥理论,价层电子对数为4+=4,无孤电子对,所以PO的立体构型是正四面体。(3)P原子3p轨道上的电子处于半充满状态,结构稳定,比S难失去电子,所以P、S元素第一电离能大小关系为P>S。(4)单键碳原子杂化方式为sp3、双键碳原子杂化方式为sp2,中既有单键碳原子又有双键碳原子,所以碳原子的杂化方式为sp3和sp2;基态碳原子核外有6个电子,就有6种运动状态。(5)CN-存在碳氮叁键,1个碳氮叁键中有2个π键,所以1 mol该配合物含有8 mol π键,数目为8NA。(6)离铜原子距离最近且相等的原子为铜原子的配位原子,根据图甲可知铜原子配位数是12;根据图乙可知,晶胞的面对角线长为127.8 pm×4,则晶胞棱长为2×127.8×10-10 cm, 每个晶胞含有铜原子数为8×+6×=4。1个晶胞的体积为(2×127.8×10-10)3 cm3,质量为 g,所以密度为 g·cm-3。 答案:(1)1s22s22p63s23p63d9(或[Ar]3d9) (2)正四面体 (3)P>S P原子3p轨道上的电子处于半充满状态,结构稳定,失去电子比S难 (4)sp3和sp2 6 (5)8NA (6)12 3.(2020·试题调研)乙烯酮是最简单的烯酮,其结构简式为CH2===C===O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备:2HC≡CH+O22CH2===C===O。 (1)基态钙原子的核外电子排布式为____________________________________。 (2)乙炔分子的立体构型为________,乙炔分子属于________(填“极性”或“非极性”)分子。 (3)乙烯酮分子中的碳原子的杂化类型为________;乙烯酮在一定条件下可聚合成双乙烯酮(结构简式为),双乙烯酮分子中含有的σ键和π键的数目之比为________。 (4)乙酸分子间也可形成二聚体(含八元环),该二聚体的结构为________。 (5)Ag的一种氧化物的晶胞结构如图所示,晶胞中所含的氧原子数为________。 解析:(1)钙为元素周期表20号元素,位于第4周期ⅡA族,故其核外电子排布式为1s22s22p63s23p64s2。(2)乙炔分子含—C≡C—,故为直线形结构,该结构决定了其为对称结构,是非极性分子。(3)乙烯酮结构简式为CH2===C===O,其中含碳碳双键和碳氧双键,与氢原子相连的碳原子为sp2杂化,羰基碳原子为sp杂化。中含3个碳氧σ键、3个碳碳σ键、4个碳氢σ键,还有2个π键,故双乙烯酮分子中含有的σ键和π键的数目之比为10∶2,即5∶1。(4)乙酸分子间能形成氢键,2个乙酸分子中的羟基氢原子分别与对方的羰基氧原子形成氢键,构成八元环结构,故二聚体结构为 。(5)由晶胞结构可知,该Ag的氧化物晶胞结构中,氧原子位于四种位置:①顶点,共8个,属于该晶胞的氧原子数为8×=1;②棱心,共4个,属于该晶胞的氧原子数为4×=1;③面心,共2个,属于该晶胞的氧原子数为2×=1;④晶胞内,共1个,故该Ag的氧化物晶胞中所含的氧原子数为4。 答案:(1)1s22s22p63s23p64s2 (2)直线形 非极性 (3)sp2、sp 5∶1 (4) (5)4查看更多