- 2021-07-09 发布 |
- 37.5 KB |
- 7页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版定性实验设计与评价作业
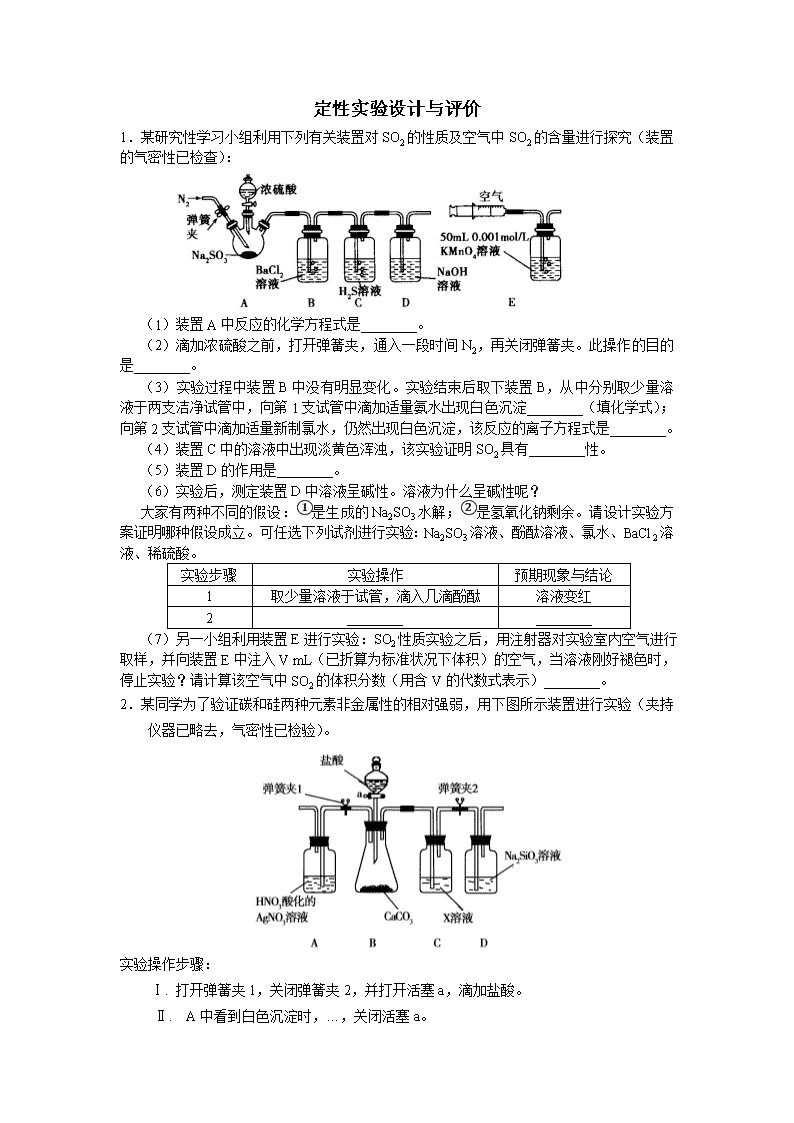
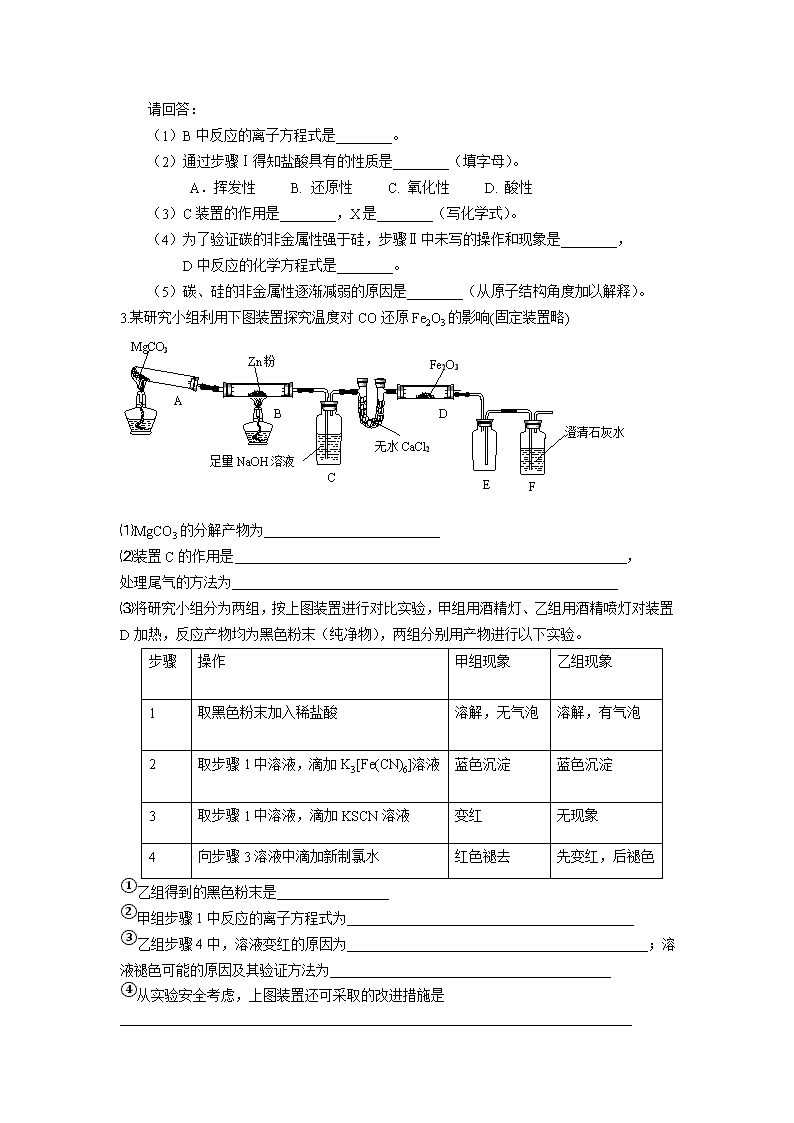
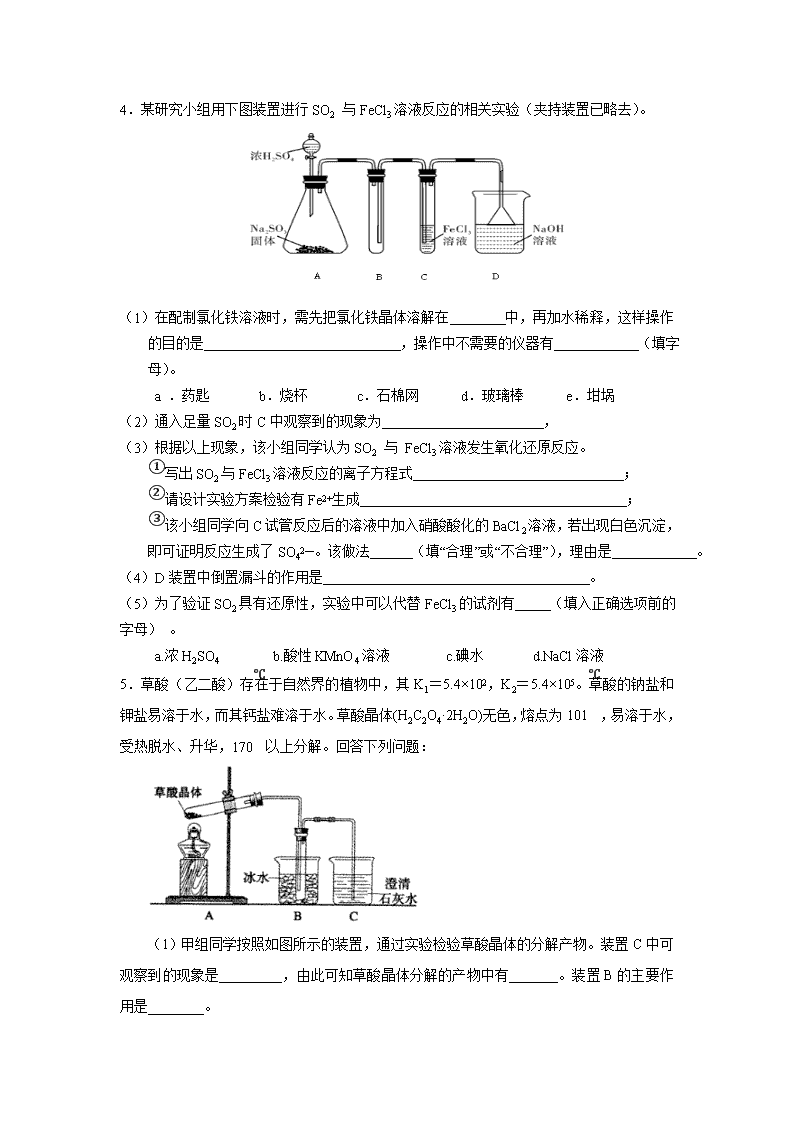
定性实验设计与评价 1.某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查): (1)装置A中反应的化学方程式是________。 (2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹。此操作的目的是________。 (3)实验过程中装置B中没有明显变化。实验结束后取下装置B,从中分别取少量溶液于两支洁净试管中,向第1支试管中滴加适量氨水出现白色沉淀________(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是________。 (4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有________性。 (5)装置D的作用是________。 (6)实验后,测定装置D中溶液呈碱性。溶液为什么呈碱性呢? 大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种假设成立。可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸。 实验步骤 实验操作 预期现象与结论 1 取少量溶液于试管,滴入几滴酚酞 溶液变红 2 ________ ________ (7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样,并向装置E中注入V mL(已折算为标准状况下体积)的空气,当溶液刚好褪色时,停止实验?请计算该空气中SO2的体积分数(用含V的代数式表示)________。 2.某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。 实验操作步骤: Ⅰ. 打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。 Ⅱ. A中看到白色沉淀时,…,关闭活塞a。 请回答: (1)B中反应的离子方程式是________。 (2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。 A.挥发性 B. 还原性 C. 氧化性 D. 酸性 (3)C装置的作用是________,X是________(写化学式)。 (4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________, D中反应的化学方程式是________。 (5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。 3.某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略) MgCO3 Zn粉 Fe2O3 无水CaCl2 澄清石灰水 足量NaOH溶液 A B C D E F ⑴MgCO3的分解产物为 ⑵装置C的作用是 , 处理尾气的方法为 ⑶将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。 步骤 操作 甲组现象 乙组现象 1 取黑色粉末加入稀盐酸 溶解,无气泡 溶解,有气泡 2 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 蓝色沉淀 蓝色沉淀 3 取步骤1中溶液,滴加KSCN溶液 变红 无现象 4 向步骤3溶液中滴加新制氯水 红色褪去 先变红,后褪色 ①乙组得到的黑色粉末是 ②甲组步骤1中反应的离子方程式为 ③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为 ④从实验安全考虑,上图装置还可采取的改进措施是 4.某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。 (1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 ,操作中不需要的仪器有 (填字母)。 a .药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚 (2)通入足量SO2时C中观察到的现象为 , (3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。 ①写出SO2与FeCl3溶液反应的离子方程式 ; ②请设计实验方案检验有Fe2+生成 ; ③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法 (填“合理”或“不合理”),理由是 。 (4)D装置中倒置漏斗的作用是 。 (5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有 (填入正确选项前的字母) 。 a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液 5.草酸(乙二酸)存在于自然界的植物中,其K1=5.4×102,K2=5.4×105。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题: (1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_________,由此可知草酸晶体分解的产物中有_______。装置B的主要作用是________。 (2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。 ①乙组同学的实验装置中,依次连接的合理顺序为A、B、______。装置H反应管中盛有的物质是_______。 ②能证明草酸晶体分解产物中有CO的现象是_______。 (3)(4分)设计实验证明: ①草酸的酸性比碳酸的强______。 ②草酸为二元酸______。 6.某兴趣小组用下图装置探究氨的催化氧化. (1)氨催化氧化的化学方程式为___________________. (2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”). (3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________. (4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________。 【答案与解析】 1. (1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O (2)排除装置中氧气对实验的干扰 (3)BaSO3 Ba2++SO2+Cl2+2H2O==BaSO4↓+4H++2Cl (4)氧化 (5)吸收SO2尾气,防止污染空气 (6) 实验步骤 实验操作 预期现象与结论 2 然后加入足量的BaCl2溶液 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 (7)2.8/V 【解析】(2)由于在水溶液中O2易把SO2及H2S氧化,因此,制备SO2之前先通一段时间N2把装置中的空气赶走,防止空气中的O2对实验产生干扰。 (3)SO2与BaCl2不反应,当加入氨水后,发生下列反应: SO2+2NH3•H2O ==(NH4)2SO3+H2O,(NH4)2SO3+BaCl2==BaSO4↓+2NH4Cl,产生白色沉淀;若加入新制氯水,则发生反应:SO2+Cl2+2H2O==H2SO4+2HCl,H2SO4+BaCl2==BaSO4↓+2HCl,也产生白色沉淀。 (4)SO2与H2S溶液发生反应SO2+2H2S==3S↓+2H2O而产生淡黄色浑浊,反应中SO2表现了氧化性。 (5)SO2是有毒气体,在装置的最后应用NaOH溶液进行尾气吸收。 (6)Na2SO3水解或氢氧化钠剩余都能使溶液呈碱性,但Na2SO3的水解是一个可逆反应,可通过使Na2SO3的水解平衡左移减小其溶液的碱性来达到验证的目的,如加入BaCl2溶液等。 (7)据5SO2~2KMnO4,n (SO2)=2.5n (KMnO4)=1.25×10-4 mol,V (SO2)=2.8×10-3 L=2.8 mL,φ (SO2)=2.8/V。 2.(1) CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O (2) A D (3)除HCl气体 、 NaHCO3 (4)关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后 Na2SiO3 + CO2 + H2O = H2SiO3(胶体)+ Na2CO3 (5)碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱。 3.⑴MgO、CO2 ⑵除CO2、点燃 ⑶①Fe ②Fe3O4+8H+=2Fe3++Fe2++4H2O ③Fe2+被氧化成Fe3+,Fe3+遇SCN-显红色;假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立(其它合理答案均可给分) (4)装置BC之间添加装置E防倒吸(其它合理答案均可给分) 4.(1)浓盐酸、抑制氯化铁水解、c、e (2)溶液由棕黄色变为浅绿色 (3)①2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+ ②取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红(2分) ③不合理硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验 (4)使气体充分吸收;防止溶液倒吸 (5)b、c 5. (1)有气泡逸出,澄清石灰水变浑浊;CO2;冷凝(水蒸气、草酸等),避免草酸进入装置C反应生成沉淀,干扰CO2的检验。 (2)①F、D、G、H、D、I; CuO(氧化铜); ②H中的粉末有黑色变为红色,其后的D中的石灰水变浑浊; (3)①向盛有少量NaHCO3溶液的试管中滴加草酸溶液,有气泡产生。 ②用氢氧化钠标准溶液滴定草酸溶液,消耗氢氧化钠的物质的量是草酸的两倍。 【解析】本题是以草酸为题材来考查学生的实验基本知识,难度中偏易。首先通读这道题,合理猜测H2C2O4·2H2O的分解产物为CO2、CO、H2O三种,然后用氧化还原反应的有关知识(化合价升降)来验证。 (1)问考常规,澄清石灰水变浑浊,说明有CO2产生,考虑到还有CO,我觉得有必要强调一下“气泡”;装置B的主要作用是冷凝分解产物中的水,同时草酸也可能升华,所以该装置还有一个作用就是除去草酸蒸气,避免其进入装置C中。 (2)问考查物质性质和实验原理的综合应用能力。由装置A、B出来的气体含有CO2、CO,容易想到用灼热氧化铜来氧化CO,进而检验其产物CO2,但要注意到原产物中有CO2,故要设计除去CO2和验证CO2除尽的环节。最终确认连接顺序F(除CO2)、D(验证CO2被除尽)、G(干燥)、H(氧化CO)、D(通过验证CO2来证明CO的存在)、I(尾气处理);H中要装CuO(氧化铜)。 (3)问考查实验设计能力,利用强酸制取弱酸的原理,向盛有少量NaHCO3溶液的试管中滴加草酸溶液,若有气泡产生,则证明“草酸的酸性比碳酸强”。 证明“草酸是二元酸”这个难一点,考虑到题中给出了Ka值,所以还可以设计了一个NaHC2O4溶液呈酸性的实验,也可以直接取NaHC2O4溶液测其pH,呈酸性则说明草酸是二元酸。若用中和滴定当然是更准确的方法了。 6.(1)4NH3+5O24NO+6H2O (2)放热 (3)浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3 反应生成了NH4NO3 (4)1 , NH4Cl,与HCl反应生成氧气(合理答案均给分) 【解析】本题考查氨的催化氧化。(1)和氧化生成。(2)该反应为放热,故不加热后仍能保持红热状态。(3)产物中有NO和NH3,NO会被氧化生成,在于空气中的水蒸气反应生成HNO3,而HNO3与NH3会产生白烟。(4)装置5与1均产生NH3。NH4Cl加热分解可得NH3和HCl,而HCl与可生成。查看更多