- 2021-07-09 发布 |
- 37.5 KB |
- 22页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习学案课件(人教版):第2章 化学物质及其变化第1节 物质的分类
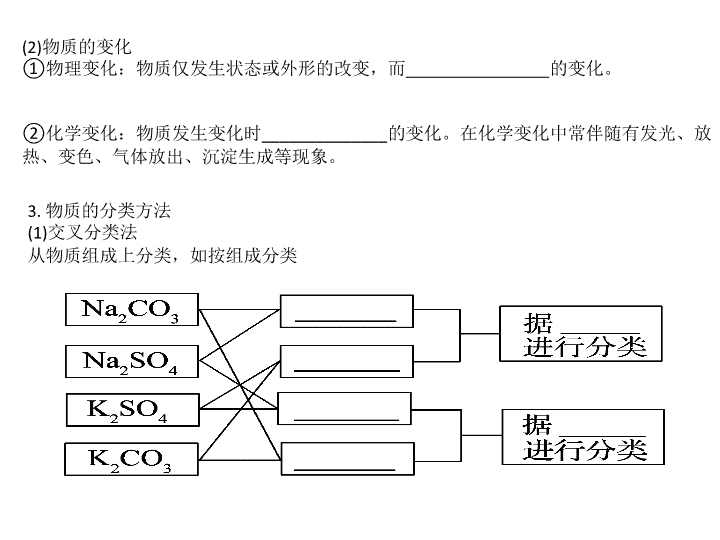
第一节 物质的分类 一、物质的组成、性质与变化及分类 1. 物质的组成 (1)宏观组成:宏观上物质由________组成。 (2)微观构成:微观上物质由__________________等基本粒子构成。 分子是保持物质________性质的一种微粒,________是化学变化中的最小微粒。 2. 物质的性质与变化 (1)物质的性质 ①物理性质:物质不需要经过________直接表现出来的性质。如:颜色、状态、气味、 熔点、沸点、密度、硬度等。 ②化学性质:物质______________时表现出来的性质。如:酸性、碱性、氧化性、还 原性、可燃性、稳定性等。 (2)物质的变化 ①物理变化:物质仅发生状态或外形的改变,而________________的变化。 ②化学变化:物质发生变化时______________的变化。在化学变化中常伴随有发光、放 热、变色、气体放出、沉淀生成等现象。 3. 物质的分类方法 (1)交叉分类法 从物质组成上分类,如按组成分类 (2)树状分类法 对同类事物进行再分类,如对化学反应的分类: 二、分散系、胶体 1. 分散系及其分类 2. 胶体的性质 (1)丁达尔效应 当一束光通过胶体时,胶体内会出现一条__________,这是由胶体粒子对光线______ 而形成的,利用丁达尔效应可区分胶体和溶液。 (2)介稳性 胶体的稳定性介于______和______之间,在一定条件下能稳定存在,属于介稳体系, 其原因是: ①胶体粒子的电性相同,相互排斥(主要原因); ②胶体粒子的布朗运动(次要原因)。 3. Fe(OH)3胶体的制备 (1)将烧杯中的蒸馏水(约25 mL)加热至______; (2)向沸水中逐滴加入1~2 mL________溶液; (3)继续煮沸至溶液呈________,停止加热,即制得Fe(OH)3胶体。离子方程式为 Fe3++3H2O△ Fe(OH)3(胶体)+3H+。 一、1. (1)元素 (2)分子、原子、离子 化学 原子 2. (1)①化学反应 ②在发生化学反应 (2)①没有生成新物质 ②生成其他物质 答案: 3.(1)钠盐 钾盐 阳离子不同 硫酸盐 碳酸盐 阴离子不同 (2)化合反应 分解反应 置换反应 复分解反应 是否有离子参与或生成 是否有电 子转移 可逆反应 不可逆反应 放热反应 吸热反应 二、1.一种(或多种)物质 另一种(或多种)物质 被分散 容纳分散质 分散质粒子的大 小不同 2. (1)光亮的通路 散射 (2)溶液 浊液 3. (1)沸腾 (2)饱和FeCl3 (3)红褐色 答案: 【想一想】 Fe(OH)3胶体的制备能否持续加热?若不能,其原因是什么? 不能,持续加热会引起胶体的聚沉。 答案: 物质的分类及常见无机物的转化关系 【例1】 某合作学习小组讨论辨析以下说法: ①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物 又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸; ⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。 上述说法正确的是( ) A. ①②③④ B. ①②⑤⑥ C. ③⑤⑥⑦ D. ①③④⑦ 【自主解答】 解析:解答此类题目首先要明确所给物质的组成、结构和性质,然后利用常见的分类 方法对其进行分类。①粗盐和酸雨均由多种成分组成,均属混合物,正确;②沼气属于可 再生资源,水煤气由炽热的煤与水蒸气反应制得,而煤为不可再生资源,所以水煤气为不 可再生资源,错误;③冰为固态水,干冰为固态CO2,均为纯净物和化合物,正确;④不 锈钢和硬币均是由金属与金属(或非金属)熔合而成的,属于合金,正确;⑤盐酸和食醋均 为溶液属于混合物,错误;⑥纯碱(Na2CO3)属于盐类,而不是碱,错误;⑦豆浆和雾都能 发生丁达尔效应,均属于胶体,正确。 答案: D 1. 物质的组成 2. 氧化物的分类及各类之间的关系 1. (2010·海南海口模拟)分类是学习和研究化学的一种常用的科学方法,下列分类正确 的是( ) ①根据一个酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等 ②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 ③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质 ④根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 ⑤根据反应的热效应将化学反应分为放热反应和吸热反应 A. ①②③ B. ①②⑤ C. ①②④ D. ③④⑤ 答案: B 解析:根据酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等,而不能根据酸中 所含氢原子的个数,因为不是酸中所有氢原子都能电离,①正确;区别强弱电解质的依据 是在水溶液中是否完全电离,③错误;区别金属元素、非金属元素的主要依据是元素的物 理性质、化学性质,④错误。 【例2】 FeCl3溶液和Fe(OH)3胶体共同具备的性质是( ) ①两者均有丁达尔现象,②分散质微粒都可通过滤纸,③加入盐酸均先沉淀,随后溶 解,④用石墨电极做导电性实验时,分散质微粒都定向且朝一个方向移动,⑤都比较 稳定 A. ①② B. ②⑤ C. ③④ D. ③⑤ 【自主解答】 解析:胶体具有丁达尔效应而溶液不具有; FeCl3溶液加盐酸无沉淀;用石墨电极作 导电性实验时,Fe(OH)3胶体粒子向阴极移动发生电泳现象,而FeCl3溶液中的Fe3+、Cl- 分别向两极移动;胶体和溶液都是比较稳定的分散系;Fe(OH)3胶体和FeCl3溶液的分散质 微粒均可通过滤纸。 答案: B 1. 溶液、胶体与浊液三类分散系的比较 分散系 溶液 胶体 浊液 悬浊液 乳浊液 分散质粒子的 大小 <1 nm 1~100 nm >100nm 分散质粒子的 构成 分子、离子 少量分子的结 合体或大分子 大量分子聚集成的固体小颗粒或 小液滴 特点 均一、透明的 稳定体系 多数均一、透 明、较稳定, 介稳体系 不均一、不透明、不稳定,静置 分层或颗粒沉降 能否透过滤纸 能 能 悬浊液不能 实例 食盐水、碘酒 Fe(OH)3胶体、 淀粉胶体 泥水、油水混合物 2. 胶体的性质、制备、提纯和应用 内容 主要应用举例 性质 丁达尔效应 一束光通过胶体时 产生一条“光路” 鉴别胶体和溶液 布朗运动 胶粒在胶体中不停 地做无规则运动 电泳 胶粒在外加电场作 用下做定向移动[胶 粒带电:如Fe(OH)3 胶粒带正电, H2SiO3胶粒带负电] 工厂除尘 聚沉 聚沉方法有:加热、 加入电解质、加入 相反电荷的胶体 加工豆腐、工业制 肥皂,解释某些自 然现象,如土壤保 肥、沙洲的形成 制备 水解法 Fe3++ 3H2O△Fe(OH)3(胶 体)+3H+ 净水剂的使用 (不加 热) 【温馨提示】①胶粒带电荷,且同种胶体的胶粒带相同的电荷,但胶体都是电中性 的。②胶体与溶液的本质区别是分散质粒子大小,外观特征区别是有无丁达尔效应。 2. 下列现象与胶体的性质无关的是( ) A. 将盐卤或石膏加入豆浆制成豆腐 B. 一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 D. 清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象 解析:A为胶体的聚沉;B中墨水属于胶体,不同型号的墨水所带电荷往往不同,故易聚 沉为沉淀而堵塞钢笔;C为FeCl3溶液与NaOH溶液反应生成氢氧化铁沉淀,非胶体性质;D 中胶体发生的是丁达尔效应。 答案: C 1. (2011·福建师大附中高三期中)分类是化学研究中常用的方 法。下列分类方法中,正确的是( ) A. 依据组成元素的种类,将纯净物分为单质和化合物 B. 根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物 C. 根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液 D. 根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等 2. 非金属氧化物采用不同的分类方法可分为不同的类别,从某种意义将N2O5、SO3、 CO2、Cl2O7等归为一类。则下列氧化物与他们属于同一类的是( ) A. CO B. NO2 C. NO D. SO2 答案: 1. A 2. D 3. (2010·广东佛山模拟)生物学家借助新的显微技术,成功观察到小于200 nm 的粒子。 下列分散系中粒子半径最小的是( ) A. 雾 B. 蛋白质溶液 C. 石灰乳 D. KNO3溶液 4. 下列关于溶液和胶体的叙述,正确的是( ) A. 溶液是电中性的,胶体是带电的 B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 C. 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者没有 答案: 3. D 解析:溶液粒子半径最小。 4. D 解析:胶体中胶体粒子可能带电,但胶体仍为电中性,A错;对于某些溶液如蔗 糖溶液,其溶质粒子不带电荷,B错;布朗运动是所有分散系中分散质粒子都具有的规律, C错。 5. 分类方法在化学学科的发展中起了非常重要的作用。下图是某反应在密闭容器中反 应前后的分子状况示意图,“●”和“○”分别表示不同的原子。对此反应的分类不 正确的是( ) A. 化合反应 B. 氧化还原反应 C. 可逆反应 D. 置换反应 答案: D查看更多