- 2021-07-09 发布 |
- 37.5 KB |
- 78页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学高考一轮复习课件:第3章 第4讲 铁及其化合物
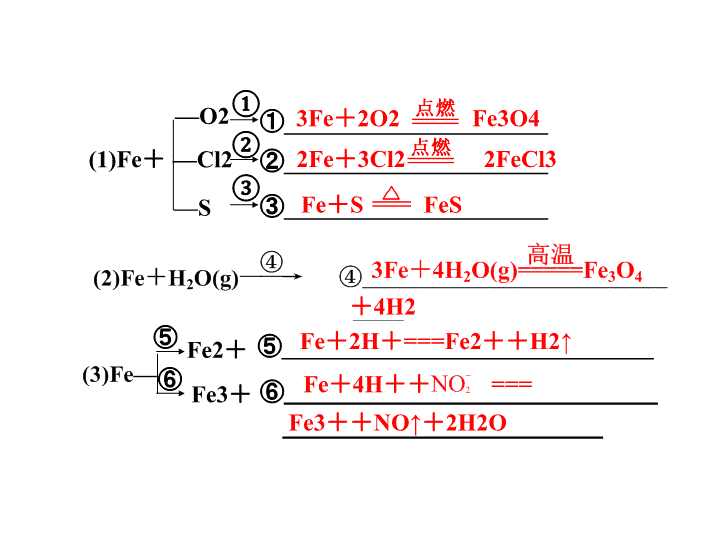
第三章 常见的金属及其化合物 ①______________________ ②______________________ ③______________________ (1)Fe+ —O2 —Cl2 —S 3Fe+2O2 Fe3O4 2Fe+3Cl2 2FeCl3 Fe+S FeS ① ② ③ +4H2 Fe+4H++ === Fe2+ Fe3+ ⑤ ⑥ ⑤_______________________________Fe+2H+===Fe2++H2↑ ⑥____________________________ ________________________Fe3++NO↑+2H2O NO2 提示 由于铁是变价金属元素,它与氧化 性不同的氧化剂反应时,其产物中铁元素 的化合价不同: (1)Fe被弱氧化剂如S、I2、H+、Fe3+、 Cu2+等氧化为Fe2+; (2)Fe被强氧化剂如Cl2、Br2、HNO3、 浓H2SO4(△)等氧化为Fe3+。 名称(俗名) 氧化亚铁 氧化铁( ) 四氧化三铁(______ _________) 化学式 FeO Fe2O3 Fe3O4 铁的化合价 +2 +3 +2( )、+3( ) 颜色 _____ _________ _______ 铁红 磁性 氧化铁 黑色 红棕色 黑色 3 1 2 3 溶解性 ____溶于水,但 酸溶液 与H+ 反应 _________________ _________________ ______________ _____________ _____________ _____________ _____________ ______ 与CO 反应 ____________________ ___________________ _______________ _______________ ________________ ________________ 空气中的 稳定性 ,空气中 加热,生成Fe3O4 ______ _____ 生成 方法 2Fe(过量)+O2 2FeO(炼钢炉) 2Fe(OH)3 Fe2O3+3H2O 3Fe+2O2 Fe3O4 都不 溶于 FeO+2H+=== Fe2++H2O Fe2O3+6H+ ===2Fe3+ +3H2O Fe3O4+8H+=== Fe2++2Fe3++ 4H2O FeO+CO Fe+CO2 Fe2O3+3CO 2Fe+3CO2 Fe3O4+4CO 3Fe+4CO2 不稳定 稳定 稳定 Fe(OH)3 Fe(OH)2 Fe2+ Fe3+ ① ② ③ ④ ⑤ ⑥ ⑦ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe(OH)2+2H+===Fe2++2H2O Fe2++2OH-===Fe(OH)2↓ Fe(OH)3+3H+===Fe3++3H2O Fe3++3OH-===Fe(OH)3↓ 2Fe2++Cl2===2Fe3++2Cl- 2Fe3++Cu===Cu2++2Fe2+ ① 、 ⑥、 ⑦ 相 互转化 氧化 还原 O2氧化生成Fe(OH)3 碱 酸 制备方法 水解 酸 KSCN 溶液显红色 白色 红褐色 浅绿色 棕黄色 提示 用洁净的试管取少量(1~2mL) 的样品溶液,向其中滴入KSCN溶液 (或NH4SCN溶液)1~2滴,若溶液立即 显红色证明该溶液已被氧化变质。 提示 NaOH不能证明,因为OH-与Fe2+ 反应生成的Fe(OH)2能够迅速被氧化为 Fe(OH)3,不易观察现象。苯酚溶液能证明, 因为Fe3+与苯酚发生显色反应。 提示 ①用KSCN溶液或苯酚溶液 ②用NaOH或其它碱溶液 ③用AgNO3溶液 ④用铜片 ⑤用苯或CCl4 提示 不能,因为二者均与Fe反应 生成Fe2+。 答案 C 溶液不呈红色 溶液呈红色 Fe2+ Fe3+ Fe2+ 白色沉淀迅速变为灰绿色, 最后变为红褐色 Fe3+ 产生红褐色沉淀 无明显现象 铜片被腐蚀,溶液变为蓝色 Fe2+ Fe3+ 试纸不变蓝 试纸变蓝 Fe2+ Fe3+ KMnO4溶液紫色褪去 KMnO4溶液不褪色 Fe2+ Fe3+ 溴水褪色 溴水不褪色 Fe2+ Fe3+ 答案 C 提示 (1)用FeSO4·7H2O制备,先在烧杯中加入 少量稀硫酸然后加入适量的FeSO4·7H2O晶体, 然后加水溶解。 (2)用稀H2SO4与Fe反应制备。 提示 酸要过量,以防止Fe2+水解, 在溶液中加入铁钉以防止Fe2+被氧 化。 提示 由于Fe3+水解能力较强,当 pH>4时,Fe3+即可形成Fe(OH)3沉淀。 在配制FeCl3溶液时,应先将固体盐溶于 少量相应的酸中抑制Fe3+水解,再加水 稀释至所需浓度。在制FeCl3固体时,加 热浓缩FeCl3稀溶液时应在HCl氛围中进 行。 Ⅱ 资料名称 物理性质描述 化学性质描述 《化学辞典》, 顾翼东编, 1989年版P637 白色无定形粉末 或白色至淡绿色 六方晶体 与空气接触易被氧 化,将细粉喷于空气 中,则立即燃烧出火 花 《大学普通化学 (下册)》傅鹰著 P637 白色沉淀 此沉淀易被氧化成微 绿色Fe3(OH)8 《普通化学教 程》(下册)P788 白色 能强烈吸收O2,迅速 变成棕色Fe(OH)3,这 时作为氧化的中间产 物为土绿色,其中含 有Fe2+、Fe3+ √ √ × √ × 解析 应发生氧化还原反应生成Fe3+。 答案 D 答案 D D ③ 看是否褪色 D E C B 收集气体 吸收尾气 H2SO4 过滤 把pH试纸伸到溶液Z中 低 溶查看更多