- 2021-07-09 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习鲁科版 基态原子的核外电子排布学案
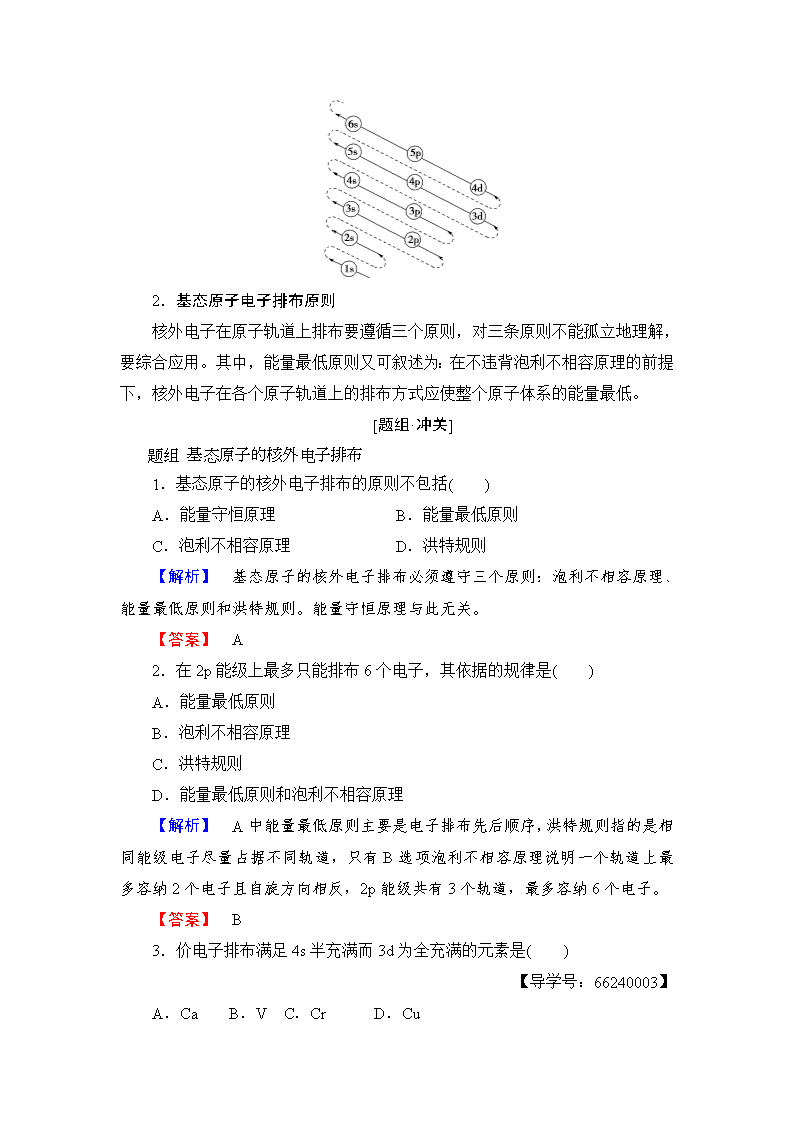
第2节 原子结构与元素周期表 第1课时 基态原子的核外电子排布 1.了解基态原子的核外电子在原子轨道上的排布顺序。 2.掌握基态原子的核外电子排布规律,会书写常见元素(1~36号)原子的核外电子排布。(重点) 3.学会利用电子排布式、轨道表示式正确表示核外电子排布。(难点) 基 态 原 子 的 核 外 电 子 排 布 原 则 [基础·初探] 1.能量最低原则 (1)基态原子的核外电子排布使整个原子体系的能量最低。 (2)基态原子的核外电子在原子轨道上的排列顺序: 1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s…… 2.泡利不相容原理 (1)一个原子轨道最多只能容纳两个电子,并且这两个电子的自旋方向必须相反;或者说,一个原子中不存在两个完全相同的电子。 (2)在原子中,每个电子层最多能容纳2n2个电子。 3.洪特规则 (1)对于基态原子,电子在能量相同的轨道上排布时,应尽可能分占不同轨道并且自旋方向相同。 (2)能量相同的原子轨道在全充满(如d10)、半充满(如d5)和全空(如d0)状态时,体系的能量较低,原子较稳定。如基态铬原子的核外电子排布式为1s22s22p63s23p63d54s1,基态铜原子的核外电子排布式为1s22s22p63s23p63d104s1。 4.电子数与电子层和能级的关系 在原子中,每个电子层最多容纳2n2个电子, 每个能级最多能容纳的电子数为其所包含的原子轨道数的2倍。 (1)原子轨道能量的相对大小为:E4s>E3d>E3p>E3s。(×) (2)基态O原子电子排布式为:1s22s22p4。(√) (3)Al原子核外有1个未成对电子。(√) (4)2p能级上有2个未成对电子的元素只有碳。(×) (5)基态铜原子:①1s22s22p63s23p63d94s2(×) ②1s22s22p63s23p63d104s1(√) [合作·探究] 原子核外电子排布规律 [探究背景] 根据基态原子核外电子排布原则可知每一层上的电子排布有一定的数值或数值范围。 [探究问题] 1.为什么每个电子层最多容纳2n2个电子? 【提示】 各电子层上的能级数目=电子层序数n,根据泡利不相容原理,每个原子轨道最多只能容纳2个电子,所以每个电子层最多容纳2n2个电子。 2.为什么原子核外最外层的电子不超过8个?次外层不超过18个电子? 【提示】 由于E(nd)>E[(n+1)s],当ns和np轨道电子排满时,多余的电子不是填入nd轨道,而是首先填入(n+1)s轨道,因此最外层电子数不可能超过2+6=8。同理次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。 [核心·突破] 1.多电子的基态原子核外电子排布遵循的排布顺序可表示为 2.基态原子电子排布原则 核外电子在原子轨道上排布要遵循三个原则,对三条原则不能孤立地理解,要综合应用。其中,能量最低原则又可叙述为:在不违背泡利不相容原理的前提下,核外电子在各个原子轨道上的排布方式应使整个原子体系的能量最低。 [题组·冲关] 1.基态原子的核外电子排布的原则不包括( ) A.能量守恒原理 B.能量最低原则 C.泡利不相容原理 D.洪特规则 【解析】 基态原子的核外电子排布必须遵守三个原则:泡利不相容原理、能量最低原则和洪特规则。能量守恒原理与此无关。 【答案】 A 2.在2p能级上最多只能排布6个电子,其依据的规律是( ) A.能量最低原则 B.泡利不相容原理 C.洪特规则 D.能量最低原则和泡利不相容原理 【解析】 A中能量最低原则主要是电子排布先后顺序,洪特规则指的是相同能级电子尽量占据不同轨道,只有B选项泡利不相容原理说明一个轨道上最多容纳2个电子且自旋方向相反,2p能级共有3个轨道,最多容纳6个电子。 【答案】 B 3.价电子排布满足4s半充满而3d为全充满的元素是( ) 【导学号:66240003】 A.Ca B.V C.Cr D.Cu 【解析】 由题意可知其价电子排布为3d104s1为Cu。 【答案】 D 4.下列原子或离子的电子排布式(或轨道表示式)正确的是________,违反能量最低原理的是________,违反洪特规则的是________,违反泡利原理的是________。 ①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6 ③P: ④Cr:1s22s22p63s23p63d44s2 ⑤Fe:1s22s22p63s23p63d64s2 ⑥Mg2+:1s22s22p6 ⑦C:。 【解析】 根据核外电子排布规律,②中错误在于电子排完2s轨道后应排2p轨道而不是3p轨道,正确的应为1s22s22p6;③中没有遵循洪特规则——电子在能量相同的轨道上排布时,应尽可能分占不同的轨道并且自旋方向相同,正确的应为:;④中忽略了能量相同的原子轨道在半充满状态时,体系的能量较低,原子较稳定,正确的应为: 【答案】 ①⑤⑥ ② ③④ ⑦ 【温馨提示】 在写基态原子的轨道表示式时,防止出现以下几种错误: ① (违反泡利不相容原理) ②(违反洪特规则) ③ (违反洪特规则) 基 态 原 子 中 核 外 电 子 排 布 的 表 示 方 法 [基础·初探] 1.电子排布式 按照能量最低原则对能级进行排序,进而在ns、np、nd等能级符号的右上角用数字表示出电子的数目。 如基态氧原子的电子排布式可表示为1s22s22p4。 2.轨道表示式 一般用小圆圈(或方框、短线)表示一个原子轨道。用“↑”或“↓”来区别自旋状态不同的电子。如基态氧原子的轨道表示式可表示为 。 3.价电子 (1)与化学性质密切相关的外层原子轨道上的电子,称为价电子。 (2)为了便于研究元素化学性质与核外电子间的关系,人们常常只表示出原子的价电子排布。如基态铁原子的价电子排布式为3d64s2。 (1)基态铁原子失去4s、3d轨道上各1个电子变为Fe2+。(×) (2)24Cr的电子排布式:1s22s22p63s23p63d54s1。(√) (3)K的价电子排布式:4s1。(√) (4)氮原子的轨道表示式:。(√) (5)原子的价电子决定了其物理性质和化学性质。(×) (6)基态N原子电子排布式为:[He] 。(×) [合作·探究] 价电子及价电子排布 [探究背景] 原子的价电子影响元素的化学性质,主族元素和过渡元素价电子排布各不相同。 [探究问题] 1.价电子就是最外层电子吗? 【提示】 不一定。价电子是指决定元素化学性质的电子。主族元素的最外层电子是价电子,但过渡元素的次外层甚至倒数第三层电子也是价电子。 2.铁原子的价电子排布式为3d64s2,铁原子可以失去2或3个电子形成离子Fe2+和Fe3+,且离子稳定性大小顺序是Fe3+>Fe2+。 [核心·突破] 核外电子排布的表示方法 原子结构示意图 意义 将每个电子层上的电子总数表示在原子核外的式子 实例 电子排布式 意义 用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式 实例 K:1s22s22p63s23p64s1 简化电子排布式 意义 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示 实例 K:[Ar]4s1 价电子排布式 意义 主族元素的价电子指最外层电子,价电子排布式即外围电子排布式 实例 Al:3s23p1 轨道表示式 意义 每个圆圈(或方框)代表一个原子轨道,每个箭头代表一个电子 实例 [题组·冲关] 题组 基态原子中核外电子排布的表示方法 1.下列轨道表示式能表示氮原子的最低能量状态的是( ) 【解析】 基态原子的电子在能量相同的轨道上分布时,将尽可能分占不同的轨道并且自旋方向相同。 【答案】 A 2.下列关于价电子构型为3s23p4的粒子描述正确的是( ) A.它的元素符号为O B.它的核外电子排布式为1s22s22p63s23p4 C.它可与H2生成液态化合物 D.其轨道表示式为 【解析】 A项,据价电子构型可知该粒子的电子排布式为1s22s22p63s23p4,故该元素为硫元素;C项,S与H2化合生成气态氢化物H2S;D项,S原子核外电子轨道表示式应为 【答案】 B 3.下列原子中,单电子数最多的是( ) A.16S B.35Br C.24Cr D.15P 【解析】 写出各项原子的价电子轨道表示式进行判断。 【答案】 C 4.按要求填空: (1)Cu的原子结构示意图为____________________________________。 (2)P的价电子排布式为____________________________________。 (3)Fe的电子排布式为____________________________________。 (4)N的轨道表示式为____________________________________。 (5)X元素的价电子排布式是4s24p5,X元素的符号是________。 【解析】 Cu的电子排布式是1s22s22p63s23p63d104s1,所以其原子结构示意图是;P的价电子排布式为3s23p3;Fe的电子排布式为1s22s22p63s23p63d64s2;N的电子排布式为1s22s22p3,所以其轨道表示式是。X元素出现了4p能级,说明3d能级已经排满,其电子排布式为1s22s22p63s23p63d104s24p5,原子序数是35,为溴元素。 【答案】 (1) (2)3s23p3 (3)1s22s22p63s23p63d64s2 (4) (5)Br 学业分层测评(二) 基态原子的核外电子排布 (建议用时:45分钟) [学业达标] 1.下列原子中未成对电子(单独占据1个原子轨道的电子)数为2的是( ) A.O B.N C.Cu D.F 【解析】 氧原子的电子排布式为1s22s22p4,所以2p轨道上有两个单电子分别占据两个不同的2p轨道。 【答案】 A 2.R元素的原子,其最外层的p能级电子数等于所有的电子层s能级电子总数,则R是( ) A.Li B.Be C.S D.Ar 【解析】 若只有1个电子层,则不存在p能级,若有2个电子层,则有两个s能级,则电子排布式为1s22s22p4,为氧元素,若有3个电子层,则有三个s能级,则电子排布式为1s22s22p63s23p6,则可以看出应选D。 【答案】 D 3.下列微粒的核外电子的表示方法中正确的是( ) A.碳原子的轨道表示式: B.磷原子价电子轨道表示式: C.铬原子的价电子排布式:3d44s1 D.Fe2+的电子排布式:1s22s22p63s23p63d64s2 【解析】 A表示碳原子的轨道表示式,正确;B不符合洪特规则;正确的铬原子的价电子排布式为3d54s1;Fe2+是铁原子失去最外层2个电子形成的,其电子排布式是1s22s22p63s23p63d6。 【答案】 A 4.(双选)下列价电子排布表示正确的是( ) A.Cu:3d94s2 B.Ca:3d2 C.Na:3s1 D. Fe:3d64s2 【解析】 A项中违反洪特规则特例,应为3d104s1;B项中违反能量最低原则,应为4s2。 【答案】 CD 5.下列各原子或离子的电子排布式错误的是( ) A.K+:1s22s22p63s23p6 B.As:1s22s22p63s23p63d104s24p3 C.N3-:1s22s22p6 D.Cr:1s22s22p63s23p63d44s2 【解析】 根据洪特规则,能量相同的原子轨道在全充满、半充满、全空状态时原子较稳定,故Cr原子电子排布式应为1s22s22p63s23p63d54s1。 【答案】 D 6.电子在一个原子的下列能级的原子轨道中排布时,最后排布的是( ) A.ns B.np C.(n-1)d D.(n-2)f 【解析】 按照能级顺序,电子在原子轨道上排布顺序为ns(n-2)f(n-1)dnp,即最后排布在np轨道。 【答案】 B 7.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( ) A.+1 B.+2 C.+3 D.-1 【解析】 据题意可知该元素原子价电子排布为3s23p1,由元素最高正化合价=价电子数可知该元素为+3价。 【答案】 C 8.(2016·衡水期中测试)下列微粒中,电子排布式为1s22s22p63s23p6的是( ) A.Na+ B.Mg2+ C.Cl- D.Br- 【解析】 该微粒的核外电子数为18,Cl-符合。 【答案】 C 9.(2016·开原一中月考)下面是某些原子的最外层电子排布式,各组指定的元素不能形成AB2(A为正价,B为负价)型化合物的是( ) A.2s22p2和2s22p4 B.3s23p4和2s22p4 C.3s2和2s22p5 D.3s1和3s23p4 【解析】 A项为C和O,能形成CO2;B项为S和O,能形成SO2;C项为Mg和F,能形成MgF2;D项为Na和S,形成Na2S,属A2B型。 【答案】 D 10.某元素的激发态原子的电子排布式为1s22s22p63s23p14s1, 则该元素基态原子的电子排布式为________;元素符号为________;其最高价氧化物对应的水化物的酸性比碳酸________(增“强”或“弱”)。 【解析】 由该元素的激发态原子的电子排布式可知其基态原子的电子排布式为:1s22s22p63s23p2,故为14号元素Si,其最高价氧化物对应的水化物H4SiO4的酸性比碳酸弱。 【答案】 1s22s22p63s23p2 Si 弱 11.A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题: (1)A为______________(写出元素符号,下同),电子排布式是________; (2)B为________,简化电子排布式是_______________________; (3)C为________,价电子排布式是______________________________; (4)D为________,轨道表示式是________________________________; (5)E为________,原子结构示意图是_____________________________。 【解析】 由题意可知,A为Si,B为Na,C为P,则D为N,E为Fe。 【答案】 (1)Si 1s22s22p63s23p2 (2)Na [Ne]3s1 (3)P 3s23p3 (4)N (5)Fe 12.已知X、Y两种元素的原子序数之和等于41。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。请回答下列问题。 (1)X元素原子基态时的电子排布式为________,该元素的符号是____; 【导学号:66240004】 (2)Y元素原子的价层电子的轨道表示式为__________________________ __________,该元素的名称是________。 【解析】 (1)因为X原子4p轨道上有3个未成对电子,可知其电子排布式为:1s22s22p63s23p63d104s24p3,并推出其元素符号为As。 (2)根据Y元素的最外层2p轨道上有2个未成对电子,又因为X、Y的原子序数和为41,故Y的原子序数为41-33=8,为氧, 故价层电子的轨道表示式为: ,元素名称为氧。 【答案】 (1)1s22s22p63s23p63d104s24p3 As (2) 氧 [能力提升] 13.下列各组表述中,两个微粒一定不属于同种元素原子的是( ) A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子 B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子 C.最外层电子数是核外电子总数的的原子和价电子排布为4s24p5的原子 D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子 【解析】 A项,3p能级有一个空轨道,说明3p上填2个电子,因填1个电子有2个空轨道,填3个电子或3个以上电子无空轨道,则3p上有2个电子,3s上肯定已填满,价电子排布为3s23p2,因此A中两微粒相同。B项,M层全充满而N层为4s2,M层上有d轨道,即:3s23p63d10,应该是锌元素,3d64s2是铁元素,B选项符合题意。C中价电子排布为4s24p5,则3d上已排满10个电子,核外电子排布式为1s22s22p63s23p63d104s24p5,最外层电子数是核外电子总数的原子,可按下述方法讨论:若最外层电子数为1,核外电子总数为5不可能,最外层电子数为2,核外电子总数为10不可能,同理,可讨论,只有最外层电子数为7,核外电子总数为35时合理,其电子排布式也是1s22s22p63s23p63d104s24p5,二者是同种元素的原子。D中2p能级有一个未成对电子,可以是2p1,也可以是2p5,因此二者不一定属于同种元素的原子,D选项不符合题意。 【答案】 B 14.(2016·资阳高二检测)下列有关原子结构或元素性质说法正确的是( ) A.原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似,B.基态碳原子的价电子轨道表示式: C.基态铜原子的价电子轨道表示式: D.Fe3+的最外层电子排布式为3s23p63d5 【解析】 原子核外电子排布式为1s2的元素是He,原子核外电子排布式为1s22s2的元素是Be,二者化学性质不相似,A错;根据能量最低原则,基态碳原子的价电子排布式为2s22p2,B错;根据洪特规则,原子轨道全满,半满,全空时体系能量最低,原子最稳定,因此基态铜原子的价电子排布式为3d104s1,C错;Fe的基态原子核外电子排布为[Ar]3d64s2,失去3个电子后,最外层即M层的电子排布式为3s23p63d5,D正确。 【答案】 D 15.某元素原子的3p原子轨道中有2个未成对电子,则下列叙述中一定正确的是( ) A.M层上有4个电子 B.最高正价为+2 C.最高正价为+4 D.L层上没有未成对电子 【解析】 3p轨道上有两个未成对电子,则该原子的价电子轨道式可表示为:,即S元素。它们的L层上均已填满。 【答案】 D 16.(2016·郑州高二检测)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,其中C、E是金属元素;A和E属同一族,且A为非金属元素,它们原子的最外层电子排布为ns1,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题: 【导学号:66240005】 (1)A是________,B是________,E是________(写元素符号)。 (2)写出C元素基态原子的电子排布式_____________________________ _____________________________________________________________。 (3)用轨道表示式表示D元素原子的价电子排布____________________ _____________________________________________________________。 【解析】 (1)A为非金属元素,且原子最外层电子排布为ns1,只能是H。B、D的价电子排布为ns2np4,前20号元素中B、D只能分别为O、S。由核电荷数及其为金属元素可知E为K。C最外层有3个电子,为Al。 (2)C为Al,电子排布式为1s22s22p63s23p1。 (3)D为S,价电子排布为3s23p4,用轨道表示式表示为 【答案】(1)H O K (2) 1s22s22p63s23p1 (3) 查看更多