2019届一轮复习人教版弱电解质的电离平衡学案(1)
第八章 水溶液中的离子平衡
第1讲 弱电解质的电离平衡
考纲要求
1.理解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离以及电解质溶液的导电性。
3.理解弱电解质在水溶液中的电离平衡。
考点一 弱电解质的电离平衡
1.强、弱电解质
(1)定义与物质类别
(2)电离方程式的书写——“强等号,弱可逆,多元弱酸分步离”
①强电解质:如H2SO4:H2SO4===2H++SO。
②弱电解质:
a.一元弱酸,如CH3COOH:CH3COOHCH3COO-+H+。
b.多元弱酸,分步电离,分步书写且第一步电离程度远远大于第二步的电离程度,如H2CO3:H2CO3H++HCO、HCO??H++CO。
c.多元弱碱,分步电离,一步书写。如Fe(OH)3:
Fe(OH)3Fe3++3OH-。
③酸式盐:
a.强酸的酸式盐
如NaHSO4在水溶液中:NaHSO4===Na++H++SO;熔融时:NaHSO4===Na++HSO。
b.弱酸的酸式盐:“强中有弱”,如NaHCO3:NaHCO3===Na++HCO、HCOH++CO。
2.弱电解质的电离平衡
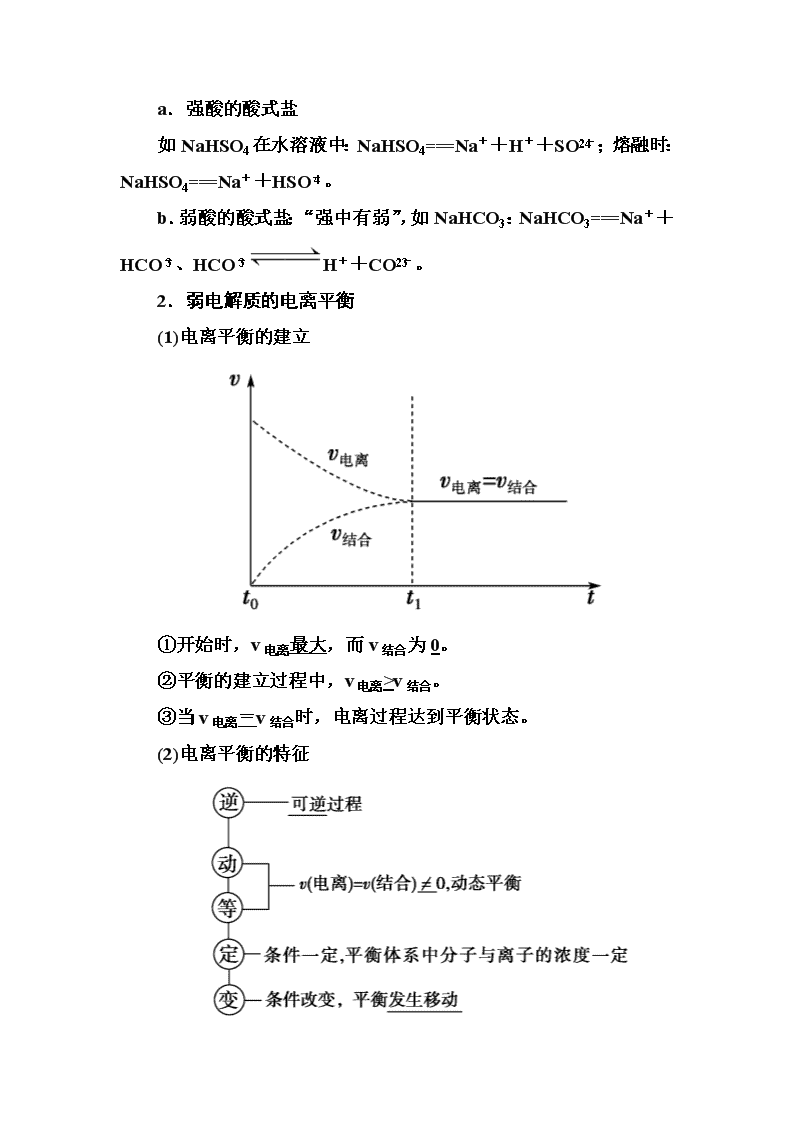
(1)电离平衡的建立
①开始时,v电离最大,而v结合为0。
②平衡的建立过程中,v电离>v结合。
③当v电离=v结合时,电离过程达到平衡状态。
(2)电离平衡的特征
(3)外界条件对电离平衡的影响
①温度:温度升高,电离平衡正向移动,电离程度增大。
②浓度:稀释溶液,电离平衡正向移动,电离程度增大。
③同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡逆向移动,电离程度减小。
④实例展示
实例(稀溶液)
CH3COOHH++CH3COO- ΔH>0
改变条件
平衡移动方向
n(H+)
c(H+)
导电能力
Ka
加水稀释
→
增大
减小
减弱
不变
加入少量冰醋酸
→
增大
增大
增强
不变
通入HCl(g)
←
增大
增大
增强
不变
加NaOH(s)
→
减小
减小
增强
不变
加入镁粉
→
减小
减小
增强
不变
升高温度
→
增大
增大
增强
增大
加CH3COONa(s)
←
减小
减小
增强
不变
【多维思考】
稀释一弱电解质溶液时,所有粒子浓度都会减小吗?
提示:不是所有粒子浓度都会减小。对于弱酸或弱碱溶液,只要对其稀释,电离平衡均会发生右移,例如HA溶液稀释时,c(HA)、c(H+)、c(A-)均减小(参与平衡建立的微粒);平衡右移的目的是减弱c(H+)、c(A-)的减小,但c(OH-)会增大。
【感悟测评】
一定温度下,
冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
(1)O点为什么不导电:________________________________。
(2)a、b、c三点溶液的pH由小到大的顺序是_______________。
(3)H+的物质的量最大的是________(填“a”“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填字母序号)。
A.加热 B.加很稀的NaOH溶液
C.加NaOH固体 D.加水
E.加CH3COONa固体 F.加入锌粒
答案:(1)冰醋酸中无自由移动的离子 (2)b
1(室温下);
②将pH=2的HA溶液稀释100倍,稀释后27(室温下)
(3)溶液的导电 性
0.1 mol·L-1的HCl和HA溶液,前者的导电能力明显更强
(4)与金属反应的速率
相同浓度的HCl和HA溶液,与相同(形状、颗粒大小)的锌粒或碳酸盐反应,前者的反应速率快;相同pH的HCl和HA溶液,与相同(形状、颗粒大小)的锌粒或碳酸盐溶液反应,后者的反应速率快。
(5)其钠盐能与弱酸反应生成HA
CO2通入NaA溶液中有HA生成:CO2+NaA+H2O===HA+NaHCO3或CO2+2NaA+H2O===2HA+Na2CO3
HA是一元弱酸,是弱电解质。其项还能证中(5)、(6) 明HA的:酸性比H2CO3弱
(6)不与碳酸氢钠溶液反应
HA溶液不与NaHCO3溶液反应
(7)中和能力
分别取等体积等pH的酸HA溶液和盐酸进行中和滴定,达到终点时酸HA比盐酸消耗的同浓度的NaOH溶液体积大
考向 弱电解质的电离平衡
1.25 ℃时,把0.2 mol·L-1的醋酸加
水稀释,则图中的纵轴y表示的是( )
A.溶液中OH-的物质的量浓度
B.溶液的导电能力
C.溶液中
D.CH3COOH的电离程度
答案:B
2.稀氨水中存在着下列平衡:NH3·H2OVNH+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是 ( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥
C.③ D.③⑤
答案:C
3.H2S水溶液中存在电离平衡H2SH++HS-和HS-?? H++S2-。若向H2S溶液中 ( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜晶体(忽略体积变化),溶液中所有离子浓度都减小
解析:加水促进H2S的电离,由于溶液体积增大,氢离子浓度减小,A错误;B项反应:2H2S+SO2===3S↓+2H2O,当SO2过量,溶液显酸性,因H2SO3酸性比H2S强,故pH减小,错误;滴加新制氯水,发生反应Cl2+H2S===2HCl+S↓,平衡向左移动,生成了强酸,溶液pH减小,C项正确;加入少量硫酸铜固体,发生反应H2S+Cu2+===CuS↓++2H+,H+浓度增大,D项错误。
答案:C
4.关于常温下,pH=2的醋酸溶液,下列叙述正确的是 ( )
A.c(CH3COOH)=0.01 mol/L
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,pH=4
D.加入醋酸铵固体,可抑制醋酸的电离
解析:pH=2的醋酸溶液中,c(H+)=0.01 mol/L,醋酸是弱酸,部分发生电离,故c(CH3COOH)大于0.01 mol/L,A错误;醋酸电离产生的c(H+)=c(CH3COO-),但在溶液中水也可以电离产生H+,故c(H+)>c(CH3COO-),B错误;加水稀释后醋酸的电离程度增大,故加水稀释100倍后,溶液的pH<4,C错误;加入醋酸钠固体后,c(CH3COO-)增大,醋酸的电离平衡逆向移动,D正确。
答案:D
【速记卡片】 勒夏特列原理适用于电离平衡
应该深刻地理解勒夏特列原理——平衡向“削弱”这种改变的方向移动,移动结果不能“抵消”或“超越”这种改变。
考点二 电离平衡常数
1.表达式
(1)对于一元弱酸HA
HAH++A-,平衡常数K=;
(2)对于一元弱碱BOH
BOHB++OH-,平衡常数K=。
2.意义
相同条件下,K值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
3.特点
(1)多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第一步电离。
4.意义
―→―→
【多维思考】
在Na2CO3中加醋酸产生CO2气体,试从电离平衡常数的角度解释原因。
提示:K(CH3COOH)=1.7×10-5;K(H2CO3)=4.4×10-7。醋酸的电离平衡常数大,酸性强,较强的酸可制备较弱的酸。
【感悟测评】
判断正误(正确的打“√”,错误的打“×”)
(1)电离平衡常数(K)越小,表示弱电解质电离能力越弱。( )
(2)不同浓度的同一弱电解质,其电离平衡常数(K)不同。( )
(3)电离平衡右移,电离平衡常数一定增大。( )
(4)温度不变,向NH3·H2O溶液中加入NH4Cl,平衡左移,电离平衡常数减小。( )
(5)电离平衡常数大的酸溶液中的c(H+)一定比电离平衡常数小的酸溶液中的c(H+)大。( )
(6)H2CO3的电离平衡常数表达式:Ka=。( )
答案:(1)√ (2)× (3)× (4)× (5)× (6)×
有关电离平衡常数的计算
以弱酸HX为例:
(1)已知c(HX)和c(H+),求电离平衡常数
HX H+ + X-
起始: c(HX) 0 0
平衡:c(HX)-c(H+) c(H+) c(H+)
则:K==
由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则K=,代入数值求解即可。
(2)已知c(HX)和电离平衡常数,求c(H+)
HX H+ + X-
起始: c(HX) 0 0
平衡: c(HX)-c(H+) c(H+) c(H+)
则:K==
由于K值很小,c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则:c(H+)=,代入数值求解即可。
考向一 有关电离平衡常数的定性分析
1.25 ℃时,部分物质的电离平衡常数如表所示;
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.7×10-5
K1=4.3×10-7 K2=5.6×10-11
3.0×10-8
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
____________________________________________________。
(2)同浓度的CH3COO-、HCO、CO、ClO-结合H+的能力由强到弱的顺序为______________________________________。
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式_____________________________________________________。
(4)物质的量浓度均为0.1 mol·L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是________(填字母)。
(5)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”“变小”或“不变”)
①____________________;
②______________________;
③__________________;
④____________________。
答案:(1)CH3COOH>H2CO3>HClO
(2)CO>ClO->HCO>CH3COO-
(3)ClO-+CO2+H2O===HClO+HCO
(4)a>b>d>c
(5)①变小 ②不变 ③变大 ④不变
考向二 有关电离平衡常数的定量计算
2.已知室温时,0.1 mol·L-1某一元酸HA在水中有1.0%电离,此酸的电离平衡常数为________。
解析: HA H++ A-
0.1-x x x
x=0.1×1.0%=10-3(mol·L-1)
Ka===10-5。
答案:10-5
3.在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-),则溶液显__________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=__________。
解析:氨水与盐酸等体积混合后的溶液中的电荷守恒关系为c(NH)+c(H+)=c(Cl-)+c(OH-),因c(NH)=c(Cl-),故有c(H+)=
c(OH-),溶液显中性。Kb=c(NH)·c(OH-)/c(NH3·H2O)=(0.005 mol·L-1×10-7 mol·L-1)/(a/2 mol·L-1-0.005 mol·L-1)=10-9/(a-0.01) mol·L-1。
答案:中 mol·L-1
4.常温下,将a mol·L-1 CH3COONa溶于水配成溶液,向其中滴加等体积的b mol·L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=________。
答案:
考点三 强酸(碱)与弱酸(碱)的比较
浓度均为0.01 mol·L-1的盐酸与醋酸
pH均为2的盐酸与醋酸
pH或物质的
量浓度
pH(HCl)=2< pH(CH3COOH)
c(HCl)=0.01 mol·L-1醋酸
盐酸=醋酸
体积相同时与过量的碱反应时消耗碱的量
盐酸=醋酸
盐酸<醋酸
体积相同时与过量活泼金属反应产生H2的量
盐酸=醋酸
盐酸<醋酸
c(Cl-)与c(CH3COO-)大小
c(Cl-)>c(CH3COO-)
c(Cl-)=c(CH3COO-)
分别加入固体NaCl、CH3COONa后pH变化
盐酸不变;醋酸变大
盐酸不变;醋酸变大
加水稀释10倍后
pH(HCl)=3pH(CH3COOH)>2
溶液的导电性
盐酸>醋酸
盐酸=醋酸
【感悟测评】
1.体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01 mol,下列叙述错误的是( )
A.与NaOH完全中和时,醋酸所消耗的NaOH多
B.分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的pH相等
D.分别用水稀释相同倍数时,n(Cl-)”“<”或“=”)。
(2)加水稀释10倍后,两溶液的pH各是多少?
(3)若稀释后两溶液的pH仍然相等,则加水量有何关系?
答案:(1)<
(2)NaOH溶液:pH=11;氨水:12>pH>11
(3)加水量:NaOH溶液小于氨水
设计实验证明电解质为弱电解质的两个角度(以CH3COOH为例)
(1)若有与CH3COOH比较的强电解质(如HCl),应从与已知强电解质比较的角度设计,如配制与已知强电解质等物质的量浓度溶液比较导电性或在相同条件与锌、碳酸氢钠反应比较反应速率等。
(2)若没有与CH3COOH比较的强电解质,应从CH3COOH自身性质的角度设计,如证明醋酸溶液中c(CH3COOH)≠c(H+)、存在电离平衡CH3COOHCH3COO-+H+以及CH3COONa溶液的pH>7等。
考向一 强酸(碱)与弱酸(碱)的比较
1.pH=2的两种一元酸X和Y的溶液,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为VX、VY,则 ( )
A.X为弱酸,VXVY
C.Y为弱酸,VXVY
解析:分析图象可知,X、Y两种酸的溶液稀释10倍,X的pH
增大1,则X为强酸,Y的pH增大的范围小于1,则Y为弱酸,c(Y)>c(X),体积相同的pH=2的X、Y两种酸的溶液被NaOH溶液滴定至pH=7,则Y消耗的NaOH溶液多。
答案:C
2.现有室温下四种溶液,有关叙述不正确的是( )
序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1 L④与V2 L①混合,若混合后溶液pH=7,则V1c(OH-),该项正确;C项,加水后②溶液的pH=10,①溶液的pH介于10和11之间,④溶液的pH=4,③溶液的pH介于3和4之间,该项正确;D项,两溶液等体积混合反应后,溶液显碱性,若溶液呈中性,④溶液需要稍过量,故V1>V2,该项错误。
答案:D
【速记卡片】 搭建思维平台法比较酸(碱)的强弱
我们在做有关强酸与弱酸、强碱与弱碱比较的试题时,不妨用假设法给自己搭建一个平台,用这个平台进行分析。如第1题,分别加水稀释10倍,假设无平衡移动,则X、Y溶液的pH均为3
,对照图象知X为强酸,然后再根据平衡移动可分析出Y为弱酸。
考向二 强、弱电解质的图象分析
3.(2018·山东临沂模拟)向体积均为1 L、pH=2的盐酸和醋酸溶液中分别投入0.2 g Ca,则下图中比较符合反应事实的曲线是( )
解析:醋酸是弱酸,向1 L pH均等于2的醋酸和盐酸中投入0.2 g Ca时,盐酸恰好完全反应,但是醋酸过量,所以B图象符合。
答案:B
4.浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg =2时,若两溶液同时升高温度,则增大
解析:A.根据图象可知,0.1 mol·L-1 MOH溶液的pH=13,说明MOH完全电离,为强电解质,而ROH溶液的pH<13,说明ROH为弱电解质,所以MOH的碱性强于ROH的碱性,正确;B.ROH为弱碱,溶液越稀越易电离,所以ROH的电离程度:b点大于a点,正确;C.两溶液无限稀释下去,则相当于纯水,所以它的氢氧根离子浓度相等,正确;D.当lg=2时,MOH溶液的pH=11,ROH溶液的pH=10,MOH溶液中不存在电离平衡;而ROH溶液中存在电离平衡,升高温度,电离正向移动,则c(R+)浓度增大,而升高温度,对c(M+)无影响,所以比值减小,错误。
答案:D
考向三 判断弱酸(碱)的方法
5.为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:0.1 mol·L-1醋酸溶液、0.1 mol·L-1盐酸、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、CH3COONH4晶体、蒸馏水、锌粒、pH试纸、酚酞、NaOH溶液等。
(1)甲取出10 mL 0.1 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是______________,理由是__________________________。
(2)乙分别取pH=3的醋酸和盐酸各1 mL,分别用蒸馏水稀释到100 mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是_________________________________
_____________________________。
(3)丙分别取pH=3的盐酸和醋酸各10 mL,然后加入质量相同的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗? __________,请说明理由:____________________
____________________________________________________。
(4)丁用CH3COONa晶体、NaCl晶体、蒸馏水和酚酞做实验,也论证了醋酸是弱酸的事实,该同学的实验操作和现象是________________________________________________________。
答案: (1)a>1 因醋酸是弱酸,不能完全电离
(2)盐酸的pH=5,醋酸的pH<5
(3)正确 由于醋酸是弱酸,随着反应的进行,醋酸不断电离,c(H+)变化小,产生H2的速率醋酸比盐酸快
(4)将CH3COONa晶体、NaCl晶体分别溶于适量水配成溶液,再分别滴入酚酞溶液,CH3COONa溶液变浅红色,NaCl溶液不变色
【速记卡片】 判断弱电解质的三个思维角度
角度一:弱电解质的定义,即弱电解质不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
角度二:弱电解质溶液中存在电离平衡,条件改变,平衡移动,如pH=1的CH3COOH加水稀释10倍后,17。
1.判断正误(正确的打“√”,错误的打“×”)
(1)(2017·高考江苏卷,14B)用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 ( )
(2)(2016·高考全国卷Ⅲ,13A)向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中减小( )
(3)(2016·高考上海卷,6)能证明乙酸是弱酸的实验事实是0.1 mol/L CH3COONa溶液的pH大于7( )
(4)(2016·高考江苏卷,7D)室温下,稀释0.1 mol·L-1CH3COOH溶液,溶液的导电能力增强( )
(5)(2015·高考重庆卷,3A)稀醋酸中加入少量醋酸钠能增大醋酸的电离程度( )
(6)(2015·高考重庆卷,3C)25 ℃时,0.1 mol·L-1
的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱( )
(7)(2015·高考江苏卷,11B)室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7( )
(8)(高考山东卷)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中:A.水的电离程度始终增大( ),
B.先增大再减小( )
答案:(1)× (2)× (3)√ (4)× (5)× (6)√ (7)× (8)× ×
2.填空(高考组合)
(1)(2017·高考全国卷Ⅱ,12改编)二元弱酸H2A在溶液中的电离:____________________________________ (写出电离方程式)。
(2)(2016·高考全国卷Ⅱ,26(4))联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为__________(已知:N2H4+H+N2H的K=8.7×107;Kw=1.0×10-14)。
(3)(2016·高考海南卷,14(4))已知:Kw=1.0×10-14,Al(OH)3AlO+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于________。
(4)(2015·高考海南卷,16(1))氨的水溶液显弱碱性,其原因为______________________(用离子方程式表示);0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量明矾,溶液中NH的浓度________(填“增大”或“减小”)。
答案:(1)H2AHA-+H+,HA-A2-+H+
(2)8.7×10-7
(3)20
(4)NH3·H2ONH+OH- 降低 增大
3.(2017·高考全国卷Ⅱ)改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=。
下列叙述错误的是( )
A.pH=1.2时, c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时, c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时, c(HA-)=c(A2-)=c(H+)
解析:A.根据图象,pH=1.2时,H2A和HA-相交,则有c(H2A)=c(HA-),正确;B.根据pH=4.2点,K2(H2A)=c(H+)·c(A2-)/c(HA-)=c(H+)=10-4.2,正确;C.根据图象,pH=2.7时,H2A和A2-相交,则有c(H2A)=c(A2-),正确;D.根据pH=4.2时,c(HA-)=c(A2-),且物质的量分数约为0.48,而c(H+)=10-4.2,可知c(HA-)=c(A2-)>c(H+),错误。
答案:D
4.(2016·高考上海卷)能证明乙酸是弱酸的实验事实是( )
A.CH3COOH溶液与Zn反应放出H2
B.0.1 mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
解析:A.只能证明乙酸具有酸性,不能证明其酸性强弱,错误;B.该盐水溶液显碱性,由于NaOH是强碱,故可以证明乙酸是弱酸,正确;C.可以证明乙酸的酸性比碳酸强,但是不能证明其酸性强弱,错误;D,可以证明乙酸具有酸性,但是不能证明其酸性强弱,错误。
答案:B
5.(2015·高考海南卷)下列曲线中,可以描述乙酸(甲,Ka=1 8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( )
解析:根据题给电离常数分析乙酸和一氯乙酸均为弱电解质且在相同温度、相同浓度时,乙酸的电离度小于一氯乙酸,即甲的电离度小于乙;弱电解质的浓度越大,电离度越小,A、C、D
与图象不符,错误;B与图象相符,正确。
答案:B
6.(2016·高考全国卷Ⅲ)下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
解析:A.=,因为随着水的量增加,醋酸电离程度增大,但醋酸根离子浓度减小,平衡常数不变,故比值变大,故错误;B.醋酸钠溶液加热,醋酸根离子水解程度增大,其=1/K,K变大,所以比值变小,故错误;C.盐酸中加入氨水至中性,则有c(H+)=c(OH-),根据电荷守恒,c(NH)=c(Cl-),故错误;D.向氯化银和溴化银的饱和溶液中加入少量硝酸银,沉淀溶解平衡逆向移动,氯离子和溴离子浓度比仍等于其溶度积的比值,故不变,故正确。
答案:D