- 2021-07-08 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习物质的制备及定量分析实验作业
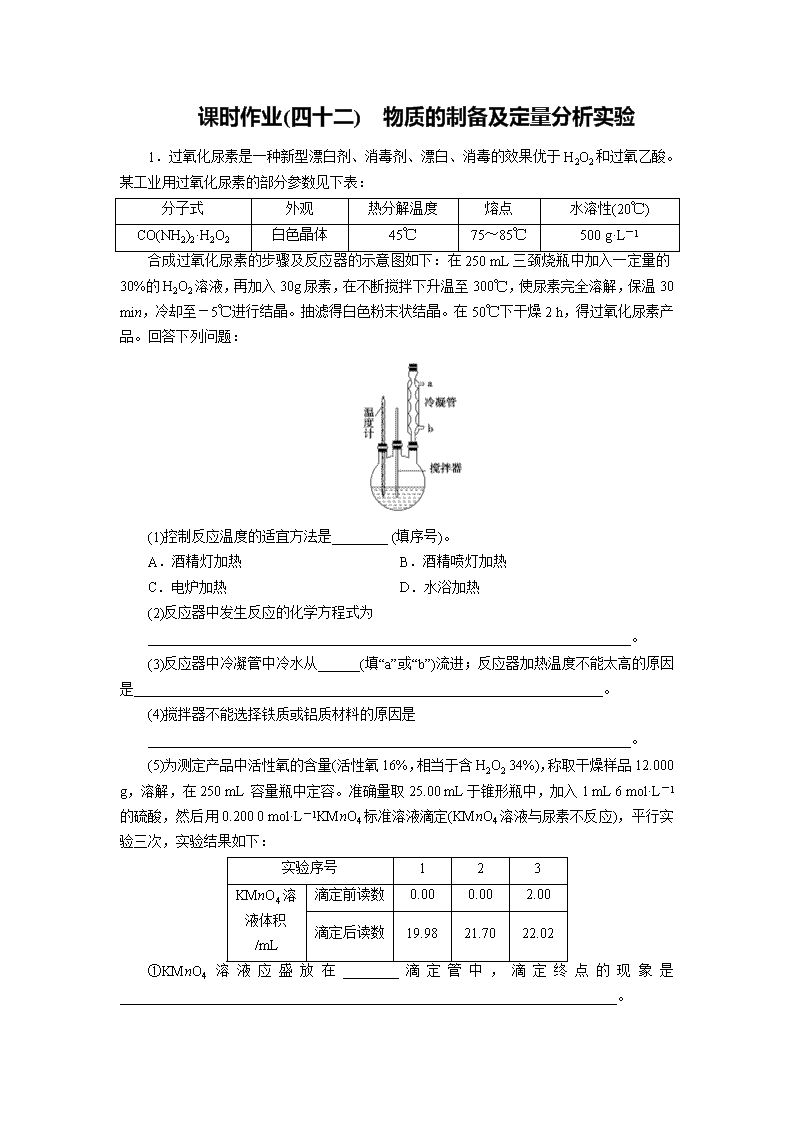
课时作业(四十二) 物质的制备及定量分析实验 1.过氧化尿素是一种新型漂白剂、消毒剂、漂白、消毒的效果优于H2O2和过氧乙酸。某工业用过氧化尿素的部分参数见下表: 分子式 外观 热分解温度 熔点 水溶性(20℃) CO(NH2)2·H2O2 白色晶体 45℃ 75~85℃ 500 g·L-1 合成过氧化尿素的步骤及反应器的示意图如下:在250 mL三颈烧瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不断搅拌下升温至300℃,使尿素完全溶解,保温30 min,冷却至-5℃进行结晶。抽滤得白色粉末状结晶。在50℃下干燥2 h,得过氧化尿素产品。回答下列问题: (1)控制反应温度的适宜方法是________ (填序号)。 A.酒精灯加热 B.酒精喷灯加热 C.电炉加热 D.水浴加热 (2)反应器中发生反应的化学方程式为 _____________________________________________________________________。 (3)反应器中冷凝管中冷水从______(填“a”或“b”)流进;反应器加热温度不能太高的原因是___________________________________________________________________。 (4)搅拌器不能选择铁质或铝质材料的原因是 _____________________________________________________________________。 (5)为测定产品中活性氧的含量(活性氧16%,相当于含H2O2 34%),称取干燥样品12.000 g,溶解,在250 mL 容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol·L-1的硫酸,然后用0.200 0 mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下: 实验序号 1 2 3 KMnO4溶液体积/mL 滴定前读数 0.00 0.00 2.00 滴定后读数 19.98 21.70 22.02 ①KMnO4溶液应盛放在________滴定管中,滴定终点的现象是_______________________________________________________________________。 ②产品中活性氧的质量分数为________。 ③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会使测得的活性氧含量________(填“偏高”“偏低”或“不变”)。 解析 (1)根据CO(NH2)2·H2O2热分解温度为45 ℃,所以采用的加热方式应用水浴加热,易于控制温度,选D;(2)反应器中过氧化氢与尿素发生化合反应生成CO(NH2)2·H2O2,反应的化学方程式为CO(NH2)2+H2O2===CO(NH2)2·H2O2;(3)冷凝管中冷水要低进高出,所以冷凝管中冷水从b流进;过氧化氢加热会分解;所以温度不能太高;(4)铁、铝具有还原性,易被氧化,所以不能选择铁质或铝质材料搅拌器;(5)①高锰酸钾具有氧化性,腐蚀橡胶,KMnO4溶液应盛放在酸式滴定管中;H2O2与高锰酸钾溶液反应,使高锰酸钾溶液褪色,滴定终点的现象是滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色;②第二次实验明显误差太大,应舍去,第一次和第三次滴定平均消耗KMnO4溶液20.00 mL;依据反应2MnO+5H2O2+6H+===2Mn2++8H2O+5O2; 2MnO~~~~~~~~5H2O2; 2 5 0.020 0 L×0.200 0 mol/L 0.01 mol 所以12.000 g样品中含过氧化氢0.1 mol;过氧化氢质量分数=×100%=28.3%;活性氧16%,相当于H2O2 34%,则活性氧质量分数==13.3%,;③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,消耗高锰酸钾溶液偏小,依据c(标准)×V(标准)=c(待测)×V(待测),则过氧化氢物质的量偏小,活性氧含量偏低。 答案 (1)D (2)CO(NH2)2+H2O2===CO(NH2)2·H2O2 (3)b 温度过高会导致过氧化氢分解 (4)铝、铁易被氧化 (5)①酸式 滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色 ②13.3% ③偏低 2.二氧化氯气体有毒,常应用在果蔬保鲜方面,用NaClO3与CH3OH (沸点64.7℃) 在催化剂、61℃时发生反应得到ClO2,实验装置如下图,(已知ClO2 的稳定性较差,用稳定剂吸收ClO2。使用时加酸释放出ClO2)。完成下列填空: (1)仪器b的名称为____________,其作用是____________。 (2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式________________________________________________________________________。 (3)甲装置中采取的加热方式是________,如果滴加甲醇的速度过快, 可造成的后果____________________。 (4)某同学建议将上述装置中的分液漏斗c改为恒压漏斗e,你认为他的理由是 。 (5)实验结束后,先用仪器a 注入一定量的NaOH溶液,过一段时后再拆卸仪器,其目的是_____________________________________________________________________。 (6)下表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是______( 填“1”或“2”),原因是_____________________________。 时间/天 稳定剂 0 2 4 6 8 10 12 14 16 稳定剂1 80 150 80 20 10 5 0 0 0 稳定剂2 40 52 52 52 52 50 48 47 20 (7)某同学在实验室测定某保鲜剂中ClO2含量,其实验操作如下,在维形瓶中加入足量的KI溶液。再加入5 mL稀硫酸,取15 mL保鲜剂于锥形瓶中。ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+===2Cl-+5I2+4H2O;用0.1000 mol/L Na2S2O3标准溶液滴定碘单质(I2+2S2O===2I-+S4O) 。达到滴定终点时用去18.00 mL Na2S2O3标准溶液,测得该保鲜剂中ClO2的含量为________g·L-1 解析 (1)根据图示仪器b的名称球形冷凝管;球形冷凝管其作用是冷凝回流甲醇;(2)甲醇被氧化为甲酸(HCOOH),NaClO3被还原为ClO2,反应方程式是4NaClO3+CH3OH+2H2SO42Na2SO4+4ClO2+HCOOH+3H2O;(3)根据NaClO3与CH3OH(沸点64.7 ℃)在催化剂、61℃时发生反应,所以加热方式为水浴加热;如果滴加甲醇的速度快,生成ClO2的速率快,稳定剂来不及吸收ClO2;(4)恒压漏斗能平衡气压,有利于液体顺利下流,防止甲醇挥发;(5)二氧化氯气体有毒,注入氢氧化钠溶液能将反应停止,并吸收多余的ClO2;(6)释放的ClO2浓度稳定,保鲜时间长的稳定剂效果好,根据表格数据,效果较好的稳定剂是2;(7)设保鲜剂中ClO2的含量是xg·L-1 ClO2~~~~5Na2S2O2 67.5 g 5 mol 0.015x 0.018 L×0.100 0 mol/L =,x=1.62。 答案 (1)球形冷凝管 冷凝回流甲醇 (2)4NaClO3+CH3OH+2H2SO42Na2SO4+4ClO2+HCOOH(H2CO2)+3H2O (3)水浴加热 稳定剂来不及吸收ClO2 (4)有利于液体顺利下流,防止甲醇挥发 (5)将反应停止,并吸收多余的ClO2 (6)2 释放的ClO2浓度稳定,保鲜时间长 (7)1.62 3.实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+ 5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。 某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题: (1)仪器a的名称是__________。 (2)检查虚线框内装置气密性的方法是________________________________________ ________________________________________________________________________ ________________________________________________________________________。 (3)若撤去装置B,对实验的影响是____________________________________________ ________________________________________________________________________。 (4)实验时发现D中导管口处气泡速率过快,合理的解决方法是________________________________________________________________________。 (5)已知:CCl3CHO+OH-→CHCl3+HCOO- HCOO-+I2===H++2I-+CO2↑ I2+2S2O===2I-+S4O称取0.40 g产品,配成待测溶液,加入20.00 mL 0.100 mol/L 碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020 mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2SO3溶液20.00 mL。滴定时所用指示剂是________,达到滴定终点的现象是__________________________________,测得产品的纯度为________。 解析 A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气。 (1)根据装置图,仪器a为冷凝管; (2)检查虚线框内装置气密性,可以在B中加入一定量水至浸没导管,对A加热。若B中导管口有气泡产生,且停止加热,B中导管内有稳定水柱形成,则装置气密性良好; (3)反应生成的氯气中含有氯化氢和水蒸气,装置B中的饱和食盐水可以除去氯化氢,若撤去装置B,会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低。 (4)实验时发现D中导管口处气泡速率过快,说明生成氯气的速率过快,合理的解决方法有停止对A加热或控制滴加盐酸量; (5)碘遇淀粉显蓝色,滴定时可以选用淀粉作指示剂,达到滴定终点时,蓝色变为无色,且半分钟内不变色;根据消耗的Na2S2O3计算剩余I2的物质的量0.020 00 mol·L-1×0.02 L×=2×10-4 mol,与HCOO-反应的I2的物质的量为0.100 0 mol·L-1×0.02 L-2×10-4mol=1.8×10-3 mol,由CCl3CHO~HCOO~I2可知,CCl3CHO的物质的量为1.8×10-3 mol,则产品的纯度为× 100%=66.4%,故答案为:淀粉溶液;蓝色变为无色,且半分钟内不变色;66.4%。 答案 (1)(球形)冷凝管 (2)在B中加入一定量水至浸没导管,对A加热。若B中导管口有气泡产生,且停止加热,B中导管内有稳定水柱形成,则装置气密性良好 (3)会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低 (4)停止对A加热或控制滴加盐酸量 (5)淀粉溶液 蓝色变为无色,且半分钟内不变色 66.4%(或66.375%) 4.(2019·江西南昌模拟)二氯二氢硅(SiH2Cl2)常用作外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl与硅在250~260℃反应可以制得SiH2Cl2。 (1)利用浓硫酸、浓盐酸为原料,选用A装置制取HCl,利用了浓硫酸的________性。 (2)D装置中生成二氯二氢硅的化学方程式为 ______________________________________________________________________。 (3)按照气体从左到右方向,制取SiH2Cl2的装置(h处用止水夹夹好)连接次序为a→____→____→____→____→____→____→____。(填仪器接口的字母,其中C装置用到2次) (4)按从左到右的顺序,前面C装置中装的药品为_________,后面C装置的作用为 ________________________________________________________________________。 (5)反应除生成二氯二氢硅之外,还会生成H2和________、________。 (6)新的制取SiH2Cl2的方法是:往硅粉中先通入Cl2在300~350℃反应生成SiCl4,然后再与HCl在250~260℃反应,可以大大提高产率。如果通入气体次序相反,结果会________________________________________________________________________(用化学方程式表示)。 解析 (1)浓硫酸具有吸水性,能使浓盐酸挥发以制取HCl。(2)根据得失电子守恒、元素守恒写出并配平化学方程式:Si+2HClSiH2Cl2。(3)根据实验目的、所用试剂及SiH2Cl2的性质,可确定实验过程为:制备氯化氢(A)、干燥氯化氢(C)、制备SiH2Cl2(D)、收集冷凝的SiH2Cl2(B)、尾气处理和防止空气中的水蒸气进入B中(C)。所以接口的连接次序是a→d→e→f→g→b→c→d。(4)前面C装置的作用是吸收HCl中的水蒸气,故装的药品可以为P2O5或CaCl2;后面C装置的作用是进行尾气处理和防止空气中的水蒸气进入B中,可装入碱石灰。(5)Si在高温下还可以与HCl发生反应:3Si+10HCl2SiHCl3+SiCl4+4H2。(6)根据CH4与Cl2发生的取代反应,可推知SiH4与Cl2发生取代反应的产物有SiH3Cl、SiH2Cl2、SiHCl3、SiCl4,表明SiH2Cl2能进一步与Cl2反应生成SiHCl3、SiCl4。 答案 (1)吸水 (2)Si+2HClSiH2Cl2 (3)d e f g b c d (4)P2O5或CaCl2 尾气处理和防止空气中的水蒸气进入B中 (5)SiCl4 SiHCl3 (6)SiH2Cl2+2Cl2Si4Cl4+2HCl(或SiH2Cl2+Cl2SiHCl3+HCl) 5.碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。 (1)采用装置A,在高温下将x g钢样中碳、硫转化为CO2、SO2。 ①气体a的成分是______________。 ②若钢样中硫以FeS的形式存在,A中反应:3FeS+5O21________+3________。 (2)将气体a通入测硫装置中(如下图),采用滴定法测定硫的含量。 ①H2O2氧化SO2的化学方程式: ________________________________________________________________________。 ②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。 (3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。 ①气体a通过B和C的目的是_______________________________________________。 ②计算钢样中碳的质量分数,应测量的数据是________________________________。 解析 (1)①钢样中的碳、硫在装置A中高温加热条件下生成CO2和SO2,还有未反应的O2,故气体a的成分为O2、SO2、CO2。②根据得失电子守恒和质量守恒定律配平化学方程式:3FeS+5O2Fe3O4+3SO2。(2)①H2O2和SO2发生氧化还原反应:H2O2+SO2===H2SO4。②根据题意,消耗1 mL NaOH溶液相当于硫的质量为y克,则消耗z mL NaOH溶液,相当于硫的质量为yz g,所以钢样中硫的质量分数为或×100%。(3)①气体a中含有O2、SO2和CO2,在吸收CO2测定碳的含量时,也可能吸收SO2 ,故气体a通过装置B和C的目的是排除SO2对CO2测定的干扰。②计算钢样中碳的质量分数,应测量吸收CO2前、后吸收瓶的质量,其质量差为CO2的质量。 答案 (1)①O2、SO2、CO2 ②Fe3O4 SO2 (2)①H2O2+SO2===H2SO4 ② (3)①排除SO2对CO2测定的干扰 ②吸收CO2前、后吸收瓶的质量查看更多