- 2021-07-08 发布 |
- 37.5 KB |
- 28页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习专题四氧化还原反应课件(28张)
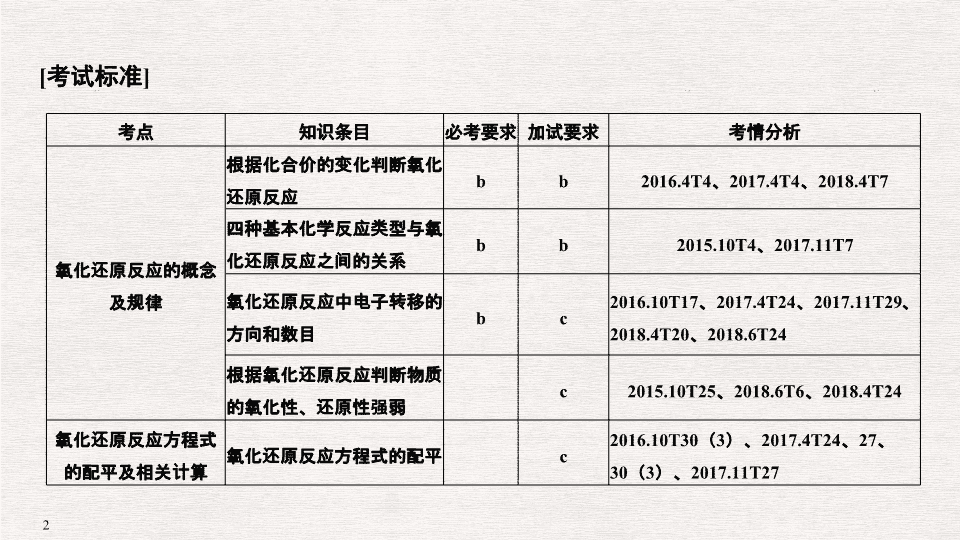
专题四 氧化还原反应 [ 考试标准 ] 考点 知识条目 必考要求 加试要求 考情分析 氧化还原反应的概念及规律 根据化合价的变化判断氧化还原反应 b b 2016.4T4 、 2017.4T4 、 2018.4T7 四种基本化学反应类型与氧化还原反应之间的关系 b b 2015.10T4 、 2017.11T7 氧化还原反应中电子转移的方向和数目 b c 2016.10T17 、 2017.4T24 、 2017.11T29 、 2018.4T20 、 2018.6T24 根据氧化还原反应判断物质的氧化性、还原性强弱 c 2015.10T25 、 2018.6T6 、 2018.4T24 氧化还原反应方程式的配平及相关计算 氧化还原反应方程式的配平 c 2016.10T30 ( 3 )、 2017.4T24 、 27 、 30 ( 3 )、 2017.11T27 考点一:氧化还原反应的判断 1. ( 2018· 嘉兴一中高一期末) 下列关于氧化还原反应的说法正确的是( ) A.CH 3 CHO 既有氧化性,又有还原性 B. 反应 BaO + H 2 O 2 ===BaO 2 + H 2 O 中, H 2 O 2 作氧化剂, BaO 2 为氧化产物 C. 反应 CH 4 + Cl 2 ―→ CH 3 Cl + HCl ,既是取代反应、置换反应,也是氧化还原反应 D. 反应 3Cu + 8HNO 3 ===3Cu ( NO 3 ) 2 + 2NO ↑ + 4H 2 O 中,氧化剂与还原剂的物质的量之比为 8 ∶ 3 解析 A.CH 3 CHO 中的醛基可以与氧气发生催化氧化,也可与氢气发生还原反应,既有氧化性,又有还原性,故 A 正确; B. 反应 BaO + H 2 O 2 ===BaO 2 + H 2 O 中没有元素的化合价发生变化,不属于氧化还原反应,故 B 错误; C. 反应 CH 4 + Cl 2 ―→ CH 3 Cl + HCl ,既是取代反应、也是氧化还原反应,但不属于置换反应,故 C 错误; D. 反应 3Cu + 8HNO 3 ===3Cu ( NO 3 ) 2 + 2NO ↑ + 4H 2 O 中,氧化剂为硝酸,还原剂为铜,氧化剂与还原剂的物质的量之比为 2 ∶ 3 ,故 D 错误;故选 A 。 答案 A A.CuFeS 2 中被氧化和被还原的原子数之比为 2 ∶ 1 B. 该反应中有两种物质作氧化剂 C. 每生成 1 mol SO 2 ,反应中转移 6 mol 电子 D.CuFeS 2 中被氧化的元素只有硫 解析 A.Cu 元素由+ 2 价降低为+ 1 价, S 元素由- 2 价升高到+ 4 价, CuFeS 2 中 Cu 元素被还原、 S 元素被氧化,且生成 Cu 2 S 、 FeS 时 S 元素的化合价不变,则 CuFeS 2 中被氧化和被还原的原子数目之比为 1 ∶ 2 ,故 A 错误; B. 反应中 Cu 、 O 元素的化合价降低,两种反应物均作氧化剂,故 B 正确; C. 由方程式可知,每生成 1 mol SO 2 ,有 1 mol 硫被氧化生成 SO 2 ,转移电子为 1 mol × [4 -(- 2 ) ] = 6 mol ,故 C 正确; D.Cu 元素由+ 2 价降低为+ 1 价, S 元素由- 2 价升高到+ 4 价, CuFeS 2 中 Cu 元素被还原、 S 元素被氧化,故 D 正确。故选 A 。 答案 A 答案 D 考点四:氧化还原反应规律的应用 4. ( 2017· 绍兴新昌中学) NaNO 2 有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。 ( 1 )下列说法正确的是 (填序号)。 A. 解毒剂美蓝应该具有氧化性 B. 中毒时亚硝酸盐发生氧化反应 C. 解毒时高铁血红蛋白被还原 D. 中毒过程中血红蛋白显氧化性 ( 2 )已知 NaNO 2 能发生如下反应: 2NaNO 2 + 4HI===2NO ↑ + I 2 + 2NaI + 2H 2 O 从上述反应推知 (填序号)。 A. 氧化性: I 2 > NaNO 2 B. 氧化性: NaNO 2 > I 2 C. 还原性: HI > NO D. 还原性: I 2 > HI ( 3 )根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别 NaNO 2 和 NaCl 。现供选用的物质有: ① 白酒 ② 碘化钾淀粉试纸 ③ 淀粉 ④ 白糖 ⑤ 食醋,进行本实验时,可以选用的物质至少有 (填序号)。 ( 4 )某工厂的废液中含有 2% ~ 5% 的 NaNO 2 ,直接排放会造成污染。下列试剂中: ① NaCl ② NH 4 Cl ③ HNO 3 ④ 浓 H 2 SO 4 ,能使 NaNO 2 转化为 N 2 的是 (填序号)。 解析 ( 1 )将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,说明 NaNO 2 具有氧化性,美蓝是亚硝酸盐中毒的有效解毒剂,应具有还原性,则 A. 解毒剂美蓝应该具有还原性,故 A 错误; B. 中毒时亚硝酸盐发生还原反应,能使血红蛋白中的铁元素由二价变为三价,故 B 错误; C. 加入解毒剂美蓝,高铁血红蛋白被还原,故 C 正确; D. 中毒过程中血红蛋白被氧化,表现出还原性,故 D 错误。( 2 )根据反应 2NaNO 2 + 4HI===2NO ↑ + I 2 + 2NaI + 2H 2 O 可知,氧化性: NaNO 2 > I 2 ,还原性: HI > NO 。( 3 )鉴别 NaNO 2 和 NaCl ,可根据 NaNO 2 在酸性条件下具有氧化性,用淀粉碘化钾试纸来检验,可加入醋酸酸化。( 4 )能使 NaNO 2 转化为 N 2 的应是具有还原性的物质,只有 NH 4 Cl 符合。 答案 ( 1 ) C ( 2 ) BC ( 3 ) ②⑤ ( 4 ) ② 考点五:氧化还原反应的有关计算 5. ( 2018· 金华十校高一) 向 100 mL FeI 2 溶液中逐渐通入 Cl 2 ,其中 n ( I 2 )、 n ( Fe 3 + )随通入 n ( Cl 2 )的变化如图所示,下列说法不正确的是( ) A. 氧化性强弱: I 2查看更多