- 2021-07-08 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版富集在海水中的元素——氯作业(2)
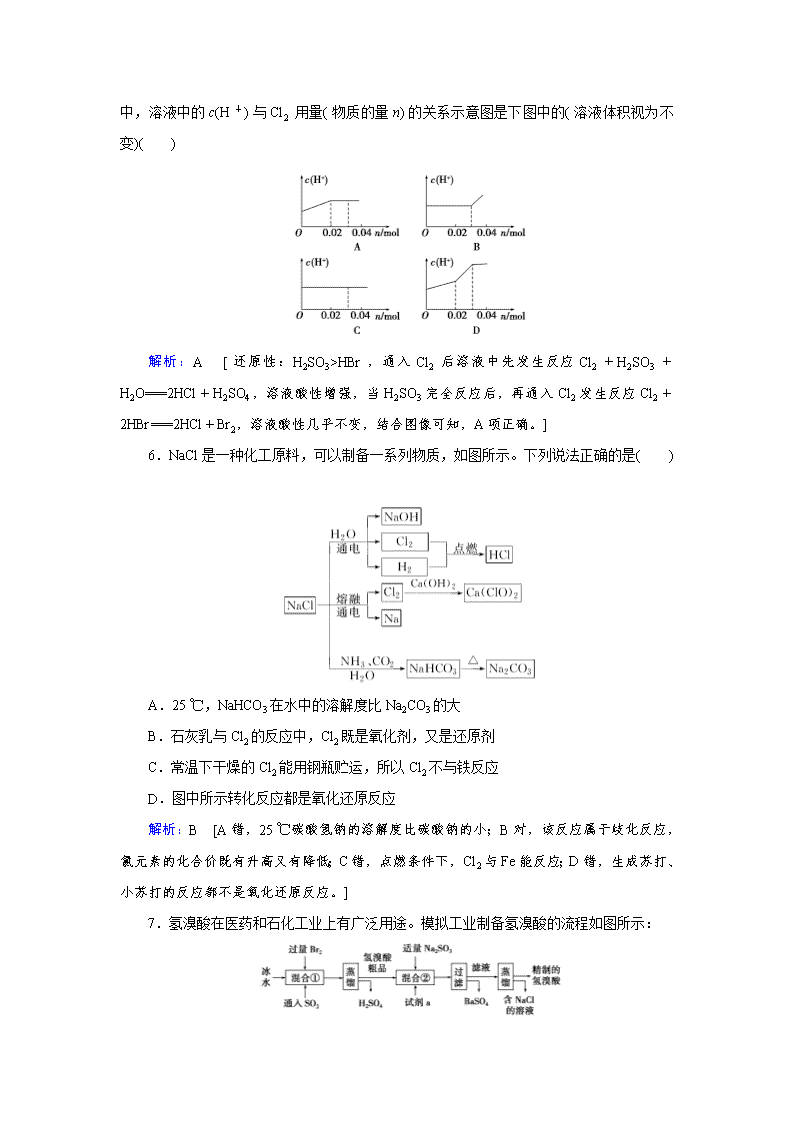
富集在海水中的元素——氯 1.氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断不正确的是( ) A.在CCl4中的溶解性BrCl<Br2 B.BrCl氧化性比Br2强 C.BrCl能使润湿的淀粉碘化钾试纸变蓝 D.常温下BrCl可与NaOH溶液反应生成NaClO和NaBr 解析:D [由于氯元素的非金属性强于溴元素的,所以BrCl和氢氧化钠溶液反应生成物应该是NaBrO和NaCl,选项D不正确,其余都是正确的,答案选D。] 2.以下关于氟、氯、溴、碘的性质叙述错误的是( ) ①HF、HCl、HBr、HI中酸性最强的是HF ②单质F2、Cl2、Br2、I2中,I2沸点最高 ③单质F2、Cl2、Br2、I2中,氧化性最强的是F2 ④HF、HCl、HBr、HI还原性最强的是HI ⑤单质F2、Cl2、Br2、I2中,与氢化合最容易的是F2 ⑥HF、HCl、HBr、HI沸点最高的是HI ⑦HF、HCl、HBr、HI稳定性逐渐减弱 A.只有① B.②⑤⑦ C.①⑥ D.③④ 解析:C [①随着原子序数的增大,卤族元素的氢化物的酸性逐渐增强,所以酸性最强的是HI,故错误。②随着原子序数的增大,卤素单质的沸点逐渐增大,所以I2沸点最高,故正确。③随着原子序数的增大,卤素单质得电子能力逐渐减弱,所以氧化性最强的是F2,故正确。④随着原子序数的增大,卤素单质得电子能力逐渐减弱,所以相应阴离子失电子能力逐渐增强,故还原性最强的是HI,正确。⑤随着原子序数的增大,卤素单质得电子能力逐渐减弱,所以单质与氢气化合逐渐困难,与氢化合最容易的是F2,故正确。⑥分子晶体的沸点随着相对分子质量的增大而增大,但要注意:如果分子间能形成氢键就会使其沸点增大,HF中能形成分子间氢键,导致其沸点增大,所以沸点最高的是HF,故错误。⑦ 随着原子序数的增大,卤族元素非金属性逐渐减弱,所以HF、HCl、HBr、HI的稳定性逐渐减弱,故正确。] 3.在含有0.1 mol FeBr2、0.1 mol FeI2的1 L溶液中,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为血红色,则下列结论和评价都符合实验事实的是( ) 编号 推断实验结论 评价结论 ① 一定发生反应:2I-+Cl2===I2+2Cl-,2Br-+Cl2===Br2+2Cl- 正确 ② 一定发生反应:2Fe2++Cl2===2Fe3++2Cl- 错误 ③ 不能确定是否存在:Fe2+、Br- 正确 ④ 若取少量所得溶液,加入CCl4液体,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,则通入的氯气一定过量 错误 ⑤ 由上述实验得出离子还原性顺序:I->Fe2+>Br->Cl- 正确 A.①⑤ B.②④ C.③ D.③⑤ 解析:C [根据实验现象只能得出:一定有+3价铁离子生成,由于+3价铁离子能氧化I-,故I-肯定完全被氧化,①结论不正确,评价不正确;②结论正确,评价不正确;③结论和评价都正确;④氯气可能恰好完全反应,结论不正确,评价正确;⑤仅由上述实验不能得到离子还原性顺序,结论不正确,评价不正确。] 4.溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示:干海带海带灰水溶液―→碘单质 下列有关叙述正确的是( ) A.碘元素在海水中也有游离态存在 B.在提取的过程中用的氧化剂可以是H2O2 C.操作A是结晶或重结晶 D.B是提纯操作,常用蒸馏或分馏 解析:B [碘元素在海水中只以化合态存在,没有游离态,A错误。操作A是萃取,操作B是分液,然后通过蒸馏等操作来得到单质碘,C、D错误。] 5.将0.03 mol Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中, 在此过程中,溶液中的c(H+)与Cl2用量(物质的量n)的关系示意图是下图中的(溶液体积视为不变)( ) 解析:A [还原性:H2SO3>HBr,通入Cl2后溶液中先发生反应Cl2+H2SO3+H2O===2HCl+H2SO4,溶液酸性增强,当H2SO3完全反应后,再通入Cl2发生反应Cl2+2HBr===2HCl+Br2,溶液酸性几乎不变,结合图像可知,A项正确。] 6.NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法正确的是( ) A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大 B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 D.图中所示转化反应都是氧化还原反应 解析:B [A错,25 ℃碳酸氢钠的溶解度比碳酸钠的小;B对,该反应属于歧化反应,氯元素的化合价既有升高又有降低;C错,点燃条件下,Cl2与Fe能反应;D错,生成苏打、小苏打的反应都不是氧化还原反应。] 7.氢溴酸在医药和石化工业上有广泛用途。模拟工业制备氢溴酸的流程如图所示: 回答下列问题: (1)混合①中发生反应的离子方程式为________________________________________。 (2)混合②中加入的试剂a是____________________________________________。 (3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是 ________________ (请用离子方程式表示)。 (4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因。该试剂是 ________ (填字母编号)。 a.KMnO4溶液 b. NaOH溶液 c.KSCN溶液 d.淀粉KI溶液 e.CCl4 解析:(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr,反应的离子方程式为SO2+Br2+2H2O===4H++2Br-+SO。 (2)由流程图可知,试剂a为BaCl2溶液。 (3)若Na2SO3过量,能与HBr反应生成二氧化硫、溴化钠、水,反应的离子方程式为SO+2H+===SO2↑+H2O。 (4)CCl4与溶液混合后分层,有机层在下层,水层在上层,若有机层无色,水层为黄色,则为含Fe3+所致;若有机层为橙色,水层为无色,则为含Br2所致;若有机层为橙色、水层为黄色,则为含Fe3+和Br2所致,故选e。 答案:(1)SO2+Br2+2H2O===4H++2Br-+SO (2)BaCl2溶液 (3)SO+2H+===SO2↑+H2O (4)e 8.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: 请填写下列空白: (1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 ________ ( 从下列仪器中选出所需的仪器,将标号字母填写在空白处)。 A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器 (2)步骤③的实验操作名称是 ________ ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 ________ 。 (3)步骤④反应的离子方程式是_________________________________________。 (4)步骤⑤中,某学生选择用苯来提取碘的理由是________________________________ ________________________________________________________________________。 (5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:________。 解析:本题以提取碘为背景,综合考查了灼烧固体、过滤等实验基本操作,(5)问是一个实验方案的设计题,所以该题很好地综合考查了学生的动手动脑能力。 (1)该实验是对固体海带加热灼烧,与三脚架一起使用的常常是泥三角、坩埚和酒精灯。 (2)步骤③是由海带灰悬浊液得到含碘离子的溶液,因此一定要进行过滤。 (3)结合“碘离子含碘水溶液”,再联想实验室中Cl2的制备不难写出④的离子方程式为2I-+MnO2+4H+===Mn2++I2+2H2O。 (5)根据淀粉遇碘单质变蓝这一现象,可以取少量提取碘之后的溶液,加入淀粉看是否变蓝来检验。 答案:(1)BDE (2)过滤 蒸馏 (3)2I-+MnO2+4H+===Mn2++I2+2H2O (4)苯与水互不相溶;碘在苯中的溶解度比在水中大;苯与碘不反应 (5)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘) 9.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计如下实验: (1)①检查气体发生装置A的气密性的操作是_____________________________ ________________________________________________________________________。 ②整套实验装置存在一处明显的不足,请指出:____________________________ ________________________________________________________________________。 (2)用改正后的装置进行实验,实验过程如下: 实验操作 实验现象 结论 打开活塞a,向圆底烧瓶中滴人适量浓盐酸;然后关闭活塞a,点燃酒精灯 D装置中:溶液变红E装置中:水层溶液变黄,振荡后,CCl4层无明显变化 Cl2、Br2、Fe3+氧化性由强到弱的顺序为 ________ (3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中;红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下: ①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因:_____ ________________________________________________________________________, 请设计简单实验证明上述解释:________________________________________ ________________________________________________________________________。 ②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因:____________________________________________ ________________________________________________________________________。 ③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为_____________________。 解析:(1)①检查装置A的气密性一般采用热膨胀法:关闭活塞a,打开止水夹b,将长导管末端浸入水中,并用酒精灯对圆底烧瓶微热(或用手捂热),如果导管口有气泡冒出,撤去酒精灯(或松开手)后导管中上升一段水柱,则装置气密性良好。②氯气有毒,必须有尾气处理装置。(2)E装置中的现象说明溶液中Fe2+被氧化而Br-未被氧化,所以Fe2+ 的还原性强于Br-,即Br2的氧化性强于Fe3+。(3)①D中溶液呈红色是由于发生反应:Fe3++3SCN-Fe(SCN)3,根据资料知过量氯气能与SCN-反应,使上述平衡逆向移动,故红色会褪去;红色褪去是由于SCN-浓度减小,所以可以向褪色后的溶液中滴加KSCN溶液,观察溶液是否重新变红。②根据资料推测E中生成物是BrCl,该物质水解生成HBrO和HCl,向其中加入硝酸银溶液,只能生成白色沉淀AgCl。③反应原理:BrCl中+l价的Br首先生成HBrO,该物质具有氧化性,被I-还原成KBr,I-被氧化为I2,另一种生成物是KCl。 答案:(1)①关闭活塞a,打开止水夹b,将长导管末端浸入水中,用手捂住圆底烧瓶,管口有气泡;松开手后,导管中上升一段水柱,则装置气密性良好 ②缺少尾气处理装置 (2)Cl2>Br2>Fe3+ (3)①过量氯气和SCN-反应:2SCN-+Cl2===2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-Fe(SCN)3平衡逆向移动而褪色 取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理 ②BrCl+H2O===HBrO+HCl,反应只产生Cl-,不产生Br- ③BrCl+2KI===KCl+KBr+I2查看更多