- 2021-07-08 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习化学反应速率与化学平衡作业(全国通用)
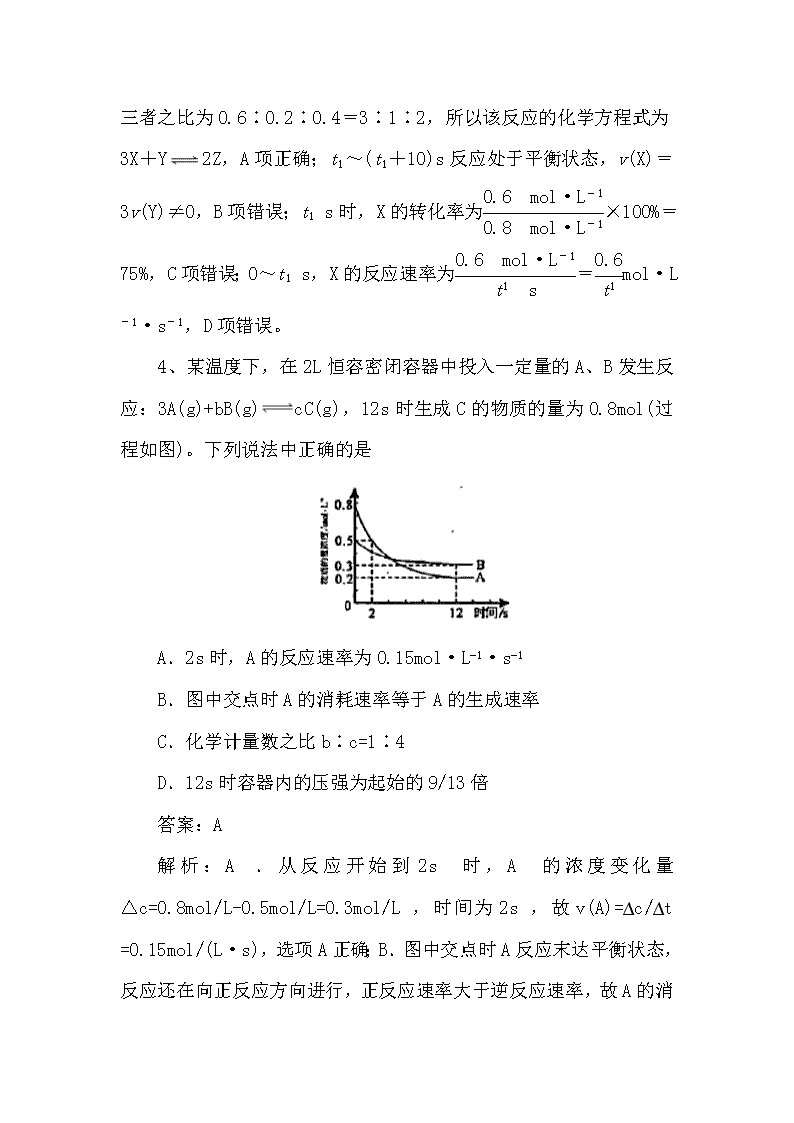
化学反应速率与化学平衡 1、下列说法正确的是( ) A.分别向等物质的量浓度的Na2CO3和NaHCO3溶液中滴加2滴酚酞溶液,后者红色更深 B.分别向2mL 5%H2O2溶液中滴加1mL 0.1mol/L FeCl3和CuSO4溶液,产生气泡快慢不相同 C.蛋白质溶液遇饱和Na2SO4溶液或醋酸铅溶液均产生沉淀,沉淀均可溶于水 D.用加热NH4C1和Ca(OH)2固体的混合物的方法,可将二者分离 答案:B 解析:A.等物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液碱性强,所以分别向等物质的量浓度的Na2CO3和NaHCO3溶液中滴加2滴酚酞溶液,前者红色更深,A错误;B. FeCl3和CuSO4溶液对5%H2O2溶液分解的催化效果不同,所以分别向2mL 5%H2O2溶液中滴加1mL 0.1mol/L FeCl3和CuSO4溶液,产生气泡快慢不相同,B正确;C. Na2SO4不属于重金属盐,该盐可使蛋白质产生盐析现象而产生沉淀,醋酸铅属于重金属盐,能使蛋白质变性而产生沉淀,所以蛋白质溶液中加入醋酸铅溶液,蛋白质变性产生的白色沉淀不溶于水,C错误;D. NH4Cl固体和Ca(OH)2固体在加热条件下发生反应生成氨气,不能用加热的方法分离,D错误;故合理选项是B。 2、一定温度下,反应①C(s)+CO2(g)===2CO(g) ΔH>0,反应②2SO2(g)+O2(g)===2SO3(g) ΔH <0。下列有关以上两个反应的说法正确的是( ) A.降低温度反应①的速率减小,反应②的速率增大 B.增大压强反应①的速率不变,反应②的速率增大 C.增大压强反应①的速率增大,反应②的速率增大 D.升高温度反应①的速率增大,反应②的速率减小 答案:C 解析:降低温度反应速率减小,升高温度反应速率增大,A、D错误;对于有气体参加的可逆反应,增大压强反应速率增大,减小压强反应速率减小,B错误,C正确。 3、在一定条件下,X气体与Y气体反应生成Z气体。反应过程中,反应物与生成物的物质的量浓度随时间变化的曲线如图所示,则下列叙述正确的是( ) A.该反应的化学方程式为3X+Y2Z B.t1~(t1+10)s时,v(X)=v(Y)=0 C.t1 s时反应物X的转化率为60% D.0~t1 s内X的反应速率为v(X)=mol·L-1·s-1 答案:A 解析:0~t1 s,Δc(X)=(0.8-0.2)mol·L−1=0.6 mol·L−1,Δc(Y)=(0.5-0.3)mol·L−1=0.2 mol·L−1,Δc(Z)=0.4mol·L−1 ,三者之比为0.6∶0.2∶0.4=3∶1∶2,所以该反应的化学方程式为3X+Y2Z,A项正确;t1~(t1+10)s反应处于平衡状态,v(X)=3v(Y)≠0,B项错误;t1 s时,X的转化率为×100%=75%,C项错误;0~t1 s,X的反应速率为=mol·L-1·s-1,D项错误。 4、某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)cC(g),12s时生成C的物质的量为0.8mol(过程如图)。下列说法中正确的是 A.2s时,A的反应速率为0.15mol·L−1·s−1 B.图中交点时A的消耗速率等于A的生成速率 C.化学计量数之比b∶c=1∶4 D.12s时容器内的压强为起始的9/13倍 答案:A 解析:A.从反应开始到2s时,A的浓度变化量△c=0.8mol/L-0.5mol/L=0.3mol/L,时间为2s,故v(A)=∆c/∆t =0.15mol/(L·s),选项A正确;B.图中交点时A反应末达平衡状态,反应还在向正反应方向进行,正反应速率大于逆反应速率,故A的消耗速率大于A的生成速率,选项B错误;C.根据化学反应速率之比等于计量数之比,12s时B减少了0.2mol/L,C增大了0.4mol/L,故化学计量数之比b∶c=0.2∶0.4=1∶2,选项C错误;D.12s时A的浓度变化为0.6mol/L,B减少了0.2mol/L,C增大了0.4mol/L,故b=1,c=2,反应中气体体积不变,容器内的压强保持不变,选项D错误。答案选A。 5、有某可逆反应aA(g)+bB(g)cC(g),如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( ) A.a+b查看更多
相关文章
- 当前文档收益归属上传用户