- 2021-07-08 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省佛山市2020届高三教学质量检测(二模考试)理科综合化学试题 Word版含解析
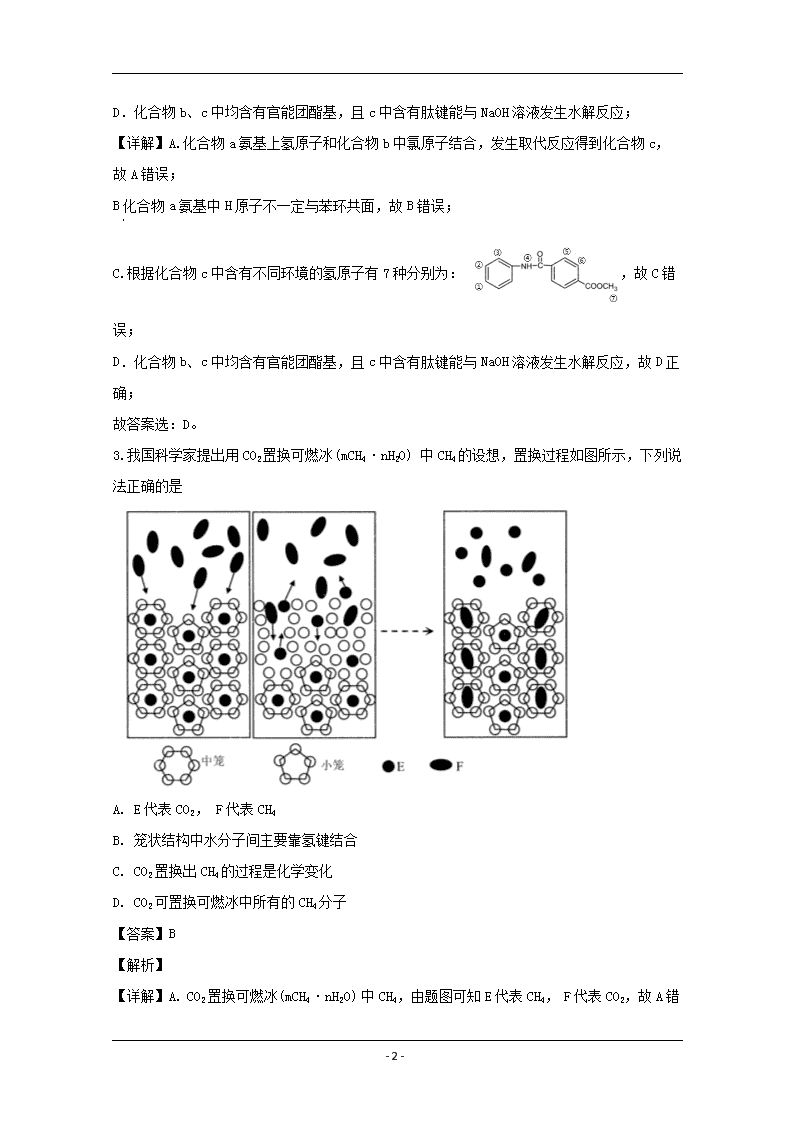
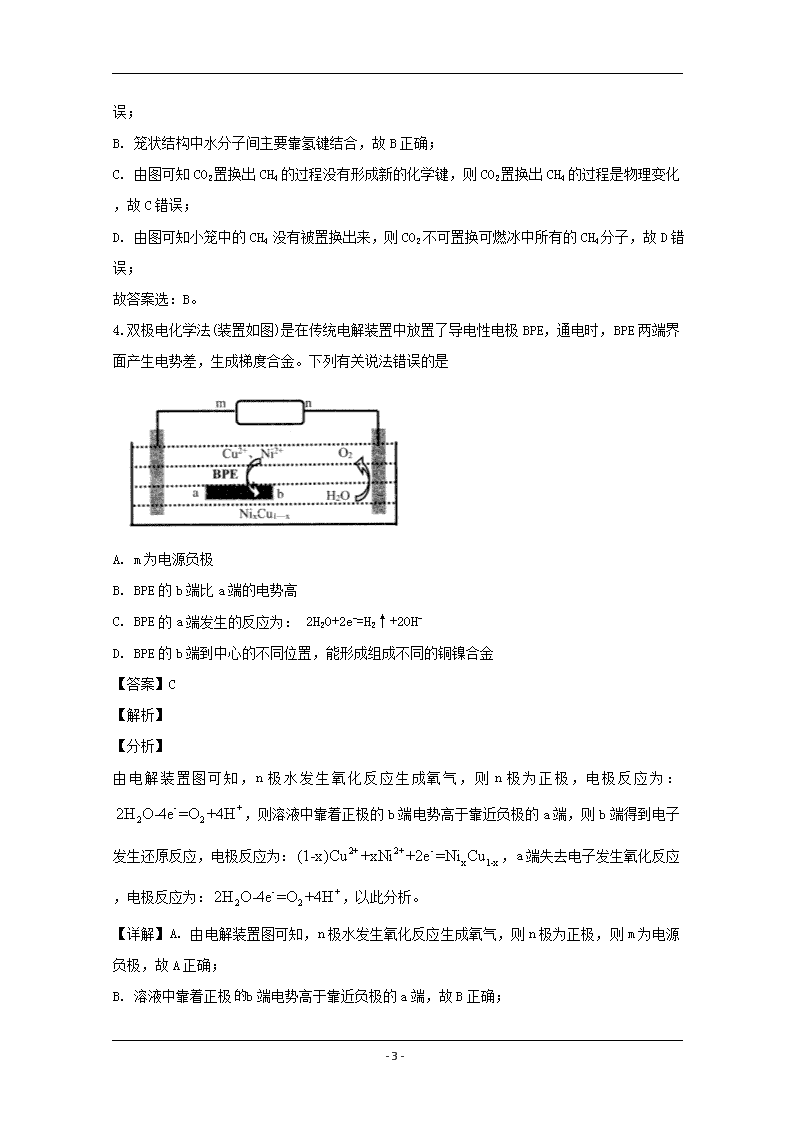
www.ks5u.com 2019~2020学年佛山市普通高中高三教学质量检测(二) 高三理科综合试题化学部分 可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 C1-35.5 1.科学防护对预防病毒感染非常重要,下列说法错误的是 A. 冠状病毒粒子直径约60-220 nm,介于溶液和胶体粒子之间 B. 制作防护服和口罩的无纺布是有机高分子材料 C. 免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性 D. 二氧化氯泡腾片可用于水处理 【答案】A 【解析】 【详解】A.溶液分散质直径小于1nm,胶体分散质直径在1nm-100nm,浊液分散质直径大于100nm,冠状病毒粒子直径约60-220 nm,介于胶体粒子和浊液之间,故A错误; B.无纺布是有机高分子材料,故B正确; C.银离子、乙醇均能使蛋白质变性,故C正确; D. 二氧化氯是常见的杀菌消毒剂,可用于水处理,故D正确; 故答案选:A。 2.化合物c的制备原理如下: 下列说法正确的是 A. 该反应为加成反应 B. 化合物a中所有原子一定共平面 C. 化合物C的一氯代物种类为5种 D. 化合物b、c均能与NaOH溶液反应 【答案】D 【解析】 【分析】 A.根据加成反应和取代反应定义判断反应类型; B.化合物a氨基中H原子不一定与苯环共面; C.根据化合物c的结构简式判断不同环境的氢原子个数; - 20 - D.化合物b、c中均含有官能团酯基,且c中含有肽键能与NaOH溶液发生水解反应; 【详解】A.化合物a氨基上氢原子和化合物b中氯原子结合,发生取代反应得到化合物c,故A错误; B化合物a氨基中H原子不一定与苯环共面,故B错误; C.根据化合物c中含有不同环境的氢原子有7种分别为:,故C错误; D.化合物b、c中均含有官能团酯基,且c中含有肽键能与NaOH溶液发生水解反应,故D正确; 故答案选:D。 3.我国科学家提出用CO2置换可燃冰(mCH4·nH2O) 中CH4的设想,置换过程如图所示,下列说法正确的是 A. E代表CO2, F代表CH4 B. 笼状结构中水分子间主要靠氢键结合 C. CO2置换出CH4的过程是化学变化 D. CO2可置换可燃冰中所有的CH4分子 【答案】B 【解析】 【详解】A. CO2置换可燃冰(mCH4·nH2O) 中CH4,由题图可知E代表CH4, F代表CO2 - 20 - ,故A错误; B. 笼状结构中水分子间主要靠氢键结合,故B正确; C. 由图可知CO2置换出CH4的过程没有形成新的化学键,则CO2置换出CH4的过程是物理变化,故C错误; D. 由图可知小笼中的CH4 没有被置换出来,则CO2不可置换可燃冰中所有的CH4分子,故D错误; 故答案选:B。 4.双极电化学法(装置如图)是在传统电解装置中放置了导电性电极BPE,通电时,BPE两端界面产生电势差,生成梯度合金。下列有关说法错误的是 A. m为电源负极 B. BPE的b端比a端的电势高 C. BPE的a端发生的反应为: 2H2O+2e-=H2↑+2OH- D. BPE的b端到中心的不同位置,能形成组成不同的铜镍合金 【答案】C 【解析】 【分析】 由电解装置图可知,n极水发生氧化反应生成氧气,则n极为正极,电极反应为:,则溶液中靠着正极的b端电势高于靠近负极的a端,则b端得到电子发生还原反应,电极反应为:,a端失去电子发生氧化反应,电极反应为:,以此分析。 【详解】A. 由电解装置图可知,n极水发生氧化反应生成氧气,则n极为正极,则m为电源负极,故A正确; B. 溶液中靠着正极b端电势高于靠近负极的a端,故B正确; - 20 - C. BPE的a端失去电子发生氧化反应,电极反应为:,故C错误; D. BPE的b端到中心的不同位置,由于电势不同,电极反应:中x不同,能形成组成不同的铜镍合金,故D正确; 故答案选:C。 5.利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法错误的是 A. 常温下,绿原酸易溶于水 B. 浸膏的主要成分是绿原酸 C. 减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质 D. 绿原酸粗产品可以通过重结晶进一步提纯 【答案】A 【解析】 【分析】 由流程图可知,绿原酸可通过加入乙酸乙酯萃取分液,有机层中含有绿原酸,再通过减压蒸馏分离乙酸乙酯和绿原酸,在通过温水洗涤浸膏,冷却过滤后得到绿原酸粗产品,以此分析。 【详解】A. 由流程图可知,绿原酸易溶于乙酸乙酯,难溶于水,故A错误; B. 浸膏的主要成分是绿原酸固体,故B正确; C. 减压蒸馏的目的是降低蒸馏温度,以免绿原酸分解或变质,故C正确; D. 绿原酸粗产品可以通过重结晶进一步提纯,故D正确; 故答案选:A。 6.“医用酒精”和“84消毒液”混合,产生ZQ、X2W4Y、XW3Q等多种物质,已知W、X、Y、Z、Q为原子序数依次增大的短周期主族元素。下列叙述错误的是 A. 简单气态氢化物热稳定性: Y>X B. W与Z可形成离子化合物ZW C. 简单离子半径: Q->Y2->Z+ D. 常温下,XW3Q为气态,且X、W、Q均满足8电子稳定结构 - 20 - 【答案】D 【解析】 【分析】 “医用酒精”主要成分为CH3CH2OH, “84消毒液”主要成分为NaClO,则反应后必定含有元素C、H、O、Na、Cl,已知W、X、Y、Z、Q为原子序数依次增大的短周期主族元素,则W为H,X为C,Y为O,Z为Na,Q为Cl,以此分析。 【详解】根据上述分析可知, A. 由于O的非金属性强于C,则简单气态氢化物热稳定性:H2O>CH4,故A正确; B. W与Z可形成离子化合物NaH,故B正确; C. 简单离子半径: Cl->O2->Na+,故C正确; D. 常温下,CH3Cl为气态,但H原子不满足8电子稳定结构,故D错误; 故答案选:D。 【点睛】根据反应前后元素守恒分析W、X、Y、Z、Q对应元素。 7.向废水中加入硫化物可以依次获得CuS、 ZnS纳米粒子。常温下,H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是 A. Ksp(CuS)的数量级为10-37 B. a点对应的CuS溶液为不饱和溶液 C. 向p点的溶液中加入少量NaS固体,溶液组成由p向q方向移动 D. H2S+Zn2+ZnS + 2H+平衡常數很大,反应趋于完全 - 20 - 【答案】D 【解析】 【分析】 A. 根据图中数据进行计算; B. 计算a点的离子浓度积与比较,若离子浓度积小于,则溶液为不饱和溶液,若离子浓度积等于,则溶液为饱和溶液; C. 向p点的溶液中加入少量NaS固体,溶液中c(S2-)增大,则c(Cu2+)减小; D. H2S+Zn2+ZnS + 2H+平衡常數带入计算即可。 【详解】A. 由图中数据可知当c(Cu2+)=10-18mol/L时,c(S2-)=10-18.3mol/L,则数量级为10-37,故A正确; B. 计算a点的离子浓度积为<则溶液为不饱和溶液,故B正确; C. 向p点的溶液中加入少量NaS固体,溶液中c(S2-)增大,则c(Cu2+)减小,故C正确; D. H2S+Zn2+ZnS + 2H+平衡常數平衡常数不是很大,反应不趋于完全,故D错误; 故答案选:D。 【点睛】H2S+Zn2+ZnS + 2H+平衡常數。 8.DCCNa (二氯异氰尿酸钠)固体是一种高效、安全的消毒剂。20℃以上易溶于水。(CNO)3H3 (氰尿酸)为三元弱酸。 I.制备DCCA (二氯异氰尿酸)装置如图。主要反应有: 碱溶 (CNO)3H3+ 2NaOH=(CNO)3Na2H + 2H2O △H<0 氯化 (CNO)3Na2H +2Cl2=(CNO)3Cl2H + 2NaCl ∆ H<0 - 20 - 回答下列问题: (1)装置C中溶液是______________,作用为______________。 (2)装置A中反应的离子方程式为_______________。 (3)装置B用冰水浴的原因是__________, 碱溶时若氢氧化钠过量,(CNO)3Na2H中可能混有的杂质是__________。 Ⅱ.制备DCCNa (4)步骤II中过滤洗盐”洗去的盐是__________________。 (5)“中和”反应的化学方程式为_________________。 (6)氧元素含量的测定:称取0. 1000 g DCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用淀粉作指示剂, 用01000 mol·L-1Na2S2O3标准溶液滴定生成的碘,消耗VmL.已知: I2+2S2O32-=2I-+S4O62-,样品中氯元素的质量分数=__________% 【答案】 (1). 氢氧化钠溶液 (2). 吸收多余氯气,防止污染空气 (3). (4). 该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低产品溶解度 (5). (CNO)3Na3 (6). NaCl (7). (8). 1.775V 【解析】 【分析】 - 20 - 由图中装置和实验药品可知,A装置为氯气发生装置,B装置发生氯化反应生成DCCA,C装置用于尾气处理,吸收多余的氯气。利用DCCA生产DCCNa先将B中产物主要成分为DCCA和NaCl的混合物进行过滤洗盐,得到DCCA,DCCA与氢氧化钠反应得到DCCNa,再经过冷却结晶,过滤干燥得到产品DCCNa,以此分析。 【详解】(1)由上述分析可知C装置用于尾气处理,吸收多余的氯气,防止污染空气,试剂为氢氧化钠溶液,故答案为:氢氧化钠溶液;吸收多余氯气,防止污染空气; (2)A装置为氯气发生装置离子反应为:,故答案为:; (3)由已知反应可知装置B中反应,该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低温度可降低产品溶解度;(CNO)3H3 (氰尿酸)为三元弱酸,则碱溶时若氢氧化钠过量,则会生成产物(CNO)3Na3,故答案为:该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低产品溶解度;(CNO)3Na3; (4)B中产物主要成分为DCCA和NaCl的混合物,则过滤洗盐洗去的盐是NaCl,故答案为:NaCl; (5)DCCA与氢氧化钠反应得到DCCNa化学方程式为:,故答案为:; (6)DCCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用Na2S2O3标准溶液滴定生成的碘,则关系式为: ,则氯原子的物质的量,则样品中氯元素的质量分数为,故答案为:1.775V。 【点睛】DCCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用Na2S2O3标准溶液滴定生成的碘,则关系式为:,依据关系式计算。 - 20 - 9.CoS2催化CO烟气脱硫具有广阔的工业化前景。回答下列问题: (1)已知: CoS2(s) +CO(g) CoS(s) +COS(g) ∆H1 2COS(g) +SO2(g) 3S(s) +2CO2(g) ∆H2 S(s) +CoS(S) CoS2 (s) △H3 则2CO(g)+ SO2(g)2CO2(g)+S(s) ∆H4=____。 (用∆H1、 ∆H2、∆H3表示) (2)在恒温、恒压的容器中模拟回收硫,加入SO2起始量均为1mol,测得CO2的平衡体积分数随CO和SO2的投料比变化如图: ①当投料比为2时,t min 时测得SO2转化率为50%,则用S的生成速率表示的反应速率v=______g·min-1。 ②当投料比为3时,CO2 的平衡体积分数对应的点是______________。 (3)向体积均为1L的恒温、恒客密团容器通入2 mol CO和| mol SO2。反应体系总压强随时间的变化如图: ①相对于I,II改变的外界条件是____________________。 ②SO2的平衡转化率为______,平衡常数Kp =________(用平衡分压代替平衡浓度计算)。 (4)利用电解法处理SO2尾气可制备保险粉 (Na2S2O4).电解装置如图,则a____ b (填“>” “=”或“<”),生成S2O42-的电极反应式为____________________。 - 20 - 【答案】 (1). (2). (3). C (4). 使用(或使用更高效)催化剂 (5). 75% (6). 0.675 (7). < (8). 【解析】 【分析】 (1)根据盖斯定律可知可得所求热化学方程式; (2)①利用三段法计算S的生成质量S的生成速率计算;②当投料比为3时,相当于在投料比为2达到平衡时充入1mol的CO,平衡正移,根据勒夏特列原理可知达到平衡时,CO2的体积分数小于投料比为2达到平衡时CO2的体积分数; (3)①由图像可知I,II,达到平衡时压强不变,则平衡不移动,II达到平衡时间变短,则II使用(或使用更高效)催化剂;②恒温、恒客密团容器中气体的压强与物质的量成正比,利用三段法计算SO2的平衡转化率,平衡常数,以此计算; (4)由电解装置图可知,SO2发生氧化反应生成H2SO4,为阳极,电极反应为:,HSO3-发生还原反应生成S2O42-,为阴极,电极反应为:,以此分析。 【详解】(1) 根据盖斯定律可知可得 - 20 - ,故答案为:; (2)①当投料比为2时,t min 时测得SO2转化率为50%,则有 S的生成速率 ;②当投料比为3时,相当于在投料比为2达到平衡时充入1mol的CO,平衡正移,根据勒夏特列原理可知达到平衡时,CO2的体积分数小于投料比为2达到平衡时CO2的体积分数,故答案为:;C; (3)①由图像可知I,II,达到平衡时压强不变,则平衡不移动,II达到平衡时间变短,则II使用(或使用更高效)催化剂;②恒温、恒客密团容器中气体的压强与物质的量成正比,设反应消耗SO2物质的量为xmol,则有 则x=0.75mol,SO2的平衡转化率为,则平衡时n(CO)=0.5mol,n(SO2)=0.25mol,n(CO2)=1.5mol,则平衡常数,故答案为:使用(或使用更高效)催化剂;75%;0.675; (4)由电解装置图可知,SO2发生氧化反应生成H2SO4,为阳极,电极反应为:,则硫酸浓度增大;HSO3-发生还原反应生成S2O42-,为阴极,电极反应为:,故答案为:<; - 20 - 。 【点睛】根据平衡常数定义可知,恒温、恒客密团容器中气体的压强与物质的量成正比,则各气体分压=各气体物质的量占比总压强。 10.Na5PW11O39Cu/T1O2膜可催化污染物的光降解,一种生产工艺流程如下,回答下列问题: (1)“溶解I”发生的离子反应方程式为______________,Na2WO4 (钨酸钠)在酸性条件下有较强的氧化性,该步骤不能用浓盐酸代替浓硝酸的原因是____________。 (2)“除杂”时用过量有机溶剂萃取溶液中的NO3-,再通过_________方法分离杂质。 (3)“溶解II”需要加入水、乙醇和稀硫酸。 ①加入乙醇的目的是_____________。 ②钛酸四丁酯水解产生TiO2和C4H9OH的化学方程式为_____。 ③溶液中Cu2+浓度为0.02 mol·L-1,需调节pH小于________。(已知Ksp[Cu(OH)2]=2×10-20) (4)培烧温度、Na5PW11O39Cu 用量对Na5PW11O39Cu/TiO2膜催化活性的影响随(时间)变化如图1、图2所示: 制备Na5PWl1O39Cu/TiO2膜的最佳条件为:培烧温度_____,Na5PW11O39Cu用量_______。 【答案】 (1). (2). WO42- - 20 - 具有强氧性,将盐酸氧化生成有毒气体氯气,污染环境 (3). 分液 (4). 增大钛酸四丁酯的溶解度 (5). (6). 5 (7). 100℃ (8). 3.0g 【解析】 【分析】 (1)浓硝酸和HPO42-和WO42-反应生成,以此写出化学方程式;Na2WO4 (钨酸钠)在酸性条件下有较强的氧化性,会和浓盐酸反应生成有毒气体氯气; (2)“除杂”时用过量有机溶剂萃取溶液中的NO3-,再通过分液方法分离杂质; (3)①“溶解II”需要加入水、乙醇和稀硫酸,加入乙醇的目的是增大钛酸四丁酯的溶解度; ②钛酸四丁酯水解产生TiO2和C4H9OH,利用原子守恒配平方程; ③利用计算OH-浓度,再利用水的离子积常数计算pH; (4)由图一可知温度为100℃时Na5PWl1O39Cu/TiO2膜活性最高;由图二可知当Na5PW11O39Cu用量为3.0g时Na5PWl1O39Cu/TiO2膜的活性最高。 【详解】(1)浓硝酸和HPO42-和WO42-反应生成,化学方程式为:;Na2WO4 (钨酸钠)在酸性条件下有较强的氧化性,会和浓盐酸反应生成有毒气体氯气,故答案为;WO42-具有强氧性,将盐酸氧化生成有毒气体氯气,污染环境; (2)“除杂”时用过量有机溶剂萃取溶液中的NO3-,再通过分液方法分离杂质,故答案为:分液; (3)①“溶解II”需要加入水、乙醇和稀硫酸,加入乙醇的目的是增大钛酸四丁酯的溶解度,故答案为:增大钛酸四丁酯的溶解度; ②钛酸四丁酯水解产生TiO2和C4H9OH,化学方程式为:,故答案为:; ③利用,则 - 20 - ,则;则,故答案为:5; (4)由图一可知温度为100℃时Na5PWl1O39Cu/TiO2膜的活性最高;由图二可知当Na5PW11O39Cu用量为3.0g时Na5PWl1O39Cu/TiO2膜的活性最高,故答案为:100℃;3.0g。 11.科学家预测21世纪中叶将进入“氢能经济”时代,下列物质都是具有广阔应用前景的储氢材料。回答下列问题: (1)Zr(锆)在元素周期表中位于第五周期,与钛同族,基态Zr的价层电子排布式为_______。 (2)亚氨基锂(Li2NH) 所含元素第一电离能最小的是____ ,电负性最大的是_____ (填元素符号)。 (3)咔唑()的沸点比芴()高的主要原因是________。 (4)①NH3BH3 (氨硼烷,熔点104℃)与乙烷互为等电子体。NH3BH3的晶体类型为____。其中B的杂化类型为____,可通过_________测定该分子的立体构型。 ②NH3BH3可通过环硼氨烷、CH4与H2O进行合成,键角: CH4______H2O (填“> "或“<"),原因是________。 (5)MgH2晶体属四方品系,结构如图,晶胞参数a =b= 450pm, c= 30lpm,原子坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。 ①Mg2+的半径为72pm,则H+的半径为______pm (列出计算表达式) ②用NA表示阿伏加德罗常数,MgH2晶体中氢的密度是标准状况下氢气密度的_____倍(列出计算表达式,氢气密度为0.089g·L-1)。 【答案】 (1). 4d25s2 (2). Li (3). N (4). 咔唑分子间存在氢键 (5). 分子晶体 (6). sp3 (7). 红外光谱 (8). > (9). CH4中无孤电子对,H2 - 20 - O中有两对孤电子对,孤电子对与σ键之间的排斥力大于σ 键之间的排斥力,使得CH4中的键角比H2O 中的键角大 (10). (11). 或 【解析】 【分析】 (1)Zr(锆)在元素周期表中位于第五周期,与钛同族,属于ⅣB族,则基态Zr的价层电子排布式为; (2)Li和H属于同主族,第一电离能由大变小,H>Li,电负性由小变大H查看更多
相关文章
- 当前文档收益归属上传用户