- 2021-07-08 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
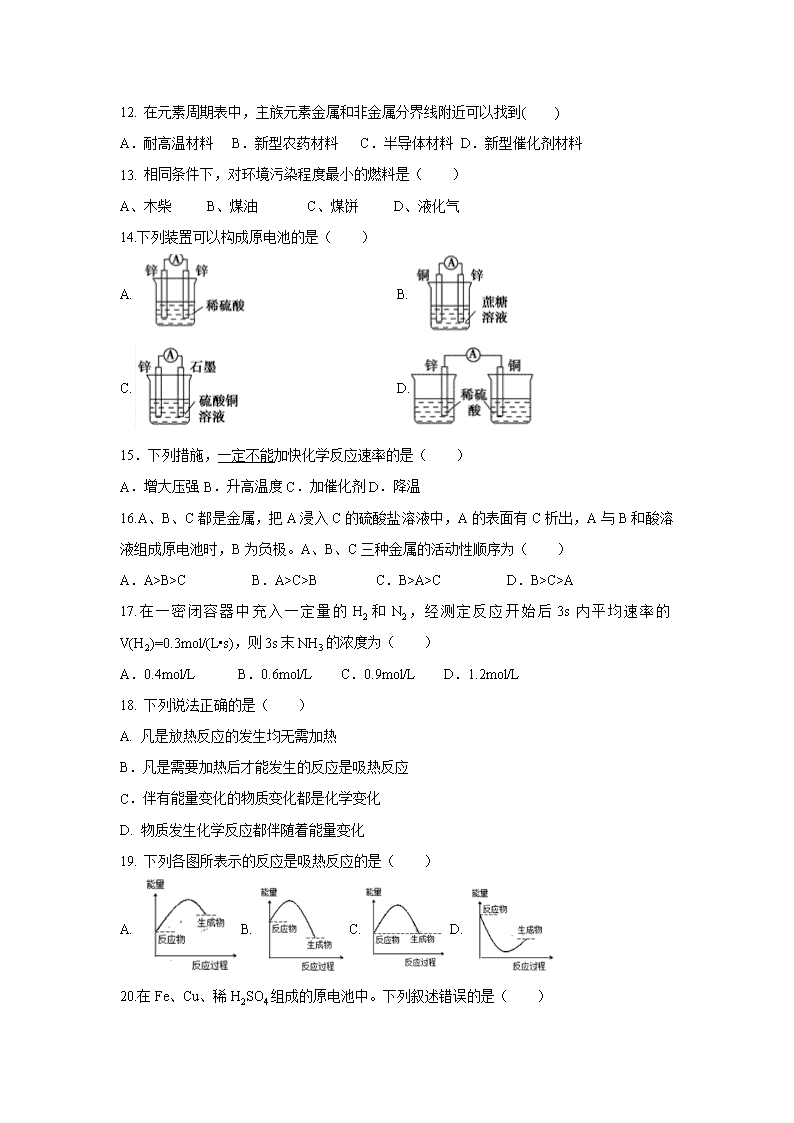
【化学】吉林省长春市第二十九中学2019-2020学年高一下学期期中考试(文)试卷
吉林省长春市第二十九中学2019-2020学年高一下学期期中考试(文)试卷 有关相对原子质量:N :14 H: 1 Na:23 Cl:35.5 S:32 O:16 一、选择题(每小题一个正确答案,共60分) 1.含有+7价元素的化合物是( ) A.KClO4 B.K2MnO4 C.KClO3 D.H3PO4 2. 下列几种酸中,酸性最弱的是( ) A.HClO4 B.HI C.H3PO4 D.H2CO3 3.下列元素中,原子半径最大的是( ) A.锂 B.钠 C.钾 D.铷 4. 下列各组物质中,属于同素异形体的是( ) A.H2O和D2O B.O2和O3 C.金刚石与Si D.冰和干冰 5.某元素最高价氧化物水化物化学式是H2XO3,则它的气态氢化物化学式为( ) A.HX B.H2X C.XH3 D.XH4 6.元素性质呈现周期性变化的基本原因是( ) A.元素的原子量逐渐增大 B.核外电子排布呈周期性变化 C.核电荷数逐渐增大 D.元素化合价呈周期性变化 7.放射性同位素钬可用于治疗肝癌。该原子的中子数是( ) A.67 B.99 C.166 D.233 8. 下列物质中,只有共价键的是( ) A. NaOH B. NaCl C. NH4Cl D. H2O 9.主族元素在周期表中的位置决定于该主族元素原子的( ) A.相对原子质量和核外电子数 B.电子层数与最外层电子数 C.相对原子质量和最外层电子数 D.电子层数与次外层电子数 10.N比F的原子半径( ) A.大 B.小 C.相等 D.不能确定 11.下列各组性质的比较中,不正确的是( ) A.碱 性:NaOH>Mg(OH)2 B.热稳定性:NH3>PH3 C.金属性:K>Na D.原子半径:Cl>S 12. 在元素周期表中,主族元素金属和非金属分界线附近可以找到( ) A.耐高温材料 B.新型农药材料 C.半导体材料 D.新型催化剂材料 13. 相同条件下,对环境污染程度最小的燃料是( ) A、木柴 B、煤油 C、煤饼 D、液化气 14.下列装置可以构成原电池的是( ) A. B. C. D. 15.下列措施,一定不能加快化学反应速率的是( ) A.增大压强B.升高温度C.加催化剂D.降温 16.A、B、C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为负极。A、B、C三种金属的活动性顺序为( ) A.A>B>C B.A>C>B C.B>A>C D.B>C>A 17.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内平均速率的V(H2)=0.3mol/(L•s),则3s末NH3的浓度为( ) A.0.4mol/L B.0.6mol/L C.0.9mol/L D.1.2mol/L 18. 下列说法正确的是( ) A. 凡是放热反应的发生均无需加热 B.凡是需要加热后才能发生的反应是吸热反应 C.伴有能量变化的物质变化都是化学变化 D. 物质发生化学反应都伴随着能量变化 19. 下列各图所表示的反应是吸热反应的是( ) A.B.C.D. 20.在Fe、Cu、稀H2SO4组成的原电池中。下列叙述错误的是( ) A.电子流从铁棒经导线流入铜棒 B.溶液逐步变为浅绿色 C.溶液的酸性减弱 D.气泡在铁片上产生 二.填空题(40分) 21.(22分) (1)写出下列物质的电子式: NaCl____________ HCl_____________ (2)第三周期元素中的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 ,呈两性的氢氧化物是 。半径最大 的原子是 ,氢化物最稳定的元素是 。 (3)硫元素位于元素周期表中______周期_______族,气态氢化物的化学式是 ____________,最高价氧化物对应水化物的化学式____ _ _ ___ 22.(6分)某原电池装置如图所示。其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是 。Cu电极上发生的反应属于______(填“氧化”或“还原”) 反应。 23(12分)下列变化属于 ①放热反应 ②吸热反应 A:分解反应 B:化合反应C:置换反应 (1)氯酸钾分解制氧气,既是 (填①或②)又是 。(填A或B或C,下同) (2)生石灰跟水反应生成熟石灰,既是 又是 。 (3)锌粒与稀硫酸的反应,既是 又是 。 【参考答案】 一.每题3分,共计60分 1——20 A D D B D B B D B A D C D C D C B D A D 21.(22分) (1) (2)HClO4 NaOH Al(OH)3 Na Cl (3)第三 ⅥA H2S H2SO4 22.(6分) 负 Zn-2e=Zn2+ 还原 23. (12分) (1) ② A; (2) ① B;(3) ① C 查看更多