2020届一轮复习人教版原子结构化学键学案
考点06 原子结构 化学键
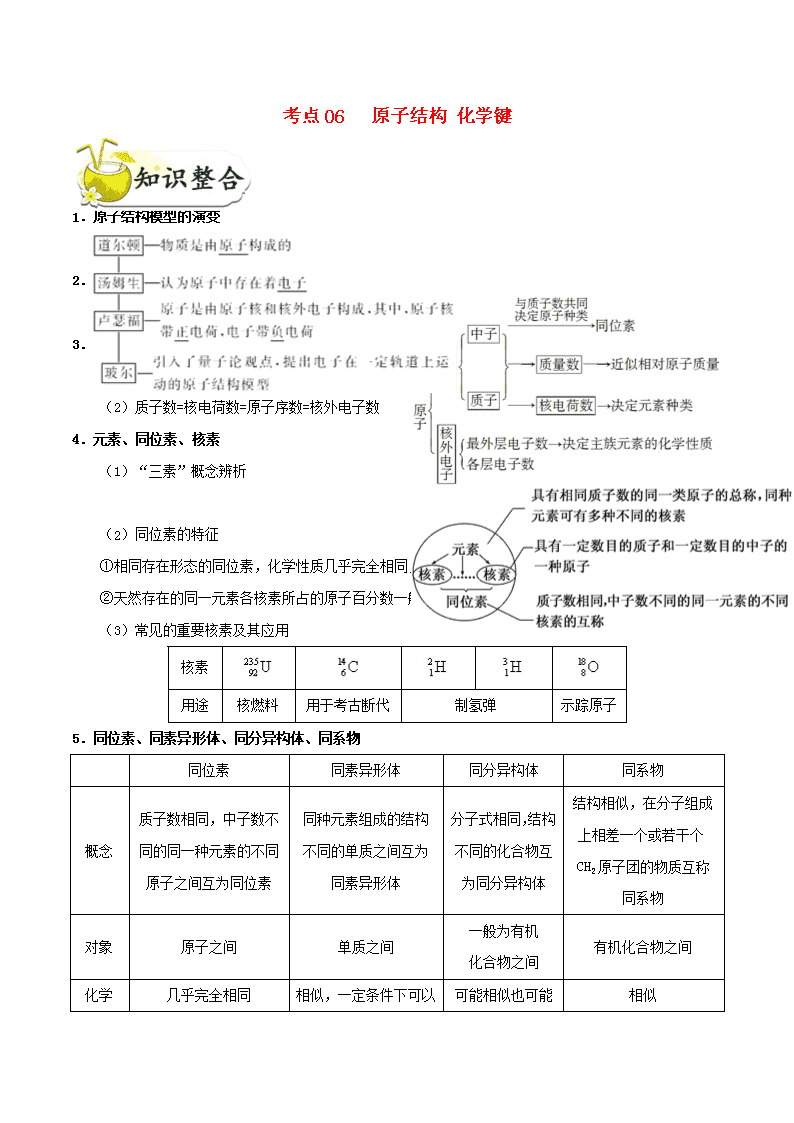
一、微粒的组成与结构
1.原子结构模型的演变
2.原子的构成
3.原子内的等量关系
(1)质量数(A)=质子数+中子数
(2)质子数=核电荷数=原子序数=核外电子数
4.元素、同位素、核素
(1)“三素”概念辨析
(2)同位素的特征
①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用
核素
用途
核燃料
用于考古断代
制氢弹
示踪原子
5.同位素、同素异形体、同分异构体、同系物
同位素
同素异形体
同分异构体
同系物
概念
质子数相同,中子数不同的同一种元素的不同原子之间互为同位素
同种元素组成的结构不同的单质之间互为同素异形体
分子式相同,结构不同的化合物互为同分异构体
结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物
对象
原子之间
单质之间
一般为有机
化合物之间
有机化合物之间
化学
几乎完全相同
相似
性质
相似,一定条件下可以相互转变
可能相似也可能不同
实例
金刚石与石墨、C60;
红磷与白磷
CH3COOH
与
HCOOCH3
甲烷、乙烷、丙烷;乙烯、丙烯;甲酸、乙酸
二、核外电子排布
1.核外电子排布规律
2.原子结构示意图
3.1~18号元素原子结构的特点归纳
(1)原子核中无中子的原子:H。
(2)最外层有1个电子的元素:H、Li、Na。
(3)最外层有2个电子的元素:Be、Mg、He。
(4)最外层电子数等于次外层电子数的元素:Be、Ar。
(5)最外层电子数是次外层电子数2倍的元素:C;最外层电子数是次外层3倍的元素:O;最外层电子数是次外层4倍的元素:Ne。
(6)电子层数与最外层电子数相等的元素:H、Be、Al。
(7)电子总数为最外层电子数2倍的元素:Be。
(8)次外层电子数是最外层电子数2倍的元素:Li、Si。
(9)内层电子总数是最外层电子数2倍的元素:Li、P。
(10)电子层数是最外层电子数2倍的元素:Li。
(11)最外层电子数是电子层数2倍的元素:He、C、S。
(12)最外层电子数是电子层数3倍的元素:O。
三、化学键
1.化学键
(1)定义:相邻原子间强烈的相互作用。
(2)分类
2.离子键
(1)概念:阴、阳离子之间的相互作用。
(2)成键粒子:离子。
(3)成键实质:静电作用。
(4)形成条件:通常是活泼金属元素与活泼非金属元素的原子相结合。
(5)表示方法:
①用电子式表示物质
②用电子式表示离子化合物的形成过程
3.共价键
(1)概念:原子间通过共用电子对形成的相互作用。
(2)成键粒子:原子。
(3)成键实质:共用电子对。
(4)形成条件:通常是非金属元素的原子相结合。
(5)分类:
形成原子种类
电子对偏向情况
非极性共价键
同种元素的原子
不偏向成键原子的任何一方
极性共价键
不同种元素的原子
偏向吸引电子能力强的一方
(6)表示方法:
①用电子式表示物质
②用结构式表示物质
③用电子式表示共价化合物的形成过程
4.离子键和共价键的比较
键型
离子键
共价键
非极性键
极性键
特点
阴、阳离子间的相互作用
共用电子对不发生偏移
共用电子对偏向吸引电子能力强的原子一方
成键
粒子
阴、阳离子
原子
成键
条件
活泼金属元素和活泼非金属元素
同种元素的原子
不同种元素的原子
存在
离子化合物
非金属单质、某些化合物
共价化合物、某些离子化合物
5.化学键与物质的类别
除稀有气体内部无化学键外,其他物质内部都存在化学键。化学键与物质的类别之间的关系可概括为:
(1)只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4等。
(2)只含有非极性共价键的物质是同种非金属元素形成的单质,如Cl2、P4、金刚石等。
(3)既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等。
(4)只含离子键的物质主要是由活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CaCl2、NaCl等。
(5)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
(6)仅由非金属元素形成的离子化合物,如NH4Cl、NH4NO3等。
(7)金属元素和非金属元素间可能存在共价键,如AlCl3等。
6.离子化合物和共价化合物的判断方法
四、分子间作用力
1.分子间作用力
(1)概念:分子间存在一种把分子聚集在一起的作用力,又称范德华力。
(2)主要特征
①分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力。
②只有分子间充分接近时才有分子间的相互作用力,如固体和液体物质中。
③分子间作用力的能量远远小于化学键。
④由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定。
(3)变化规律
一般来说,对于组成与结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。
例如,熔、沸点:I2>Br2>Cl2>F2。
2.氢键
(1)概念:像水分子间,一个水分子中的氢原子与另一个水分子中的氧原子间所形成的分子间作用力。
(2)形成条件:跟吸电子能力较强的原子(如:N、O、F等)成键的氢原子,与其他的吸电子能力较强的原子间易形成氢键,可表示如下:A—H……B(A、B一般为N、O、F等原子)。
(3)形成原因:在“A—H……B”中由于A原子吸电子能力较强,使H原子显正电性,同理,由于B原子吸电子能力较强,B原子显负电性,这样在分子间,氢原子与B原子间通过静电作用形成氢键。
(4)对物质性质的影响:分子间氢键会使物质的熔点和沸点升高,溶解性增强。
3.物质的变化与微粒之间的作用力的变化的关系
(1)化学变化时,既有化学键的断裂又有化学键的形成,有化学键断裂或形成的变化不一定是化学变化,物理变化时可能有化学键的断裂或形成。
(2)离子化合物溶于水或熔化后均电离出自由移动的阴、阳离子,离子键被破坏。
(3)有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等;有些共价化合物溶于水后,与水分子作用形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等;有些共价化合物溶于水后,其分子内的共价键无变化,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
(4)某些活泼的非金属单质溶于水能与水反应,分子内的共价键被破坏,如Cl2、F2等。
分子间作用力、共价键对物质性质影响比较
分子间作用力
共价键
对物质
性质
的影响
①影响物质的熔点、沸点、溶解度等物理性质;
②组成和结构相似的物质,随相对分子质量的增大,物质的熔、沸点升高。如熔、沸点CF4
H2S,HF>HCl,NH3>PH3
①影响分子的稳定性;
②共价键键能越大,分子稳定性越强
五、晶体类型与性质
1.几种常见的晶体模型
(1)离子晶体
在NaCl晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+。
(2)分子晶体
①干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有12个。
②冰的结构模型中,每个水分子与相邻的4个水分子以氢键相连接,含1 mol H2O的冰中,最多可形成2 mol“氢键”。
(3)原子晶体(金刚石和二氧化硅)
①金刚石晶体中,每个C与另外4个C形成共价键,C—C键之间的夹角是109°28′,最小的环是6元环。含有1 mol C的金刚石中,形成的共价键有2 mol。
②SiO2晶体中,每个Si原子与4个O成键,每个O原子与2个硅原子成键,最小的环是12元环,在“硅氧”四面体中,处于中心的是硅原子。
(4)足球烯的结构模型
C60分子结构模型
C60是由60个碳原子形成的封闭笼状分子,形似足球,分子内每个碳原子与其他3个碳原子形成共价键。
2.晶体类型及性质的比较
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
构成晶体的粒子
阳离子、阴离子
分子
原子
金属离子、自由电子
组成晶体粒子间相互作用
离子键
范德华力(有的存在氢键)
共价键
金属键
典型实例
NaCl
冰(H2O)、干冰(CO2)
金刚石、晶体硅、SiO2、SiC及Si3N4等大多数新型高温结构陶瓷
除汞外的金属及合金
熔、沸点
熔、沸点低
熔、沸点高
晶体的物理性质
熔点较高,沸点高
易导电、易导热,大多数具有较好的延展性,密度、硬度、熔、沸点等差别较大
导热性
不良
不良
不良
导电性
固态不导电,熔化或溶于水能导电
固体、熔融不导电,部分化合物溶于水能导电
不导电
机械加工性能
不良
不良
不良
硬度
略硬而脆
硬度低
高硬度
考向一 原子结构
典例1 两种元素原子X和Y,X原子的M层比Y原子的M层少3个电子,Y原子的L层电子数恰好是X原子L层电子数的两倍,则X、Y分别是
A.硅原子和钠原子 B.硼原子和氮原子
C.氮原子和碳原子 D.碳原子和铝原子
【解析】由于Y原子的M层电子比X原子的M层电子多3个电子,说明Y的M层电子数至少有3个,那么Y的L层必定有8个电子;Y原子的L层电子数恰好是X原子L层电子数的两倍,则X的L层只有4个电子,M层无电子。由此推出Y的核外电子总数为13,X的核外电子总数为6。所以X、Y的核电荷数分别是6和13,即为碳原子和铝原子。
【答案】D
1.下列说法正确的是
①1H、2H、3H为三种不同的核素 ②1H、2H、3H互为同位素 ③1H、2H、3H互为同素异形体 ④114号元素位于周期表第七周期ⅤA族 ⑤氢元素质量数为1 ⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置 ⑦互为同位素的原子性质相同
A.①②④⑥⑦ B.①②③⑤⑥
C.①②⑥ D.①②③⑥⑦
短周期元素原子核外电子排布的特征
Be
C
O←最外层电子数是次外层电子数的3倍
Ne←最外层电子数是次外层电子数的4倍
考向二 电子数相等的微粒的判断与应用
典例1 现有下列几组粒子:①N2、CO、C2H2;②NH、H3O+、OH-;③C、O、CN-;④PO、SO、ClO。对上述四组粒子归类正确的是
A.质子数相等、电子数和原子数不相等:①
B.质子数和电子数相等、原子数不相等:②
C.电子数相等、质子数和原子数不相等:③
D.原子数和电子数相等、质子数不相等:④
【解析】阳离子:电子总数=质子总数-所带的电荷总数;阴离子:电子总数=质子总数+所带的电荷总数。①N2、CO、C2H2的质子数和电子数都等于14,原子数不等;②NH、H3O+、OH-的原子数和质子数不等,电子数都为10;③C、O、CN-的原子数和电子数都相等,质子数不同;④P、S、Cl所含的电子数分别为15、16、17,酸根离子中所含氧原子数均相等,所带负电荷数依次为3、2、1,三种酸根离子所含的总电子数相等(18+32)、原子数都为5,但三种酸根离子的质子数不相等。
【答案】D
2.甲、乙、丙、丁4种化合物均含有2种或3种元素,分子中均含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙和甲中同种元素的质量分数相等,则乙中含有化合价为-1的元素
C.丙与氧气的摩尔质量相同,则丙一定仅由两种元素组成
D.丁中含有第2周期ⅣA族元素,则丁一定是甲烷的同系物
推断10e−和18e−微粒的思维模型
1.10电子微粒
2.18电子微粒
(1)
(2)“双九”微粒:—F、—OH、—NH2、—CH3的相互组合,如:F2、H2O2、N2H4、C2H6、CH3F、CH3OH、CH3NH2。
考向三 电子式的书写与正误判断
典例1 下列化学用语正确的是
A.H2S的电子式:
B.S2−的结构示意图:
C.CaO2的电子式:
D.CCl4的电子式:
【解析】H2S是共价化合物,电子式为,故A错误;S2−的原子核内有16个质子,核外有18个电子,结构示意图为,故B正确;过氧化钙是由离子键和非极性共价键形成的物质,电子式为,故C错误;在CCl4中Cl的最外层有8个电子,电子式为,故D错误。
【答案】B
3.(1)联氨(又称肼,N2H4,无色液体)分子的电子式为 ,其中氮的化合价为 。
(2)HClO的电子式为 。
(3)该气体(H2S)分子的电子式为 。
(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为 。
(5)H、C、N、O、Na、Al、S、Cl中任选元素组成一种四原子共价化合物,写出其电子式: 。
电子式书写常见的四大误区
考向四 化学键与物质类别、性质
典例1 下列有关说法正确的是
A.该组化合物中只含有共价键:H2O、NH4Cl、H2O2
B.非金属原子间以共价键结合的物质都是共价化合物
C.Na2O、NaOH和Na2SO4为离子化合物,HCl、NH3、NH4NO3、H2SO4为共价化合物
D.由不同种非金属原子间通过共用电子对形成的化合物是共价化合物
【解析】NH4Cl中既含有共价键,也含有离子键,A错;非金属原子以共价键结合形成的可能为共价化合物如HCl,也可能为单质,如H2、O2,B错;NH4NO3为离子化合物,C错;不同非金属原子间通过共用电子对形成的化合物是共价化合物,D对。
【答案】D
4.下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是
A.氯气 二氧化碳 氢氧化钠
B.氯化钠 过氧化氢 氯化铵
C.氯化钠 过氧化钠 氯化铵
D.氯化钠 氦气 氢氧化钠
考向五 化学键与分子间作用力、氢键
典例1 下列解释正确的是
A.H2O很稳定,是因为水分子之间存在氢键
B.HF的熔、沸点在同族元素的氢化物中出现反常,是因为HF分子中有氢键
C.卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大
D.氨气极易溶于水,与氢键没有关系
【解析】水稳定是因为水分子中的氢氧共价键稳定,与氢键无关,故A错误;HF分子间存在氢键,HF分子内没有氢键,故B错误;卤素单质的熔、沸点与分子间作用力有关,相对分子质量越大,分子间作用力越大,所以卤素单质从上到下熔、沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大,故C正确;氨气与水分子之间能形成氢键,使氨气溶解度增大,所以氨气极易溶于水,与氢键有关系,故D错误。
【答案】C
5.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力
B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
化学键、分子间作用力和氢键的对比
相互作用
化学键
分子间作用力
氢键
存在范围
分子内相邻原子(离子)之间
分子之间
含H—F、O—H、
N—H键的分子之间
作用力
比较
强
很弱
比化学键弱,
比分子间作用力强
影响范围
物质的物理性质及化学性质
物质的物理性质
物质的物理性质
对物质性
质的影响
①离子键:成键离子半径越小、离子所带电荷越多、离子键越强,离子化合物的熔、沸点越高;
②
①影响物质的熔沸点、溶解度等物理性质;
②
分子间氢键的存在使物质的熔、沸点升高,在水中的溶解度增大,如熔、沸点:H2O>H2S,HF>HCl;乙醇与水混溶
共价键:原子半径越小,共用电子对越多,共价键越强,单质或化合物的稳定性越强
组成和结构相似的物质,随着相对分子质量的增大,物质的熔、沸点逐渐升高
考向六 晶体类型与性质
典例1 下列关于二氧化硅晶体的描述错误的是
A.分子式为SiO2
B.熔化时共价键断裂
C.属于酸性氧化物
D.1 mol SiO2中含有4 mol Si—O键
【解析】A.二氧化硅晶体是由硅原子和氧原子构成的原子晶体,不含分子,因此没有分子式,故A错误;B.二氧化硅是原子晶体,熔化时破坏共价键Si—O键,故B正确;C.二氧化硅能与强碱溶液反应生成盐和水,属于典型的酸性氧化物,故C正确;D.在二氧化硅晶体中,每个硅原子形成四条Si—O键,1 mol SiO2中含有4 mol Si—O键,故D正确。
【答案】A
6.下列说法正确的是
A.氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键
B.石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向
C.下列物质的熔沸点由大到小排列:晶体硅>碳化硅>金刚石
D.黄色晶体碳化铝,熔点2 200℃,熔融态不导电,是原子晶体
练后总结
1.离子晶体不一定含有金属阳离子,如NH4Cl晶体中的阳离子为NH;含有阳离子的晶体不一定是离子晶体,如金属晶体中就含有金属阳离子。
2.具有金属光泽且能导电的单质不一定是金属,如石墨具有金属光泽且能导电,却是非金属单质。
1.下列结构示意图所代表的微粒中,化合价为-1价的是
2.下列化学用语表示不正确的是
A.S2-的结构示意图:
B.乙烯的比例模型:
C.乙醛的结构简式:CH3COH
D.含中子数为10的氧元素的一种核素O
3.I是常规核裂变产物之一,可以通过测定大气或水中I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关I的叙述中错误的是
A.I的化学性质与I相同
B.I的原子序数为53
C.I的原子核外电子数为78
D.I的原子核内中子数多于质子数
4.下列各组中两种微粒所含电子数不相等的是
A.H3O+和OH- B.CO和N2
C.HNO2和NO D.CH和NH
5.下列关于化学键及晶体的说法中,正确的是
A.分子晶体中一定含有共价键,离子晶体中可能含有共价键
B.原子或离子之间强烈的相互吸引作用叫做化学键
C.金刚石、石墨、足球烯互为同素异形体,但晶体类型不同
D.HCl溶于水能电离出氢离子和氯离子,故HCl是离子化合物
6.下列关于物质结构和化学用语的说法正确的是
A.78 g Na2O2晶体中所含阴、阳离子个数为4NA
B.1个乙醇分子中存在8对共用电子对
C.NaOH和Na2O中所含的化学键类型完全相同
D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
7.有关物质结构的说法正确的是
A. 有强共价键存在的物质熔沸点一定很高
B. 液氯与水反应破坏了分子间作用力和共价键
C. 离子化合物中一定含有离子键、一定不含共价键
D. 晶体NH4Cl和Na2O中的化学键类型完全相同
8.下列说法正确的是
A.氢氧化钠是离子化合物,该物质中只存在离子键
B.干冰在升华的过程中,只需要克服分子间作用力
C.12C与 13C由于核外电子排布不同,所以属于同位素
D.在 N2、CO2 和 SiO2 三种物质中,都存在共价键,它们都是由分子构成的物质
9.已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-具有相同的电子层结构,则下列说法正确的是
A.原子序数:a>b>c>d
B.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-
C.离子氧化性:A(n+1)+>Bn+ 离子还原性:C(n+1)->Dn-
D.C最高价氧化物对应的水化物的酸性比D的强
10.在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是
A.2Na +2H2O===2NaOH+H2↑
B.SO2+2H2S===3S↓+2H2O
C.Mg3N2+6H2O===3Mg(OH)2+2NH3↑
D.AgNO3+NaCl===AgCl↓+NaNO3
11.现有部分1~18号元素的性质或原子结构如下表:
元素编号
元素性质或原子结构
T
单质通常呈固态,能形成一种大气污染物,且是酸雨的“祸首”
X
最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
元素最高正价是+7价
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____________。
(2)分别写出X2H6、X2H4、X2H2的结构式________、________、__________。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式________________。
(4)Y2H4是一种可燃性的液体,其燃烧产物之一是大气中的主要成分。3.20 g Y2H4在氧气中完全燃烧放出热量62.4 kJ(25 ℃),请写出Y2H4完全燃烧的热化学反应方程式______________________。
(5)元素Z与元素T相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是________________________;
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(6)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是____________,理由是_____________________________。
12.(1)下列是中学化学中熟悉的物质:O2 金刚石 NaBr H2SO4 Na2CO3 Na2S NaHSO4,回答下列问题:
这些物质中,只含共价键的是________________;只含离子键的是________________;既含离子键又含共价键的是________________。
(2)C60、金刚石和石墨的结构模型如下图所示的(a)、(b)、(c)所示(石墨仅表示出其中的一层结构):
①C60、金刚石和石墨三者的关系是互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
②固态时,C60属于________晶体(填“离子”“原子”或“分子”),C60分子中含有双键的数目是________。
③硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是____________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子的数目是________。
④石墨层状结构中,平均每个正六边形占有的碳原子数是________。
浙江真题题组
1.[2019·4月浙江选考]下列表示不正确的是
A.次氯酸的电子式 B.丁烷的球棍模型
C.乙烯的结构简式CH2=CH2 D.原子核内有8个中子的碳原子146C
2.[2019·4月浙江选考]下列说法正确的是
A.18O2和16O2互为同位素
B.正己烷和2,2−二甲基丙烷互为同系物
C.C60和C70是具有相同质子数的不同核素
D.H2NCH2COOCH3和CH3CH2NO2是同分异构体
3.[2019·4月浙江选考]下列说法不正确的是
A.纯碱和烧碱熔化时克服的化学键类型相同
B.加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
C.CO2溶于水和干冰升华都只有分子间作用力改变
D.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
4.[2018·11月浙江选考]下列表示不正确的是
A.Na+ 结构示意图 B.乙烷的比例模型
C.乙醛的结构简式CH3CHO D.氯化钙的电子式
5.[2018·11月浙江选考]下列说法正确的是
A.CaO与水反应过程中,有共价键的断裂和形成
B.H2O的热稳定性比H2S强,是由于H2O的分子间作用力较大
C.KCl、HCl、KOH的水溶液都能导电,所以它们都属于离子化合物
D.葡萄糖、二氧化碳和足球烯(C60)都是共价化合物,它们的晶体都属于分子晶体
6.[2018·4月浙江选考]下列表示正确的是
A.硫原子结构示意图 B.乙炔的结构简式CHCH
C.乙烯的球棍模型 D.NaCl的电子式
7.[2018·4月浙江选考]下列说法正确的是
A.CaCl2中既有离子键又有共价键,所以CaCl2属于离子化合物
B.H2O汽化成水蒸气、分解为H2和O2,都需要破坏共价键
C.C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点不同
D.水晶和干冰都是共价化合物,均属于原子晶体
8.[2017·11月浙江选考]下列表示不正确的是
A.氯原子的结构示意图 B.二氧化碳的结构式:O=C=O
C.CH4的球棍模型 D.乙醛的官能团 —CHO
9.[2017·11月浙江选考]下列说法不正确的是
A. Mg2+和S2―的最外层电子都形成了8个电子的稳定结构
B. 石英和金刚石都是原子间通过共价键结合形成的原子晶体
C. 浓H2SO4和H2O混合时放出热量与微粒之间的作用力有关
D. H2O2易分解是因为H2O2分子间作用力弱
10.[2017·4月浙江选考]下列表示不正确的是
A.CO2的电子式
B.Cl2的结构式:Cl—Cl
C.CH4的球棍模型
D.Cl-的结构示意图
11.[2017·4月浙江选考]下列说法正确的是
A.金刚石和石墨互为同素异形体,熔点和硬度都很高
B.氕、氘、氚是氢元素的三种核素,质子数都为1
C.乙醇和二甲醚(CH3—O—CH3)互为同系物
D.C4H10的一氯取代物只有一种
12.[2017·4月浙江选考]下列说法正确的是
A.干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同
B.化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键
C.CH4和CCl4中,每个原子的最外层都具有8电子稳定结构
D.NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响
全国真题题组
1.[2019江苏] 反应NH4Cl+NaNO2NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A.中子数为18的氯原子:
B.N2的结构式:N=N
C.Na+的结构示意图:
D.H2O的电子式:
2.[2018江苏]用化学用语表示 NH3+ HClNH4Cl中的相关微粒,其中正确的是
A.中子数为8 的氮原子: B.HCl 的电子式:
C.NH3的结构式: D.Cl−的结构示意图:
3.[2018北京]下列化学用语对事实的表述不正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OHC17H35COOC2H5+H218O
B.常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O+OH−
C.由Na和C1形成离子键的过程:
D.电解精炼铜的阴极反应:Cu2+ +2e−Cu
4.[2018新课标Ⅲ]下列叙述正确的是
A.24 g 镁与27 g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol重水与1 mol水中,中子数比为2∶1
D.1 mol乙烷和1 mol乙烯中,化学键数相同
5.[2017北京]2016年IUPAC命名117号元素为Ts(中文名“”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素 B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts核素符号是
6.[2017江苏]下列有关化学用语表示正确的是
A.质量数为31的磷原子:
B.氟原子的结构示意图:
C.CaCl2的电子式:
D.明矾的化学式:Al2(SO4)3
7.[2016上海]下列各组物质的熔点均与所含化学键的键能有关的是
A.CaO与CO2 B.NaCl与HCl C.SiC与SiO2 D.Cl2与I2
变式拓展
1.【答案】C
【解析】1H、2H、3H,质子数均为1,中子数分别为0、1、2,是氢元素的三种不同的核素,故①正确;1H、2H、3H是氢元素的三种不同的核素,互为同位素,故②正确;1H、2H、3H是三种不同的核素,不是单质,因此不是同素异形体,故③错误;114号元素位于周期表第七周期ⅣA族,故④错误;质量数是指某种原子的质子数与中子数之和,对元素无意义,⑤错误;同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置,故⑥正确;互为同位素的原子化学性质相同,物理性质不同,故⑦错误。
2.【答案】B
【解析】A.甲是18电子的氢化物,且其水溶液为二元弱酸,不难得出甲为H2S,某钠盐溶液若为NaHS溶液,其中含有HS-、OH-,但NaHS既能与盐酸等反应生成H2S,也能与NaOH反应生成Na2S,故A错误;B.H2S中元素的质量比为1∶16,H2O2分子中元素的质量比也为1∶16,H2O2中氧元素的价态为一1价,故B正确;C.氧气的摩尔质量为32 g/mol,丙的摩尔质量也为32 g/mol,且含有18电子,CH3OH符合,含有三种元素,故C错误;D.第二周期ⅣA族元素为C,如CH3OH符合,但CH3OH不是CH4的同系物,故D错误。
3.【答案】(1) −2
(2)
(3)
(4)
(5)(或等,合理均可)
【解析】(1)N2H4的电子式可结合NH3得出正答。
(2)HClO为共价化合物,分子中含有1个O—Cl键和1个 H—O键,其电子式为。
(3)H2S为共价化合物,其电子式为。
(4)NaBH4为离子化合物,的电子式与类似。
(5)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为等。
4.【答案】B
【解析】Cl2只含有共价键,A错;NaCl只含有离子键,H2O2只含有共价键,NH4Cl中既含有离子键,又含有共价键,B对;Na2O2既含有离子键又含有共价键,C错;氦气中没有共价键,D错。
5.【答案】B
【解析】石蜡属于有机物,由分子构成,故题干中前两个变化破坏的是范德华力,而第三个变化是石蜡中烃的分解,被破坏的是共价键。
6.【答案】D
【解析】A.氢键属于分子间作用力,不是化学键,故A错误;B.石墨晶体中含有层状结构,可从石墨材料中剥离出的单层碳原子面材料(石墨烯),C60、金刚石等不含有层状结构,不能得到单层碳原子面材料,故B错误;C.晶体硅、碳化硅、金刚石都是原子晶体,硅原子半径大于碳原子,键长逐渐减小,键能逐渐增大,熔沸点逐渐升高,故C错误;D.黄色晶体碳化铝,熔点2 200 ℃,熔融态不导电,满足原子晶体的特征,故D正确。
考点冲关
1.【答案】D
【解析】A项是原子,显0价,错误;B项显+2价,错误;C项显+1价,错误;D项显-1价,正确;故选D。
2.【答案】C
【解析】A.S2-的最外层达到8电子稳定结构,其离子结构示意图为:,故A正确;B.乙烯分子中含有1个碳碳双键,碳原子的相对体积较大,其比例模型为:,故B正确;C.乙醛分子中含有1个醛基,其正确的结构简式为:CH3CHO,故C错误;D.含中子数为10的氧元素的质量数=10+8=18,该核素可以表示为:O,故D正确。
3.【答案】C
【解析】同位素化学性质相同,A正确;I的原子序数为53,核外电子数为53,B正确,C错误;D选项考查中子数的计算,I的中子数为78,多于质子数,D正确。
4.【答案】D
【解析】本题考查微粒中电子数目的计算。中性微粒:核外电子数等于核内质子数;阳离子:电子数等于质子数减所带的电荷数;阴离子:电子数等于质子数加所带的电荷数。CH中的电子数为8,NH
中电子数为10,二者不相等。
5.【答案】C
【解析】分子晶体中不一定含有共价键,如稀有气体,稀有气体是单原子组成的分子,离子晶体中可能含有共价键,一定含有离子键,如氢氧化钠,故A错误;原子或离子之间的强烈的相互作用称为化学键,相互作用包括引力和斥力,故B错误;金刚石、石墨、足球烯都是由碳原子组成的单质,结构不同,因此它们属于同素异形体,金刚石是原子晶体,石墨是混合晶体,足球烯是分子晶体,故C正确;HCl属于共价化合物,故D错误。
6.【答案】B
【解析】A项,1 mol Na2O2中含有3 mol离子,即2 mol Na+和1 mol O,A错;B项,1分子CH3CH2OH中有8个共价键,即存在8对共用电子对,B正确;C项NaOH中含离子键和极性共价键,Na2O只含离子键,C项错;D项,PCl3分子中,每个原子都达到了8电子稳定结构,而BCl3分子中,硼原子只满足6电子结构,D错。
7.【答案】B
【解析】有较强共价键存在的物质不一定熔沸点很高,如氟气等,熔化时只需破坏分子间作用力,熔沸点低,故A错误;B.液氯溶于水发生化学反应,有共价键的断裂和形成,同时也破坏了分子间作用力,故B正确;C.离子化合物中一定含有离子键,可能存在非极性共价键,如 Na2O2,故C错误;D.晶体NH4Cl中含有离子键和共价键,而Na2O中只存在离子键,故D错误。
8.【答案】B
【解析】A.氢氧化钠是离子化合物,该物质中既存在离子键,又存在共价键,故A错误;B.干冰在升华的过程中,只需要克服分子间作用力,故B正确;C.12C与 13C的质子数相同,但中子数不同,二者属于同位素但核外电子排布相同,故C错误;D.在 N2、CO2 和 SiO2 三种物质中,都存在共价键,N2和CO2 是由分子构成的物质,而SiO2是原子构成的物质,故D错误;答案为B。
9.【答案】C
【解析】A.aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则有:a-n-1=b-n=c+n+1=d+n,则有A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,故A错误;B.具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径大小为:C(n+1)->Dn->Bn+>A(n+1)+,故B错误;C.金属性越强,对应离子的氧化性越弱,非金属性越强,对应离子的还原性越弱,则离子还原性为:C(n+1)->Dn-,离子氧化性为:Bn+<A(n+1)+,故C正确;D.非金属性:D>C,D最高价氧化物的水化物对应的酸性比C的强,故D错误。
10.【答案】C
【解析】A项,2Na+2H2O===2NaOH+H2↑,反应中只断裂了共价键和金属键,A错误;B项,SO2+2H2S===3S↓+2H2O,反应中断裂了共价键,也只形成了共价键,B错误;C项,Mg3N2+6H2O===3Mg(OH)2+2NH3↑,反应中既断裂了离子键又断裂了共价键,同时有离子键和共价键形成,C正确;D项,反应中只断裂和形成了离子键,D错误。
11.【答案】(1)C
(2)H—C≡C—H
(3)
(4)N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-624 kJ·mol-1
(5)Cl b
(6)H2CO3 弱酸
【解析】(1)酸雨的“祸首”是二氧化硫,故T元素是S;X最外层电子数是次外层的两倍,因此X次外层为2个电子,最外层为4个电子,是碳元素;能用于测定文物年代的是具有放射性的C;(2)C2H6的结构式为,C2H4的结构式为,C2H2的结构式为H—C≡C—H;Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N,形成的离子为NH,其电子式为;Y2H4为N2H4,根据题意可写出热化学方程式为:N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。元素Z最高正价是+7价,因此Z是Cl,非金属性Cl>S。非金属性强弱可通过气态氢化物的稳定性及最高价氧化物水化物的酸性比较得出。T、X、Y、Z四种元素的最高价氧化物的水化物分别为H2CO3、H2SO4、HNO3、HClO4,除了碳酸是弱酸,其余均为强酸。
12.【答案】(1)O2、金刚石、H2SO4 NaBr、Na2S Na2CO3、NaHSO4
(2)①B ②分子 30 ③2 6 ④2
【解析】(1)Na2CO3、NaHSO4这一类物质,酸根离子内含共价键,酸根离子与金属离子(或NH)之间存在离子键;
(2)①三者的关系为同素异形体,由于C60具有确定的分子组成,故固态时是分子晶体;②C60中每个碳原子与周围3个碳原子相连,故必有1个双键和2个单键,则分子中共有30个双键;③晶体硅中每个硅原子与周围4个硅原子形成共价键,则1 mol晶体硅含2 mol Si—Si键;④石墨的层状结构中,每个碳原子被3个六边形所共用,故每个六边形实际占有的碳原子数为2。
直通高考
浙江真题题组
1.【答案】A
【解析】A.次氯酸中Cl最外层为7个电子,为达到8电子稳定结构,需要拿出一个电子与其他原子形成一个共用电子对,O原子最外层为6个电子,为达到8电子稳定结构,需要拿出两个电子与其他原子形成两对共用电子对,因而次氯酸的电子式为,A项错误。B、C、D等3个选项均正确。故答案选A。
2.【答案】B
【解析】A.18O2和16O2是指相对分子质量不同的分子,而同位素指具有相同质子数,但中子数不同的元素互称同位素,A项错误;
B.正己烷的分子式C6H14,2,2−二甲基丙烷即新戊烷分子式是C5H12,两者同属于烷烃,且分子式差一个CH2,属于同系物,B项正确;
C.核素表示具有一定的质子数和中子数的原子,C60和C70是由一定数目的碳原子形成的分子,显然,C项错误;
D.H2NCH2COOCH3和CH3CH2NO2是分子式分别为C3H7O2N和C2H5O2N,分子式不同,显然不是同分异构体,D项错误。故答案选B。
3.【答案】C
【解析】A.烧碱和纯碱均属于离子化合物,熔化时须克服离子键,A项正确;B.加热蒸发氯化钾水溶液,液态水变为气态水,水分子之间的分子间作用力被破坏,B项正确;C.CO2溶于水发生反应:CO2+H2O⇌H2CO3,这里有化学键的断裂和生成,C项错误;D.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,D项正确。故答案选C。
4.【答案】B
【解析】A.Na+ 结构示意图为,选项A正确;B.乙烷的比例模型为,为乙烷的球棍模型,选项B不正确;C.乙醛的结构简式为CH3CHO,选项C正确;D.氯化钙的电子式为,选项D正确。答案选B。
【点睛】本题主要考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
5.【答案】A
【解析】A、氧化钙与水化合过程中水中的共价键会断裂,并会形成氢氧根离子,选项A正确;B、热稳定性与共价键即非金属性有关,氧元素的非金属性大于硫元素,选项B不正确;C、HCI属于共价化合物,选项C不正确;D、足球烯(C60)并非共价化合物,选项D不正确。答案选A。
6.【答案】C
【解析】A、硫原子的核外有16个电子,故硫原子的结构示意图为,A错误;B、炔烃的结构简式中碳碳三键不能省略,故乙炔的结构简式为CH≡CH,B错误;C、乙烯中碳原子之间以双键结合,每个碳原子上连2个H原子,故其球棍模型为,C正确;D、氯化钠是离子化合物,由钠离子和氯离子构成,故氯化钠的电子式为,D错误。答案选C。
7.【答案】C
【解析】分析:A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,非金属元素之间易形成共价键;
B.分子晶体汽化时破坏分子间作用力,分解破坏共价键;
C.结构不同的分子分子间作用力不同,分子间作用力不同的分子沸点不同;
D.相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体,常见的原子晶体是周期表中第ⅣA族元素的一些单质和某些化合物,例如金刚石、硅晶体、SiO2、SiC等。
详解:A.CaCl2含有离子键无共价键,为离子化合物,A错误;
B.H2O分子之间存在分子间作用力,汽化成水蒸气,破坏分子间作用力,H2O分解为H2和O2,需要破坏共价键H-O键,B错误;
C.丁烷有CH3CH2CH2CH3、CH3CH(CH3)2两种同分异构体,前者为正丁烷、后者为异丁烷,结构不同,分子间作用力大小不同,因而沸点不同,C正确;
D.水晶为二氧化硅,属于原子晶体,干冰为二氧化碳的固态形式,属于分子晶体,D错误;答案选C。
8.【答案】A
【解析】A. 氯是17号元素,最外层有7个电子,原子结构示意图为,故A错误;B. 二氧化碳是直线分子,结构式:O=C=O,故B正确;C. 碳原子半径比氢原子大,CH4是正四面体结构,球棍模型为,故C正确;D. 乙醛的官能团为醛基,结构简式为 –CHO,故D正确;故选A。
9.【答案】D
【解析】A. Mg2+和S2―分别是10电子和18电子微粒,其最外层电子都形成了8个电子的稳定结构,A正确;B. 原子间通过共价键形成的空间网状结构的晶体是原子晶体,石英和金刚石都是原子间通过共价键结合形成的原子晶体,B正确;C. 浓硫酸和水混合涉及硫酸分子的扩散,所以浓H2SO4和H2O混合时放出热量与微粒之间的作用力有关,C正确;D. H2O2易分解是因为H2O2分子中化学键键能较小,易断键,分子间作用力只能影响物质的物理性质,D错误。故选D。
10.【答案】C
【解析】本题为容易题。有球有棍的模型称球棍模型,C为甲烷的比例模型,故不正确。
11.【答案】B
【解析】本题为容易题。四个概念的研究对象不同。
同位素
同素异形体
同分异构体
同系物
概念
质子数相同中子数不同的原子(即核素)
同一种元素组成的不同单质
分子式相同结构不同的物质
结构相似(官能团相同),组成相差一个或若干“CH2”
举例
氕、氘、氚
金刚石、石墨
CH3CH2OH和CH3OCH3
CH3OH和CH3CH2OH
金刚石为原子晶体,熔点和硬度很大,而石墨为混合晶体,质软,A不正确;C中乙醇CH3CH2OH和CH3OCH3互称为同分异构体;D中C4H10的同分异构体就有两种,CH3CH2CH2CH3和CH3CH(CH3),前者一氯代物有两种,后者一氯代物也有两种,共四种,故D不正确。
12.【答案】B
【解析】干冰和石英的化学键都是共价键,前者为分子晶体,熔化时克服分子间作用力,后者为原子晶体,熔化时克服共价键,A错误;CH4中H原子最外层没有达到8电子结构,C错误;NaHSO4晶体中Na+与HSO之间为离子键,HSO内原子之间为共价键,溶于水后电离过程为NaHSO4===Na++H++SO,离子键和部分共价键破坏,故D错误。
全国真题题组
1.【答案】D
【解析】
【分析】此题考查化学用语,化学用语包括:化学式,结构式,电子式,原子(或离子)结构示意图以及不同核素的表达等,根据各化学用语的书写要点分析。
【详解】A.核素的表达式中A表示X原子的质量数,Z表示X原子的质子数,则中子数=A-Z,中子数为18的氯原子为,A项错误;
B.氮原子最外层电子数为5,还需要3个电子(或形成3对共用电子对)达到8电子稳定结构,所以两个氮原子共用3对电子,氮气的结构式为N≡N,B项错误;
C.钠原子的核外有11个电子,钠离子是由钠原子失去一个电子形成的,则钠离子核外有10个电子,Na+的结构示意图为,C项错误;
D.氧原子最外层有6个电子,两个氢原子分别和氧原子形成1对共用电子对,D项正确。故选D。
2.【答案】C
【解析】A项,中子数为8的氮原子的质量数为15,表示为,A项错误;B项,HCl中只含共价键,HCl的电子式为,B项错误;C项,NH3中含3个N-H键,NH3的结构式为,C项正确;D项,Cl-最外层有8个电子,Cl-的结构示意图为,D项错误;故选C。
点睛:本题考查化学用语,侧重考查原子结构、离子结构示意图、电子式和结构式,注意它们之间的区别是解题的关键,如原子结构示意图与离子结构示意图的区别、共价化合物和离子化合物电子式的区别、电子式与结构式的区别等。
3.【答案】A
【解析】A项,酯化反应的机理是“酸脱羟基醇脱氢”,硬脂酸与乙醇反应的化学方程式为C17H35COOH+C2H518OHC17H35CO18OC2H5+H2O,A项错误;B项,常温下0.1mol·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9mol·L-10.1mol·L-1,氨水为弱碱水溶液,电离方程式为NH3·H2ONH4++OH-,B项正确;C项,Na原子最外层有1个电子,Na易失电子形成Na+,Cl原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-
间形成离子键,C项正确;D项,电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项正确;故选A。
点睛:本题考查酯化反应的机理、电离方程式的书写、用电子式表示物质的形成过程、电解精炼铜的原理。注意强电解质和弱电解质电离方程式的区别、用电子式表示离子化合物和共价化合物形成过程的区别。
4.【答案】B
【解析】本题考查的是物质结构,需要先分析该物质中含有的微观粒子或组成的情况,再结合题目说明进行计算。A.1个Mg原子中有12个质子,1个Al原子中有13个质子。24 g镁和27 g铝各自的物质的量都是1 mol,所以24 g镁含有的质子数为12 mol,27 g铝含有的质子的物质的量为13 mol,选项A错误。B.设氧气和臭氧的质量都是Xg,则氧气(O2)的物质的量为mol,臭氧(O3)的物质的量为mol,所以两者含有的氧原子分别为×2=mol和×3=mol,即此时氧气和臭氧中含有的氧原子是一样多的,而每个氧原子都含有8个电子,所以同等质量的氧气和臭氧中一定含有相同的电子数,选项B正确。C.重水为,其中含有1个中子,含有8个中子,所以1个重水分子含有10个中子,1 mol重水含有10 mol中子。水为,其中没有中子,含有8个中子,所以1个水分子含有8个中子,1 mol水含有8 mol中子。两者的中子数之比为10:8=5:4,选项C错误。
D.乙烷(C2H6)分子中有6个C-H键和1个C-C键,所以1 mol乙烷有7 mol共价键。乙烯(C2H4)分子中有4个C-H键和1个C=C,所以1 mol乙烯有6 mol共价键,选项D错误。
点睛:本题考查的是物质中含有的各种粒子或微观结构的问题,一般来说先计算物质基本微粒中含有多少个需要计算的粒子或微观结构,再乘以该物质的物质的量,就可以计算出相应结果。
5.【答案】D
【解析】元素周期表中第七周期0族应当排列118号元素。A、117号元素位于118号左侧即ⅦA族,所以Ts是第七周期第ⅦA族元素,A正确;B、同位素是同种元素不同原子之间的互称,因此Ts的同位素原子具有相同的电子数,B正确;C、元素周期表同一列从上往下非金属性依次减弱,所以Ts在同族元素中非金属性最弱,C正确;D、中子数为176的Ts核素,其质量数为176+117=293,所以这种核素符号是,D错误。故选D。
【名师点睛】明确元素周期表的结构以及编制原则是解答的关键,元素周期表每一周期元素种类依次为2、8、8、18、18、32、32(周期表未排满),则每一周期最后一种惰性气体原子序数依次为2、10、18、36、54、86、118,因此
只要记住了稀有气体元素的原子序数,就可由主族元素的原子序数推出主族元素的位置。即(1)若比相应的稀有气体元素多1或2,则应处在下周期的第ⅠA族或第ⅡA族,如88号元素:88-86=2,则应在第七周期第ⅡA族;(2)若比相应的稀有气体元素少1~5时,则应处在同周期的第ⅦA族~第ⅢA族,如84号元素应在第六周期第ⅥA族;(3)若预测新元素,可与未发现的稀有气体元素(118号)比较,按上述方法推测知:117号元素应为第七周期第ⅦA族。
6.【答案】A
【解析】A.P的质子数是15,A正确;B.F原子的电子数为9,B错误;C.离子化合物中阴、阳离子间隔排列,其电子式中离子分开写、不能合并,C错误;D.明矾是十二水合硫酸铝钾,D错误。
7.【答案】C
【解析】A.CaO是离子化合物,熔化断裂离子键,而CO2在固态时是分子晶体,熔化破坏的是分子间作用力,与化学键无关,错误;B.NaCl是离子化合物,熔化断裂离子键,而HCl在固态时是分子晶体,熔化破坏的是分子间作用力,与化学键无关,错误;C.SiC和SiO2都是原子晶体,熔化断裂的是共价键,与化学键有关,正确;D.Cl2和I2在固态时都是分子晶体,熔化断裂的是分子间作用力,与化学键无关,错误。
【名师点睛】物质熔点高低取决于熔化过程中需要破坏的作用力的类型和大小,一般来说原子晶体>离子晶体>分子晶体。主要原因是原子晶体和离子晶体融化时分别破坏共价键和离子键,键能越大熔点越高,且原子晶体中原子间由共价键形成空间网状结构,需要破坏化学键数目一般要大于离子晶体;而分子晶体熔化时只破坏分子间作用力,与化学键键能无关,且分子间作用力强弱远小于化学键。因此,本题换个角度考虑,实质是在考查晶体类型,即两种物质是原子晶体或离子晶体的选项符合题意。