- 2021-07-08 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习鲁科版化学反应与能量变化学案
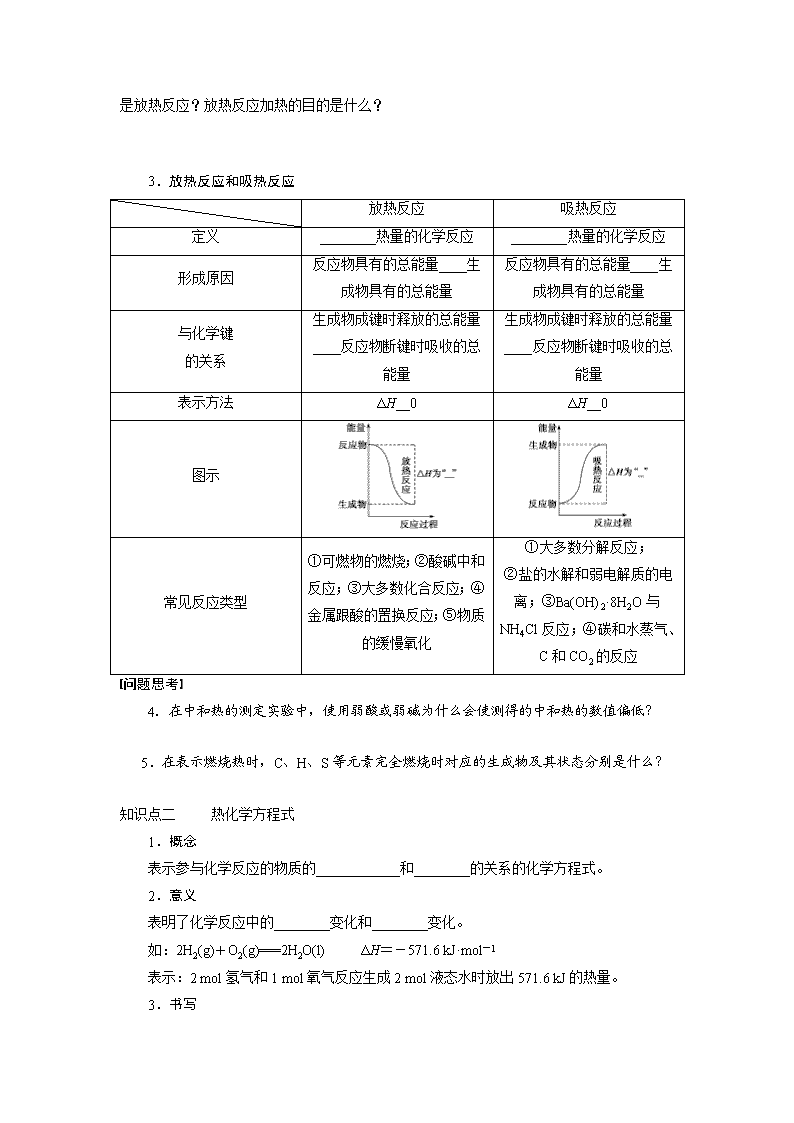
化学反应与能量变化 [考纲要求] 1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。 2. 了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 3.理解盖斯定律并能运用盖斯定律进行有关反应焓变的简单计算。 4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用 【课前预习】 知识点一 化学反应的焓变 1.化学反应中的能量变化 (1)化学反应中的两大变化:________变化和__________变化。 (2)化学反应中的两大守恒:________守恒和__________守恒。 (3)化学反应中的能量转化形式:________、光能、电能等。通常表现为________的变化。 2.焓变 反应热 (1)定义:在________条件下进行的反应的________。 (2)符号:________。 (3)单位:__________或__________。 (4)化学键与化学反应中能量变化的关系 发生化学反应时,断开反应物的化学键要________能量,形成生成物的化学键要________能量,这两个过程中的能量________,因此化学反应中必然伴随着能量的变化。即 迷津指点 ①吸热反应完成后体系能量增加,故ΔH>0,为正值。放热反应完成后体系能量减少,故ΔH<0,为负值。 ②比较反应热(ΔH)的大小时,不要忽视“+”、“-”号。放热越多,ΔH就越小。 问题思考 1.同质量的硫粉在空气中燃烧和在纯氧中燃烧,哪一个放出的热量多,为什么? 2.放热反应不需要加热就能反应,吸热反应不加热就不反应,对吗? 3. 做实验时,不管吸热反应和放热反应都用到酒精灯,怎样判断该反应是吸热反应还是放热反应?放热反应加热的目的是什么? 3.放热反应和吸热反应 放热反应 吸热反应 定义 ________热量的化学反应 ________热量的化学反应 形成原因 反应物具有的总能量____生成物具有的总能量 反应物具有的总能量____生成物具有的总能量 与化学键 的关系 生成物成键时释放的总能量____反应物断键时吸收的总能量 生成物成键时释放的总能量____反应物断键时吸收的总能量 表示方法 ΔH__0 ΔH__0 图示 常见反应类型 ①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化 ①大多数分解反应; ②盐的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应 问题思考 4.在中和热的测定实验中,使用弱酸或弱碱为什么会使测得的中和热的数值偏低? 5.在表示燃烧热时,C、H、S等元素完全燃烧时对应的生成物及其状态分别是什么? 知识点二 热化学方程式 1.概念 表示参与化学反应的物质的____________和________的关系的化学方程式。 2.意义 表明了化学反应中的________变化和________变化。 如:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 表示:2 mol氢气和1 mol氧气反应生成2 mol液态水时放出571.6 kJ的热量。 3.书写 (1)注明反应条件:反应热与测定条件(温度、压强等)有关。绝大多数反应是在25 ℃、101 kPa下进行的,可不注明。 (2)注明物质状态:常用____、____、____、____分别表示固体、液体、气体、溶液。 (3)注意符号单位:ΔH应包括“+”或“-”、数字和单位(kJ·mol-1)。 (4)注意守恒关系:①原子守恒和得失电子守恒;②能量守恒。(ΔH与化学计量数相对应) (5)注意特殊反应: ①表示中和热的热化学方程式中,产物H2O的系数必为____。 ②表示燃烧热的热化学方程式中,可燃物的系数必为____,且燃烧产物应为________________。 (6)区别普通方程式:一般不注“↑”、“↓”以及“点燃”、“加热”等。 【核心突破】 一、热化学方程式的书写 1.书写热化学方程式时,一定要注明反应条件吗? 2.物质的聚集状态与ΔH有什么联系? 3.热化学方程式中的化学计量数表示的意义是什么?使用时需注意什么问题? 典例导悟1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是( ) A.2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1 B.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 C.C8H18(l)+O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1 D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1 二、反应热大小的比较 1.比较ΔH的大小时需带正负号吗? 2.怎样比较两个反应的ΔH大小? (1)同一反应,生成物状态不同时 A(g)+B(g)===C(g) ΔH1<0 A(g)+B(g)===C(l) ΔH2<0 因为C(g)===C(l) ΔH3____, 则ΔH3=__________,ΔH2____ΔH1。 (2)同一反应,反应物状态不同时 S(g)+O2(g)===SO2(g) ΔH1<0 S(s)+O2(g)===SO2(g) ΔH2<0 ΔH2+ΔH3=____,则ΔH3=____________,又ΔH3________,所以ΔH1____ΔH2。 (3)两个有联系的不同反应相比 C(s)+O2(g)===CO2(g) ΔH1<0 C(s)+O2(g)===CO(g) ΔH2<0 根据常识可知CO(g)+O2(g)===CO2(g) ΔH3<0 又因为ΔH2+ΔH3=____,所以ΔH2____ΔH1。 典例导悟2 下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( ) ①C(s)+O2(g)===CO2(g) ΔH1 C(s)+O2(g)===CO(g) ΔH2 ②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4 ③H2(g)+O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6 ④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8 A.① B.④ C.②③④ D.①②③ 知识点三 盖斯定律 1.内容 对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是________的。 2.意义 ________________________________________________________________________。 问题思考 6.盖斯定律的实质是什么? 7.在利用盖斯定律进行计算时,如果热化学方程式方向改变时应做哪些调整? 典例导悟3 已知:(1)C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 (2)H2(g)+O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1 (3)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ·mol-1 根据以上方程式可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( ) A.+244.1 kJ·mol-1 B.-488.3 kJ·mol-1 C.-996.6 kJ·mol-1 D.+996.6 kJ·mol-1 变式演练 已知下列热化学方程式 Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1① 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1② Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1③ 写出FeO(s)被CO还原成Fe和CO2的热化学方程式 ________________________________________________________________________。 典例导悟4 由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:________________________________________________________。 若1 g水蒸气转化成液态水放热2.444 kJ,则反应2H2(g)+O2(g)===2H2O(l)的ΔH=_ _______kJ·mol-1,氢气的燃烧热为__________kJ·mol-1。 四、实验探究——中和热的测定 1.测定原理 ΔH= c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1;n为生成H2O的物质的量。 2.装置如图(在横线上填出仪器的名称) 3.注意事项 (1)碎泡沫塑料(或纸条)及泡沫塑料板的作用是 ____________________________________________。 (2)为保证酸、碱完全中和,常采用________稍稍过量。 (3)实验中若使用弱酸或弱碱,因中和过程中电离________,会使测得数值________。 【巩固提升】 高考真题1.、己知丙烷的燃烧热ΔH=—2215KJ·mol-1,若一定量的丙烷完全燃烧后生成18g水,则放出的热量约为 A. 55 kJ B.220 kJ C. 550 kJ D.1108 kJ 2、据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( ) 3.下列与化学反应能量变化相关的叙述正确的是 A.生成物能量一定低于反应物总能量 B.放热反应的反应速率总是大于吸热反应的反应速率 C.应用盖斯定律,可计算某些难以直接测量的反应焓变 D.同温同压下,在光照和点燃条件下的不同 4.(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛图。回答下列问题: (3)已知反应2HI(g)=H2(g) + I2(g)的ΔH=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。 5、(14分)硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下: 已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。 (1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。 (2)请配平第①步反应的化学方程式: □NaBO2+□SiO2+□Na+□H2-------□NaBH4+□Na2SiO3 (3)第②步分离采用的方法是______;第③步分离(NaBH4 )并回收溶剂,采用的方法是______。 (4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。 高考预测 题组一 化学反应的热效应 1.某反应过程能量变化如图所示,下列说法正确的是( ) A.反应过程a有催化剂参与 B.该反应为吸热反应,热效应等于ΔH C.改变催化剂,可改变该反应的活化能 D.有催化剂条件下,反应的活化能等于E1+E2 2.下列说法中正确的是( ) A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应 C.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0 D.ΔH的大小与热化学方程式的计量数无关 题组二 盖斯定律热化学方程式的书写 3.A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量: N2H4(l)+O2(g)N2(g)+2H2O(g) ΔH=+642 kJ·mol-1 B.12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)2CO(g) ΔH=-110.5 kJ·mol-1 C.已知:H2(g)+O2(g)H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l)2H2(g)+O2(g)的 ΔH=+572 kJ·mol-1 D.已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入 0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 4.已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1 H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( ) A.-332 B.-118 C.+350 D.+130 5.实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)2SO3(g) ΔH=-196.64 kJ·mol-1,当放出314.624 kJ热量时,SO2的转化率为( ) A.40% B.50% C.80% D.90% 题组三 综合探究 6、已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示: (1)在一定温度下,测得硫蒸气的平均摩尔质量为72 g·mol-1,则该蒸气中S2分子的体积分数不小于 。 (2)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g),反应过程和能量关系可用如图简单表示(图中的ΔH表示生成1 mol产物的数据)。 ①写出表示S8燃烧热(1 mol可燃物完全燃烧生成稳定氧化物放出的热量)的热化学方程式: 。 ②写出SO3分解生成SO2和O2的热化学方程式: 。 ③若已知硫氧键(SO)的键能为dkJ·mol-1,氧氧键(OO)的键能为ekJ·mol-1,则S8分子中硫硫键(S—S)的键能为 。 参考答案 【课前预习】 知识点一 1.(1)物质 能量 (2)质量 能量 (3)热能 热量 2.(1)恒压 热效应 (2)ΔH (3)kJ/mol kJ·mol-1 (4)吸收 放出 不相等 吸热 E1 E2 > 放热 E1 E2 < 3. 放热反应 吸热反应 定义 放出热量的化学反应 吸收热量的化学反应 形成原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量 与化学键的关系 生成物成键时释放的总能量大于反应物断键时吸收的总能量 生成物成键时释放的总能量小于反应物断键时吸收的总能量 表示方法 ΔH<0 ΔH>0 图示 知识点二 1.物质的量 反应热 2.物质 能量 3.(2)s l g aq (5)①1 ②1 稳定的氧化物 知识点三 1.一样 2.间接计算某些难以直接测量的反应热 问题思考 1.在空气中燃烧放出的热量多,因在纯氧中燃烧火焰明亮,光能多,故热量少。 2.不正确。反应放热还是吸热,与反应物和生成物具有的能量有关,与加热与否无必然关系。例如红磷和O2生成P2O5需要加热,铵盐和碱不加热就能进行。 3.持续用酒精灯加热,撤掉酒精灯反应就停止的反应是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的是放热反应。放热反应加热目的一般是加快反应速率。 4.因为弱酸或弱碱的电离过程中会吸收一部分热量,从而使测得的结果偏低。 5.CO2(g)、H2O(l)、SO2(g) 6.实质是能量守恒。 7.当热化学方程式的方向改变时,ΔH的符号改变,大小不变。 【核心突破】 一、1.不一定。反应热ΔH与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明ΔH的测定条件。绝大多数ΔH是在25 ℃、101 kPa下测定的,可不注明温度和压强。 2.反应物和产物的聚集状态不同,反应热ΔH不同。因此,必须注明物质的聚集状态。这是因为: 3.(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数。因此化学计量数可以是整数,也可以是分数。 (2)热化学方程式中的反应热是表示反应物完全反应时的热量变化,与反应是否可逆无关。方程式中化学式前面的化学计量数必须与ΔH相对应,即化学计量数与ΔH成正比。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。如: ①H2(g)+Cl2(g)===2HCl(g) ΔH1 ②H2(g)+Cl2(g)===HCl(g) ΔH2 ③2HCl(g)===H2(g)+Cl2(g) ΔH3 则有:ΔH1=2ΔH2=-ΔH3 二、1.比较吸、放热反应过程中,吸收或放出热量的多少时不考虑符号,但比较ΔH大小时,必须带正、负号比较,对放热反应,ΔH越小,放热越多;对吸热反应,ΔH越大,吸热越多。 2.(1)<0 ΔH2-ΔH1 < (2)ΔH1 ΔH1-ΔH2 <0 < (3)ΔH1 > 典例导悟 1.B [H2SO4与Ba(OH)2溶液反应,不仅生成了H2O还有BaSO4 生成,因此A项放出的热量比57.3 kJ×2还多,A项错误;辛烷的燃烧热是指1 mol辛烷完全燃烧生成CO2气体和液态水时放出的热量是5 518 kJ,C、D项均错误。] 2.C [本题主要考查对“ΔH”的理解,明确“ΔH”既有“+”、“-”,又有数值大小。碳与氧气反应放热,即ΔH1<0,ΔH2<0,CO再与O2作用时又放热,所以ΔH1<ΔH2;等量的固态硫变为气态硫蒸气时吸收热量,故在与O2作用产生同样多的SO2时,气态硫放出的热量多,即ΔH3>ΔH4;发生同样的燃烧反应,物质的量越多,放出的热量越多,故ΔH5>ΔH6;碳酸钙分解吸收热量,ΔH7>0,CaO与H2O反应放出热量,ΔH8<0,显然ΔH7>ΔH8。故本题答案为C。] 3.B [根据盖斯定律,将(1)×2+(2)×2-(3)得:2C(s)+2H2(g)+O2(g)===CH3COOH(l) ΔH=-393.5 kJ·mol-1×2-2×285.8 kJ·mol-1-(-870.3 kJ·mol-1)=-488.3 kJ·mol-1。] 4.H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1 -571.6 285.8 【巩固提升】 高考真题 1.A2、B 3、C 4.⑶ 299 5.【答案】(1)除去反应器中的水蒸气和空气 煤油 镊子 滤纸 (2)1 NaBO2+2SiO2+4Na+2H2=1NaBH4+2Na2SiO3 (3)过滤 蒸馏 (4)NaBH4(s)+2H2O(l)= NaBO2(s)+4H2(g) △H= -216.0KJ/mol 高考预测 1.C 2.C [化学反应中一定有能量变化,A错误;B项中,ΔH=反应物的键能总和-生成物的键能总和,得ΔH<0,故为放热反应。] 3、C 4、D 5.C [当放出热量为314.624 kJ时,参加反应的SO2的物质的量为×2 mol=3.2 mol,故SO2的转化率为×100%=80%。] 4.A [将(1)减去(2)可得到3O2(g)===2O3(g) ΔH=+284.2 kJ·mol-1,即等质量的反应物O2比生成物O3能量低,反应吸热,O2比O3稳定,A选项正确。] 5.A [未经分类的生活垃圾使用填埋法处理的措施不仅污染环境,还造成资源浪费,③不正确。] 6.【解析】(1)当只有S2、S4时S2分子的体积分数最小,设S2物质的量为X,S4物质的量为Y,=72;得到X∶Y=7∶1,相同条件下气体物质的量之比等于体积之比,该蒸气中S2分子的体积分数不小于87.5%。 (2)①依据图象分析1 mol O2和mol S8反应生成二氧化硫放热akJ·mol-1,依据燃烧热的概念是1 mol可燃物完全燃烧生成稳定氧化物放出的热量,根据概念先写出化学方程式,标注物质聚集状态、反应热,热化学方程式为S8(s)+8O2(g)8SO2(g) ΔH=-8akJ·mol-1。②依据图象分析结合反应能量变化,写出化学方程式,标注物质聚集状态和反应热,SO3分解生成SO2和O2的热化学方程式为SO3(g)SO2(g)+O2(g) ΔH=bkJ·mol-1。 ③设S8分子中硫硫键键能为XkJ·mol-1;S8(s)+8O2(g)8SO2(g) ΔH=-8akJ·mol-1;依据反应热=反应物的键能总和-生成物的键能总和=8X+8e-16d=-8a,则X=2d-a-e。 答案:(1)87.5% (2)①S8(s)+8O2(g)8SO2(g) ΔH=-8akJ·mol-1 ②SO3(g)SO2(g)+O2(g) ΔH=bkJ·mol-1 ③(2d-a-e)kJ·mol-1查看更多