- 2021-07-08 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版铁及其重要的化合物学案
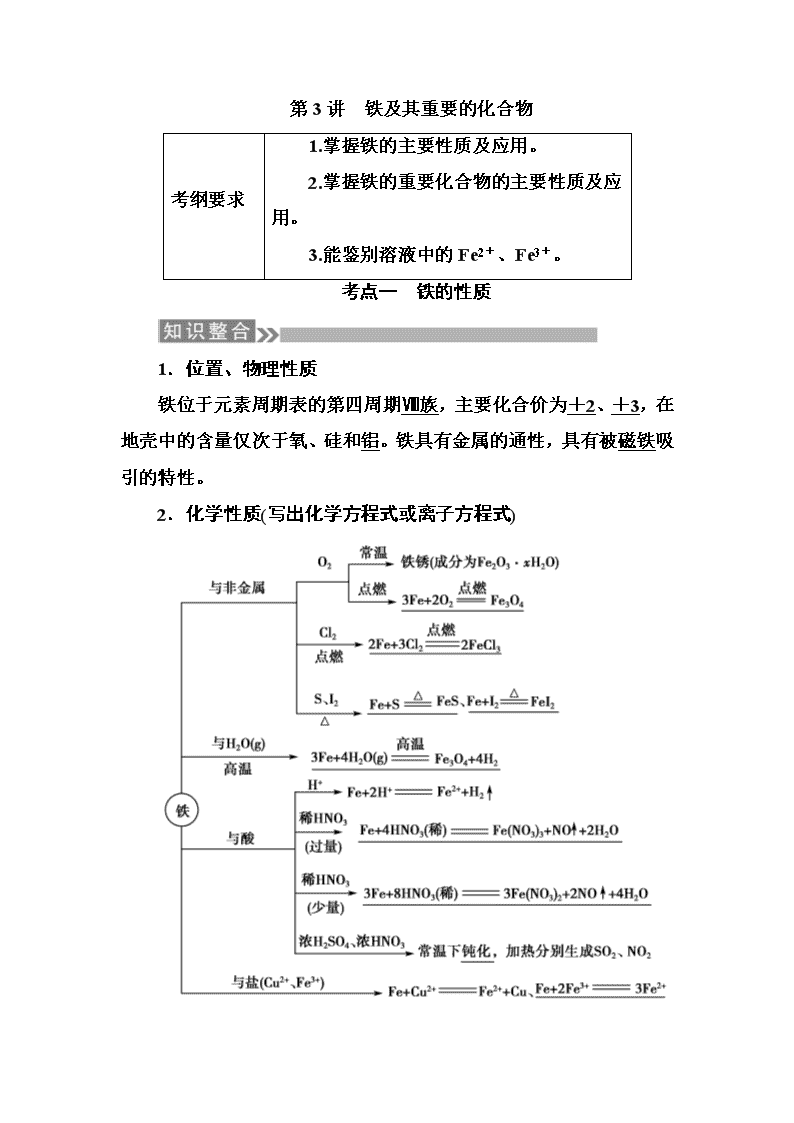
第3讲 铁及其重要的化合物 考纲要求 1.掌握铁的主要性质及应用。 2.掌握铁的重要化合物的主要性质及应用。 3.能鉴别溶液中的Fe2+、Fe3+。 考点一 铁的性质 1.位置、物理性质 铁位于元素周期表的第四周期Ⅷ族,主要化合价为+2、+3,在地壳中的含量仅次于氧、硅和铝。铁具有金属的通性,具有被磁铁吸引的特性。 2.化学性质(写出化学方程式或离子方程式) 【多维思考】 1.铁、铝遇冷的浓硫酸或浓硝酸发生钝化,是物理变化还是化学变化? 提示:化学变化。 2.FeCl2、FeCl3是否都可以通过化合反应制取? 提示:都可以。 铁与氧化剂反应后的价态判断方法 (1)铁与弱氧化剂(如S、I2、H+、Fe3+、Cu2+)等反应所得产物为Fe2+,铁元素的价态为+2价。 (2)铁与强氧化剂(如Cl2、Br2、浓H2SO4、硝酸等)反应所得产物为Fe3+,铁元素的价态为+3价。 (3)铁在纯氧中燃烧以及在高温下与H2O(g)反应得到的产物为Fe3O4,铁元素的价态为+2、+3价。 考向一 铁的存在和性质 1.下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是( ) 陈述Ⅰ 陈述Ⅱ 判断 A 铁是地壳中含量最高的金属元素 铁是人类最早使用的金属材料 Ⅰ对;Ⅱ对;有 B 常温下铁与稀硫酸反应生成氢气 高温下氢气能还原氧化铁得到铁 Ⅰ对;Ⅱ对;无 C 铁元素属于过渡元素 铁和铁的某些化合物可用作催化剂 Ⅰ错;Ⅱ对;无 D 在空气中铁表面形成致密氧化膜 铁不能与氧气反应 Ⅰ对;Ⅱ对;有 解析:A项,地壳中含量最高的金属元素是Al,Ⅰ错,最早使用的金属是铜,Ⅱ错;C项,陈述Ⅰ、Ⅱ都正确,且有因果关系;D项,铁在空气中易形成铁锈,而不是致密的氧化膜,且铁与氧气反应,Ⅰ、Ⅱ均错。 答案:B 2.下列关于铁的说法正确的是( ) A.纯铁为灰黑色,所以铁属于黑色金属 B.铁在硫蒸气中燃烧生成Fe2S3 C.纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化 D.铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3 解析:纯铁为银白色,A错;铁在硫蒸气中燃烧生成FeS,B错;3Fe+4H2O(g)Fe3O4+4H2,D错。 答案:C 考向二 铁反应后元素价态的判断 3.下列物质反应后一定有+3价铁生成的是( ) ①过量的Fe与Cl2加热时发生反应 ②Fe与过量稀H2SO4反应后,再向其中加KNO3 ③Fe与过量的S加热时发生反应 ④Fe(NO3)2溶液中加少量盐酸 ⑤Fe和Fe2O3的混合物溶于盐酸中 A.①②③ B.③④⑤ C.①④⑤ D.①②④ 解析:Fe与Cl2反应只生成FeCl3;Fe与S反应生成FeS;Fe Fe2+Fe3+;Fe2+Fe3+;Fe2O3溶于盐酸生成Fe3+,当混合物中Fe不足时,溶液中仍有Fe3+,当Fe足量时,溶液中无Fe3+。 答案:D 4.在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+ 的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。 ①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+ (1)AB段铁元素以________形式存在。 (2)BC段铁元素以________形式存在。 (3)CD段铁元素以________形式存在。 解析:向稀HNO3中加入铁粉,开始时稀HNO3过量应生成Fe3+,故AB段铁元素以Fe3+形式存在。随着铁粉的增加,溶液中的Fe3+与Fe反应生成Fe2+,故BC段铁元素以Fe2+、Fe3+形式存在。Fe3+全部转化成Fe2+后,铁粉不再溶解,故CD段铁元素以Fe、Fe2+形式存在。 答案:(1)① (2)④ (3)③ 考点二 铁的氧化物与氢氧化物 1.铁的氧化物 化学式 FeO Fe2O3 Fe3O4 俗名 铁红 磁性氧化铁 颜色状态 黑色粉末 红棕色粉末 黑色晶体 (有磁性) 溶解性 难溶于水 难溶于水 难溶于水 铁的 化合价 +2 +3 +2、+3 稳定性 不稳定 稳定 稳定 与H+反应的离子方程式 FeO+2H+ ===Fe2++H2O Fe2O3+6H+ ===2Fe3++3H2O Fe3O4+8H+ ===Fe2+ +2Fe3++4H2O 2.铁的氢氧化物 化学式 Fe(OH)2 Fe(OH)3 色态 白色固体 红褐色固体 与盐酸反应 Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+ ===Fe3++3H2O 受热分解 分解产物复杂 2Fe(OH)3 Fe2O3+3H2O 制法 可溶性亚铁盐与碱溶液反应Fe2++2OH- === Fe(OH)2↓ 可溶性铁盐与碱溶液反应 Fe3++3OH-===Fe(OH)3↓ 两者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3 【多维思考】 1.盐酸、氢碘酸均是强酸,Fe(OH)3分别与它们反应有何不同?写出有关的反应方程式? 提示:Fe(OH)3悬浊液遇到盐酸、氢碘酸均能使红褐色沉淀溶解,但HI具有较强的还原性,能被Fe3+氧化为I2,使溶液颜色变深,故HCl与Fe(OH)3反应只是中和反应:Fe(OH)3+3HCl===FeCl3+3H2O,而HI与Fe(OH)3反应为氧化还原反应,反应方程式为2Fe(OH)3+6HI===2FeI2+I2+6H2O。 2.用FeSO4溶液和NaOH溶液制备Fe(OH)2沉淀,应注意哪些问题? 提示:(1)配制FeSO4溶液和NaOH溶液的蒸馏水要加热煮沸以除去蒸馏水中的O2; (2)用长滴管吸取NaOH溶液插入FeSO4溶液液面以下挤出。 1.铁的氧化物组成的判断方法 设铁的氧化物中铁元素与氧元素的质量比为m∶n,则氧化物中 n(Fe)∶n(O)=∶=a:b, 若a∶b=1∶1,则铁的氧化物为FeO; 若a∶b=2∶3,则铁的氧化物为Fe2O3; 若a∶b=3∶4,则铁的氧化物是Fe3O4,或FeO与Fe2O3按物质的量比1∶1的混合物,或FeO、Fe2O3、Fe3O4的混合物其中FeO、Fe2O3物质的量之比为1∶1,Fe3O4为任意值。 2.制备Fe(OH)2常用的三种方法 方法一:有机覆盖层法 将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。 方法二:还原性气体保护法 用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀。如图2所示。 方法三:电解法 用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖苯或煤油,如图3所示。 图3 考向一 铁的氧化物、氢氧化物的组成与性质 1.把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为( ) A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO C.Fe(OH)2、Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3 解析:红褐色沉淀应为Fe(OH)3,因为加入HNO3,Fe(OH)2不存在;Fe(OH)3受热分解生成Fe2O3。 答案:A 2.由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是( ) A.1∶2∶1 B.2∶1∶1 C.1∶3∶1 D.1∶1∶3 解析:混合物中,n(Fe)∶n(O)=∶=3∶4,故 FeO与Fe2O3按物质的量1∶1混合,D项符合要求。 答案:D 考向二 Fe(OH)2的制备 3.用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的 FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。 (1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入__________________________________________________________ _________________________________________________________。 (2)除去蒸馏水中溶解的O2常采用__________的方法。 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________________________。 解析:(1)Fe2+易水解,要加入稀硫酸防止其水解;Fe2+易被空气中的O2氧化,要加Fe粉防止Fe2+被氧化。 (2)气体的溶解度随温度升高而降低,所以煮沸后的水中溶解的O2较少。 答案:(1)稀硫酸、铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2 4.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是________(填序号)。 解析:因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即4Fe(OH)2+O2+2H2O===4Fe(OH)3,因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解水产生的OH-结合生成Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于带入空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀。 答案:①②③⑤ 考点三 Fe2+、Fe3+的性质及检验 1.“铁三角”的转化关系 写出上述转化关系中标号反应的离子方程式: ①2Fe3++Fe===3Fe2+; ②2Fe3++H2S===2Fe2++S↓+2H+; ③2Fe2++H2O2+2H+===2Fe3++2H2O; ④3Fe2++NO+4H+===3Fe3++NO↑+2H2O。 2.Fe2+和Fe3+的检验 (1)Fe2+的检验:先加KSCN溶液,无明显现象,再加氯水出现红色,反应的离子方程式:Cl2+2Fe2+===2Cl-+2Fe3+、Fe3++3SCN-??Fe(SCN)3。 (2)Fe3+的检验:滴加KSCN溶液,生成红色溶液,反应的离子方程式为Fe3++3SCN-??Fe(SCN)3。 【多维思考】 1.如何除去FeCl3溶液中的Fe2+? 提示:加一定量的氯水或H2O2溶液。 2.Fe2+与NO能否大量共存?若向其中再加入少量盐酸,情况又会如何? 提示:Fe2+与NO能大量共存,但在酸性条件下NO能将Fe2+ 氧化成Fe3+而不能大量共存。 3.检验Fe2+时能不能先加氯水再加KSCN溶液?为什么? 提示:不能,因为若溶液中含有Fe3+时,就无法排除其干扰。 Fe2+、Fe3+的转化应用——除杂 主要成分 杂质 除杂方法 FeCl3 FeCl2 加入氯水或H2O2 FeCl2 FeCl3 加过量铁粉后过滤 FeCl2 CuCl2 加过量铁粉后过滤 考向一 Fe2+与Fe3+之间的转化 1.如何除去括号中的杂质? (1)Fe2+(Fe3+):________________________________________; (2)FeCl3(FeCl2):______________________________________; (3)FeCl2(CuCl2):______________________________________; (4)Fe2O3(Al2O3、SiO2):__________________________________。 答案:(1)加过量铁粉,过滤 (2)加氯水或H2O2 (3)加过量铁粉,过滤 (4)加过量强碱溶液,过滤 2.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下: Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液; Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。 (1)FeCl3蚀刻铜箔反应的离子方程式为__________________________________________________________ _________________________________________________________。 (2)过程Ⅰ加入铁屑的主要作用是_______________________, 分离得到的固体主要成分是____________________________, 从固体中分离出铜需采用的方法是_______________________。 (3)过程Ⅱ中发生反应的化学方程式为____________________ _________________________________________________________。 解析:FeCl3溶液蚀刻铜箔的离子方程式为2Fe3++Cu===2Fe2++Cu2+,得到的废液中含有FeCl3、CuCl2、FeCl2。 答案:(1)2Fe3++Cu===2Fe2++Cu2+ (2)反应掉FeCl3、CuCl2 Fe、Cu 加入足量稀盐酸过滤 (3)4FeCl2+4Ca(OH)2+O2+2H2O===4Fe(OH)3+4CaCl2 考向二 探究Fe2+与Fe3+的性质 3.某班同学用如下实验探究Fe2+、Fe3+的性质。 回答下列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________ _________________________________________________________。 (2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为________________________________________ _________________________________________________________。 (3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________________________。 (4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验: ①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色; ②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀; ③第三支试管中加入1滴KSCN溶液,溶液变红。 实验②检验的离子是______(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________。 (5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_________________________________________; 生成沉淀的原因是_________________________________________ ________________________(用平衡移动原理解释)。 解析:(1)Fe2+具有很强的还原性,易被空气中的O2氧化为Fe3+,在FeCl2溶液中加入少量铁屑,可防止Fe2+被氧化。 (2)Fe2+被氧化为Fe3+,Cl2被还原为Cl-,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。 (3)O2难溶于煤油,加入煤油能隔绝空气,排除O2对实验的影响。 (4)KI溶液与FeCl3溶液反应的离子方程式为2I-+2Fe3+===I2+2Fe2+。K3[Fe(CN)6]是检验Fe2+的试剂。实验③溶液变红,说明溶液中仍存在Fe3+,由此可说明该氧化还原反应为可逆反应。 (5)酸化的FeCl2溶液与H2O2反应,Fe2+被氧化为Fe3+,H2O2被还原为H2O,反应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。Fe3+对H2O2的分解起催化作用,当反应一段时间后,会发生反应:2H2O22H2O+O2↑,故溶液中产生气泡。由于H2O2分解反应放热,促使Fe3++3H2OFe(OH)3+3H+平衡右移,最终出现Fe(OH)3红褐色沉淀。 答案:(1)防止Fe2+被氧化 (2)2Fe2++Cl2===2Fe3++2Cl- (3)隔绝空气(排除氧气对实验的影响) (4)Fe2+ Fe3+ 可逆反应 (5)2Fe2++H2O2+2H+===2Fe3++2H2O Fe3+催化H2O2分解产生O2 H2O2分解反应放热,促进Fe3+的水解平衡正向移动 1.判断正误(正确的打“√”,错误的打“×”) (1)(2017·高考江苏卷,7A)FeFeCl2Fe(OH)2( ) (2)(2017·高考江苏卷,9A)无色透明的溶液中: Fe3+、Mg2+、SCN-、Cl- 能大量共存( ) (3)(2017·高考江苏卷9C)c(Fe2+)=1 mol·L-1的溶液中:K+、NH、MnO、SO能大量共存( ) (4)(2016·高考四川卷Ⅲ,2B)常温下,将铁片浸入足量浓硫酸中,铁片不溶解,则常温下铁与浓硫酸一定没有发生化学反应( ) (5)(2016·高考全国卷Ⅲ,7B)根据铁比铜金属性强,在实际应用中可用FeCl3腐蚀Cu刻制印刷电路板( ) (6)(2016·高考全国卷Ⅰ,10C)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释( ) (7)(2016·高考海南卷)将铁屑放入稀HNO3中证明Fe比H2活泼( ) (8)(2015·高考重庆卷,4A)观察Fe(OH)2生成( ) (9)(2015·高考天津卷,2A)在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+( ) (10)(2015·高考山东卷,11B)向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色,则溶液中一定含有Fe2+( ) (11)(2015·高考四川卷,1A改编)铁粉作食品袋内的脱氧剂,铁粉起还原作用( ) 答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)× (8)√ (9)× (10)× (11)√ 2.(2017·高考全国卷Ⅲ)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题: (1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:________、________。 (2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。 ①仪器B的名称是________________。 ②将下列实验操作步骤正确排序________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。 a.点燃酒精灯,加热 B.熄灭酒精灯 c.关闭K1和K2 D.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温 ③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x________(填“偏大”“偏小”或“无影响”)。 (3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。 ①C、D中的溶液依次为________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为________________。 a.品红 B.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4 ②写出硫酸亚铁高温分解反应的化学方程式_______________ ________________________________________________________。 解析:(1)样品溶于水滴加KSCN溶液,溶液颜色无明显变化,说明样品中无Fe3+;再向试管中通入空气,溶液逐渐变红,这说明有铁离子产生,即硫酸亚铁易被空气氧化为硫酸铁,铁离子遇KSCN溶液显红色;(2)①根据仪器构造可知B是球形干燥管;②由于装置中含有空气,空气能氧化硫酸亚铁,所以加热前需要排尽装置中空气,利用氮气排出空气,为了使生成的水蒸气完全排除,应该先熄灭酒精灯再冷却,然后关闭K1和K2,最后称量,即正确的排序是dabfce;③样品的质量是m2-m1,加热后剩余固体是硫酸亚铁,根据铁原子守恒可知=,解得x=;若实验时按a、d次序操作,在加热过程中硫酸亚铁被空气氧化为硫酸铁,导致m3增加,因此x偏小;(3)① 最终得到红棕色固体,说明有氧化铁生成,即分解过程发生了还原反应,根据化合价变化可知一定有SO2生成,这说明硫酸亚铁分解生成氧化铁、二氧化硫和三氧化硫。三氧化硫溶于水生成硫酸,硫酸根离子和钡离子结合生成白色沉淀硫酸钡,由于硝酸钡在酸性溶液中有氧化性,能氧化SO2,所以应该用氯化钡,检验SO2用品红溶液,所以C、D的溶液依次为氯化钡溶液和品红溶液,实验现象是C中溶液变浑浊产生白色沉淀,D中品红溶液褪色;②根据以上分析可知硫酸亚铁高温分解的方程式为2FeSO4Fe2O3+SO2↑+SO3↑。 答案:(1)样品中无Fe3+ 硫酸亚铁易被空气氧化为硫酸铁 (2)①球形干燥管 ② dabfce ③ 偏小 (3)①c、a 产生白色沉淀、品红溶液褪色 ②2FeSO4Fe2O3+SO2↑+SO3↑查看更多