- 2021-07-08 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版氧化还原反应教案(1)
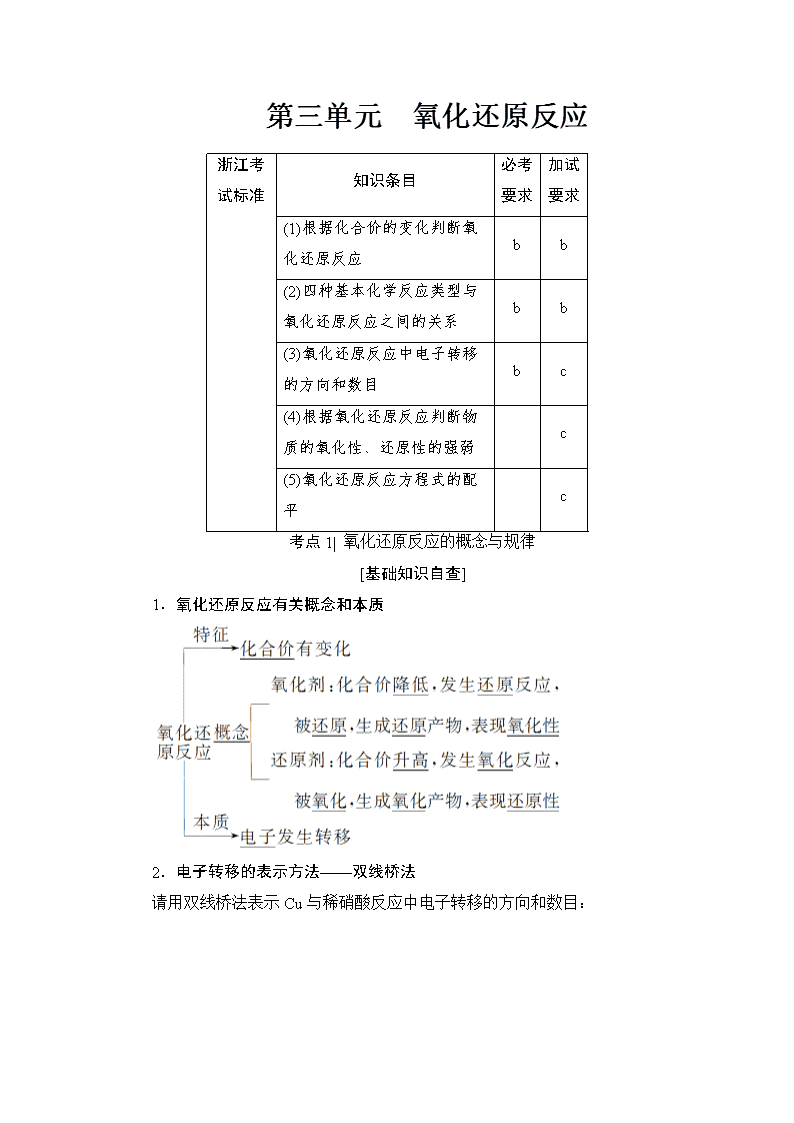
第三单元 氧化还原反应 浙江考试标准 知识条目 必考要求 加试要求 (1)根据化合价的变化判断氧化还原反应 b b (2)四种基本化学反应类型与氧化还原反应之间的关系 b b (3)氧化还原反应中电子转移的方向和数目 b c (4)根据氧化还原反应判断物质的氧化性、还原性的强弱 c (5)氧化还原反应方程式的配平 c 考点1| 氧化还原反应的概念与规律 [基础知识自查] 1.氧化还原反应有关概念和本质 2.电子转移的表示方法——双线桥法 请用双线桥法表示Cu与稀硝酸反应中电子转移的方向和数目: 3.氧化还原反应与其他类型反应之间的关系 (1)一定属于氧化还原反应的是置换反应。 (2)一定不属于氧化还原反应的是复分解反应。 (3)属于氧化还原反应的常见化合反应的共同点是有单质参加。 (4)属于氧化还原反应的常见分解反应的共同点是有单质生成。 4.常见氧化剂与还原剂 (1)氧化剂 ①某些活泼的非金属单质:如Cl2,一般被还原为Cl-。 ②元素处于高价态的物质:如浓硫酸,一般被还原为SO2。 ③过氧化物:如H2O2,一般被还原为H2O。 (2)还原剂 ①活泼的金属单质:如Zn,一般被氧化为Zn2+。 ②某些活泼的非金属单质:如H2,一般被氧化为H2O。 ③元素处于低价态的物质:如CO,一般被氧化为CO2。 [核心要点提升] 氧化还原反应的基本规律 (1)守恒规律 氧化还原反应中有物质失电子必有物质得电子,且得电子总数等于失电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价降低总值必等于升高总值。 (2)强弱规律 氧化性较强的氧化剂跟还原性较强的还原剂反应,生成还原性较弱的还原产物和氧化性较弱的氧化产物。可表示为 应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。 (3)价态规律 元素处于最高价态,只有氧化性;元素处于最低价态,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质中若含有多种元素,其性质是这些元素性质的综合体现。 应用:判断元素或物质有无氧化性或还原性。 (4)转化规律 氧化还原反应中,元素相邻价态之间的转化最容易;同种元素不同价态之间发生反应,元素的化合价只靠拢而不交叉;同种元素相邻价态之间不发生氧化还原反应。例如: 应用:判断氧化还原反应能否发生及表明电子转移情况。 (5)难易规律 越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,与还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,与氧化性最强的优先发生反应,如FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为2Fe2++Cl2===2Fe3++2Cl-,2Br-+Cl2===Br2+2Cl-。 应用:判断物质的稳定性及反应顺序。 [典型例题讲解] (2016·浙江10月选考试题)下列反应中,水作氧化剂的是( ) A.C+H2OCO+H2 B.H2+CuOCu+H2O C.Cl2+H2O===HCl+HClO D.SO3+H2O===H2SO4 【解析】 A项,反应中水中的氢元素化合价降低得电子,所以水作氧化剂,正确;B项,水是生成物,既不是氧化剂,也不是还原剂,错误;C项,在该反应中水是反应物,既不是氧化剂,也不是还原剂,错误;D项,该反应是非氧化还原反应,错误。 【答案】 A (2015·浙江10月选考试题)已知氧化性Br2>Fe3+。向含溶质a mol的FeBr2溶液中通入b mol Cl2,充分反应。下列说法不正确的是( ) 【导学号:81640037】 A.离子的还原性强弱:Fe2+>Br->Cl- B.当a≥2b时,发生的离子反应:2Fe2++Cl2===2Fe3++2Cl- C.当a=b时,反应后的离子浓度之比:c(Fe3+)∶c(Br-)∶c(Cl-)=1∶2∶2 D.当3a≤2b时,发生的离子反应:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl- 【解析】 由氧化性Br2>Fe3+,可知通入Cl2,依次发生2Fe2++Cl2===2Fe3++2Cl-,2Br-+Cl2===2Cl-+Br2 ,由还原剂的还原性大于还原产物的还原性,可知还原性:Fe2+>Br->Cl-,A正确;当a≥2b时,Cl2只能氧化Fe2+,B正确;当a=b时,Cl2氧化完Fe2+再氧化部分Br-,其反应后的离子浓度之比为c(Fe3+)∶c(Br-)∶c(Cl-)=1∶1∶2,C错误;当3a≤2b时,Cl2过量能将FeBr2完全氧化,D正确。 【答案】 C (1)同时含有几种还原剂时将按照还原性由强到弱的顺序依次反应→依次得到相应的氧化产物。 (2)同时含有几种氧化剂时将按照氧化性由强到弱的顺序依次反应→依次得到相应的还原产物。 [题组对点训练] 1.(2016·浙江4月学考)下列属于氧化还原反应的是( ) A.2KBr+Cl2===2KCl+Br2 B.CaCO3CaO+CO2↑ C.SO3+H2O===H2SO4 D.MgCl2+2NaOH===Mg(OH)2↓+2NaCl A [反应2KBr+Cl2===2KCl+Br2中氯元素化合价降低,溴元素化合价升高,为氧化还原反应,A项符合题意;碳酸钙分解生成氧化钙和二氧化碳时,无元素化合价变化,为非氧化还原反应,B项不符合题意;反应SO3+H2O===H2SO4中无元素化合价变化,为非氧化还原反应,C项不符合题意;氯化镁与氢氧化钠发生的是复分解反应,为非氧化还原反应,D项不符合题意。] 2.(2015·浙江7月学考)在化学反应3CO+Fe2O32Fe+3CO2中,还原剂是( ) A.CO B.Fe2O3 C.Fe D.CO2 A [反应中CO中碳元素由+2价升高到+4价(生成CO2 ),失去电子,CO作还原剂。] 3.(2015·浙江1月学考)火法炼铜首先要焙烧黄铜矿(主要成分为CuFeS2,其中Cu、Fe均为+2价),其反应为2CuFeS2+O2Cu2S+2FeS+SO2 关于此反应,下列说法不正确的是( ) 【导学号:81640038】 A.CuFeS2中只有硫元素被氧化 B.每生成1 mol SO2,反应中共转移6 mol电子 C.该反应中有两种物质作氧化剂 D.CuFeS2中被氧化和被还原的原子数目之比为2∶1 D [CuFeS2中-2价的硫元素化合价升高为SO2中的+4价,即硫元素被氧化;每生成1 mol SO2共转移6 mol电子;反应中 ―→,2―→,故CuFeS2和O2得电子作氧化剂;2 mol CuFeS2中,1 mol 硫原子被氧化,2 mol铜原子被还原,被氧化和被还原的原子数之比为1∶2,D错误。] 4.向含0.78 mol FeCl2的溶液中通入0.09 mol Cl2,再加入100 mL 1 mol·L-1的X2O酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为( ) A.+1 B.+2 C.+3 D.+5 C [0.78 mol Fe2+→0.78 mol Fe3+,共失去0.78 mol e-,0.09 mol Cl2→0.18 mol Cl-,获得0.18 mol e-,根据得失电子守恒可知,X2O获得电子的物质的量=0.78 mol-0.18 mol=0.60 mol,n(X2O)=0.1 L×1 mol·L-1=0.1 mol,设产物中X的化合价为x,则有0.1×2×(6-x)=0.60,得x=3,C项正确。] 5.(2016·宁波高三三模)向FeI2和FeBr2物质的量之比为1∶1的混合溶液中逐滴滴入氯水,下列离子反应不可能发生的是( ) A.2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl- B.2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- C.2Fe2++2I-+2Br-+3Cl2===2Fe3++I2+Br2+6Cl- D.2Fe2++4I-+4Br-+5Cl2===2Fe3++2I2+2Br2+10Cl- D [Fe2+、I-、Br-还原性顺序为I->Fe2+>Br-。A项,属于只氧化FeI2的情况;B项,属于I-、Fe2+全部被氧化的情况;C项,属于FeI2、FeBr2(1∶1)全部被氧化的情况;D项,Fe2+未被完全氧化,Br-则不能被氧化。] 考点2| 氧化性还原性强弱的比较(加试要求) [基础知识自查] 1.氧化性是指物质得到电子的性质,还原性是指物质失去电子的性质。 2.氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。 从元素的价态考虑:最高价态——只有氧化性,如:Fe3+、H2SO4、KMnO4等;最低价态——只有还原性,如:金属单质、Cl-、S2-等;中间价态——既有氧化性又有还原性,如:Fe2+、S、Cl2等。 [核心要点提升] 1.氧化性、还原性强弱的判断方法 氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物 可总结为:比什么性,找什么剂,产物之性小于剂。 2.根据“三表”判断 (1)根据元素周期表判断 (2)根据金属活动性顺序判断 (3)根据非金属活动性顺序判断 3.依据反应条件及反应的剧烈程度判断 反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。 例如:根据2Na+2H2O===2NaOH+H2↑, Mg+2H2OMg(OH)2+H2↑,可以推知还原性Na>Mg。 4.依据产物价态的高低判断 相同条件下: 不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。 例如,根据2Fe+3Cl22FeCl3,Fe+SFeS, 可以推知氧化性:Cl2>S。 [典型例题讲解] 常温下,在溶液中可发生以下反应: ①16H++10Z-+2XO===2X2++5Z2+8H2O ②2M2++R2===2M3++2R- ③2R-+Z2===R2+2Z- 由此判断下列说法错误的是( ) A.氧化性强弱顺序为:XO查看更多
相关文章
- 当前文档收益归属上传用户