- 2021-07-08 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
西藏林芝市第二中学2019-2020学年高二上学期第一次月考化学试题
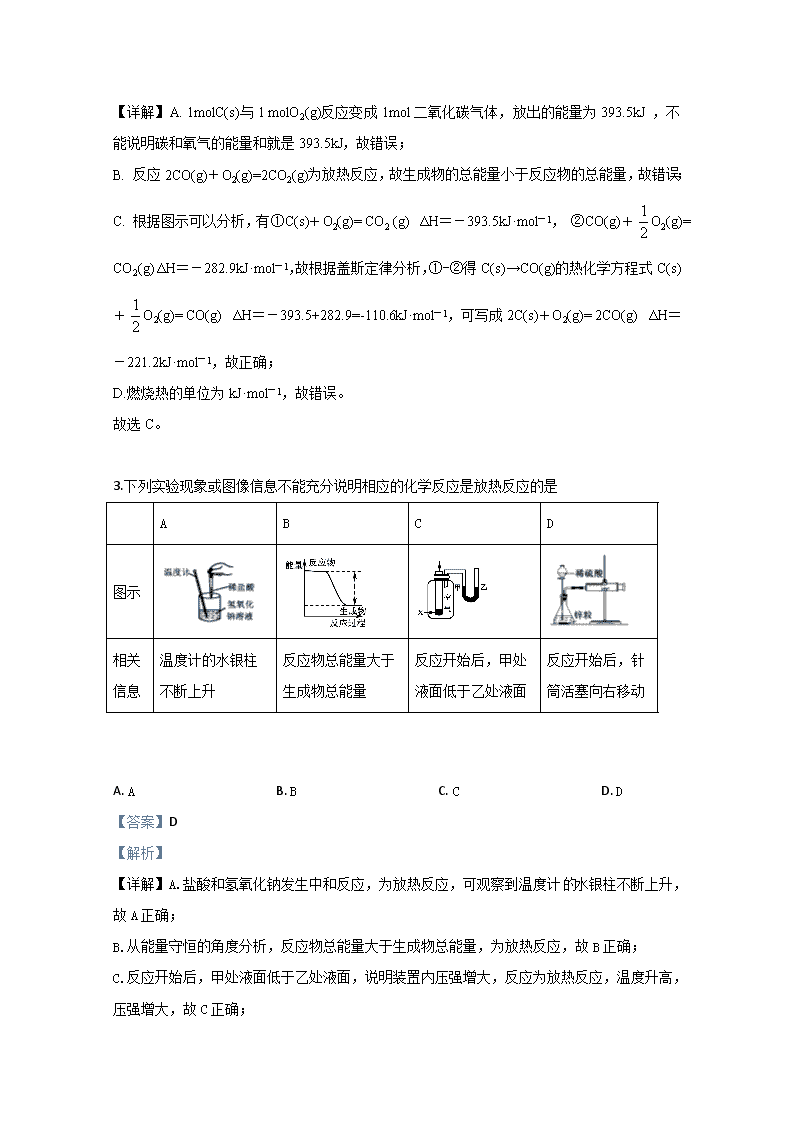
林芝二高2019-2020学年第一学期高二年级月考 理综化学试题 1.工业上由CO2和H2合成气态甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50kJ·mol-1。下面表示合成甲醇的反应的能量变化示意图,其中正确的是( ) A. B. C. D. 【答案】A 【解析】 【详解】根据题目所给热化学反应方程式,工业上由CO2和H2合成气态甲醇和气态水的反应为放热反应,即反应物的总能量高于生成物的总能量,因此排除CD选项,由气态水到液态水的过程是液化的过程,会向外放热,因此液态产物的能量比气态产物的能量更低,因此选择A项。 2.根据如图能量关系示意图,下列说法正确的是( ) A. 1molC(s)与1 molO2(g)的能量之和为393.5kJ B. 反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量 C. 由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)= 2CO(g) ΔH=-221.2kJ·mol-1 D. CO的燃烧热ΔH=-282.9kJ 【答案】C 【解析】 【详解】A. 1molC(s)与1 molO2(g)反应变成1mol二氧化碳气体,放出的能量为393.5kJ ,不能说明碳和氧气的能量和就是393.5kJ,故错误; B. 反应2CO(g)+O2(g)=2CO2(g)为放热反应,故生成物的总能量小于反应物的总能量,故错误; C. 根据图示可以分析,有①C(s)+O2(g)= CO2 (g) ΔH=-393.5kJ·mol-1, ②CO(g)+O2(g)= CO2(g) ΔH=-282.9kJ·mol-1,故根据盖斯定律分析,①-②得C(s)→CO(g)的热化学方程式C(s)+O2(g)= CO(g) ΔH=-393.5+282.9=-110.6kJ·mol-1,可写成2C(s)+O2(g)= 2CO(g) ΔH=-221.2kJ·mol-1,故正确; D.燃烧热的单位为kJ·mol-1,故错误。 故选C。 3.下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是 A B C D 图示 相关 信息 温度计的水银柱不断上升 反应物总能量大于生成物总能量 反应开始后,甲处液面低于乙处液面 反应开始后,针筒活塞向右移动 A. A B. B C. C D. D 【答案】D 【解析】 【详解】A.盐酸和氢氧化钠发生中和反应,为放热反应,可观察到温度计水银柱不断上升,故A正确; B.从能量守恒的角度分析,反应物总能量大于生成物总能量,为放热反应,故B正确; C.反应开始后,甲处液面低于乙处液面,说明装置内压强增大,反应为放热反应,温度升高,压强增大,故C正确; D.硫酸和锌反应生成氢气,导致反应开始后针筒活塞向右移动,不能说明一定是反应放热,造成体积的膨胀,故D错误。 所以本题答案:选D。 4. 以下几个热化学方程式,哪个是表示碳或氢气燃烧热的 A. C(s)+O2(g)="==CO(g)" ΔH="110.5" kJ/mol B. C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol C. 2H2(g)+O2(g)="==2" H2O(l) ΔH=-571.6 kJ/mol D. H2(g)+O2(g)="==" H2O(g) ΔH=-241.8 kJ/mol 【答案】B 【解析】 试题分析:A、C燃烧生成稳定氧化物是CO2不是CO,所以不符合燃烧热的概念,错误;B、1molC完全燃烧生成稳定的CO2,符合燃烧热的概念,放出的热量为燃烧热,正确;C、燃烧热是指1mol纯净物完全燃烧,方程式中为2mol,不是燃烧热,错误;D、生成稳定的氧化物,水应为液态,错误。 考点:考查燃烧热的概念。 5.将2mol·L-1A气体和1mol·L-1B气体混合,并在一定条件下发生反应:2A(g)+B(g)2C(g),若经2s后测得C浓度为0.6mol·L-1,现有下列几种说法: ①用物质B表示的反应的平均速率为0.6mol·L-1·s-1 ②用物质A表示的反应的平均速率为0.3mol·L-1·s-1 ③2s时物质A的转化率为70% ④2s时物质B的浓度为0.7mol·L-1 其中正确的是( ) A. ① ③ B. ③ ④ C. ② ③ D. ② ④ 【答案】D 【解析】 【详解】2A(g)+B(g)2C(g) 初始 2 1 0 改变 0.6 0.3 0.6 2s后 1.4 0.7 0.6 ①用物质B表示的反应的平均速率为mol·L-1·s-1,故错误;②用物质A表示的反应的平均速率为mol·L-1·s-1,故正确;③2s时物质A的转化率为,故错误;④2s时物质B的浓度为0.7mol·L-1,故正确。 故选D。 【点睛】掌握有关平衡的三段式计算是关键。注意数据的单位。 6.一定温度下,向容积为2 L的密闭容器中通入两种气体,发生化学反应生成另外两种气体,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是 A. 该反应的化学方程式为3B(g)+4D(g)6A(g)+2C(g) B. 反应进行到1 s时,v(A)=v(D) C. 反应进行到6 s时,B平均反应速率为0.05 mol/(L·s) D. 反应进行到6 s时,各物质的反应速率相等 【答案】C 【解析】 分析】 当反应进行到6s时,反应达到平衡状态,根据0-6s时反应物与生成物浓度变化之比等于化学方程式中化学计量数之比,Δn(A)∶Δn(B)∶Δn(C)∶Δn(D)=(1.2-0)mol∶(1.0-0.4)mol∶(1.0-0.2)mol∶(0.4-0)mol=6∶3∶4∶2,又因为6s时各物质浓度均保持不变,因此该反应为可逆反应,所以化学方程式为3B(g)+4C(g)6A(g)+2D(g)。由此解题。 【详解】A. 根据分析可知,C应为反应物,D应为产物,A项错误; B. 任何时刻,各物质的反应速率之比等于化学计量数之比,因此=,B项错误; C. 反应进行到6 s时,B的平均反应速率v(B)===0.05 mol/(L·s),C项正确; D. 反应进行到6 s时,各物质的反应速率之比等于化学计量数之比,D项错误; 答案应选C。 7.密闭容器中有如下反应:L(s)+aG(g)bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( ) A. 正反应为放热反应 B. 增大L的质量,平衡正向移动 C. 化学方程式中的计量数a>b D. G的转化率随温度升高而减小 【答案】C 【解析】 【详解】A.随温度升高,G的体积分数减小,说明升温,平衡正向移动,则正反应为吸热反应,故错误; B.L为固体,增大其质量不能改变速率和平衡,故错误; C.在相同温度下,增大压强 ,G的体积分数减小,说明平衡正向移动,即有a>b,故正确; D.随温度升高,G的体积分数减小,说明转化率增大,故错误。 故选C。 【点睛】在有温度和压强两种变量时,一般是固定一个条件改变另一个。所以应分析在固定压强的条件下改变温度,G的体积分数变化,分析平衡移动方向和反应放热还是吸热。固定温度,分析在不同压强下G的体积分数变化,分析平衡移动方向和气体物质化学计量数的大小。查看更多