- 2021-07-08 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省高安中学 高一年级 化学期中复习试卷一(无答案)
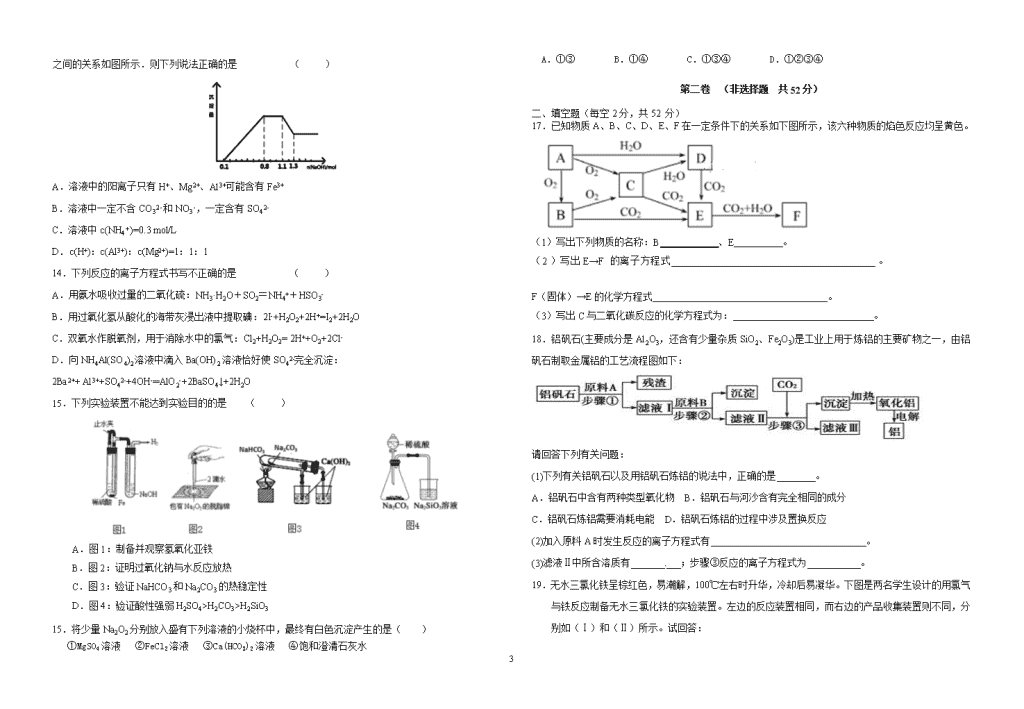
高一创新班期中复习题 (一) 第一卷 (选择题共48分) 一、选择题(本题共16小题,每小题3分,共48分,每小题只有一个选项符合题意) 1. 焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是( ) A.焰色反应是化学变化 B.用稀盐酸清洗做焰色反应的铂丝(铂丝或铁丝) C.焰色反应均应透过蓝色钴玻璃观察 D.利用焰色反应可区分NaC1与Na2CO3固体 2. 24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知元素Cr在产物中的化合价为+3 ,则Na2SO3反应后硫元素的化合价变为 ( ) A.+2 B.0 C.+4 D.+6 3. 设NA为阿伏加德罗常数的数值,下列说法正确的是( ) A.23 g Na与足量H2O反应完全后可生成NA个H2分子 B.1 mol Na2O2和足量CO2反应转移2 NA个电子 C.27g铝与足量氢氧化钠溶液反应失去3 NA个电子 D.3 mol单质Fe足量盐酸反应,失去9NA个电子 4. 将少量金属钠放入下列盛有足量溶液的小烧杯中(忽略温度的变化),既有气体生成,又有沉淀产生的是( ) ①MgSO4溶液 ②NaCl溶液 ③Na2SO4溶液 ④Ca(HCO3)2溶液 ⑤Al2(SO4)3溶液 ⑥CuSO4溶液 A. ①②④⑤ B. ③④⑤⑥ C. ①④⑤⑥ D. ②④⑤⑥ 5.铁在高温条件下与氧化铜反应:2Fe+3CuO 高温 Fe2O3+3Cu 铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2 ,一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液(表示为“甲”)于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙.下列判断正确的是( ) ①甲中含有FeCl3; ②甲中不含FeCl3;③若向固体丙加稀盐酸无明显现象,则滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2;④若向固体丙加稀盐酸有气体产生,则滤液乙中可能含有ZnCl2、FeCl2,一定不含有CuCl2. A.①③ B.②③ C .①④ D.②④ 6.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是( ) ①氢氧化铝加热能分解为金属氧化物和水;氢氧化镁、氢氧化铁也能加热分解生成金属氧化物和水 ②Fe露置在潮湿空气中一段时间后就会锈迹斑斑;性质更活泼的Al不能稳定存在于空气中 ③碳酸钠、碳酸氢钠溶液均显碱性;钠盐溶液均能使酚酞变红 ④钠和硫反应生成Na2S;镁、铝、铁均能与硫直接化合生成相应的硫化物 ⑤化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色 ⑥钠与水反应生成NaOH和H2;所有金属与水反应都生成对应碱和H2 A.①④⑤ B.①③⑥ C.②③⑥ D.①②③ 7. 将2.32 g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是( ) A.OA段发生反应的离子方程式为:H++OH-===H2O CO+H+===HCO B.A点溶液中的溶质为NaCl、NaHCO3 C.当加入45 mL盐酸时,产生CO2的体积为336mL D.混合物中NaOH的质量0.20 g 8.某溶液可能含有Cl-、SO、CO 、NH 、Fe3+、Al3+ 和K+ 。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀,过滤,洗涤,灼烧,得到 1.6 g固体;向上述滤液中加入足量BaCl2 溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( ) A.至少存在 5种离子 B.Cl- 一定存在,且 c(Cl-)≥0.4 mol/L C.SO 、NH一定存在,Cl- 可能不存在 D.CO 、Al3+ 一定不存在,K+可能存在 9.某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO、NO、OH- 4 。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是( ) A.Na+和NO来自同一工厂 B.Cl-和NO一定来自同一工厂 C.Ag+和Na+可能来自同一工厂 D.SO和OH-一定来自同一工厂 10.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是( ) A.Ca2+、K+、Cl-、SO32- B.NH4+、Fe2+、 I一、SO42- C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2—、K+ 11.下列离子方程式书写正确的是( ) ①.等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合 Ba2+ + 2OH – + NH4+ + HCO3 – = BaCO3↓+ NH3·H2O + H2O ②.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O = 4NH4+ + AlO2 – + 2H2O ③.向次氯酸钙溶液中通入过量的二氧化硫 Ca2+ + 2ClO – + SO2 + H2O = CaSO3↓+ 2HClO ④.已知等浓度的碳酸钠、次氯酸钠、碳酸氢钠PH逐渐减小,向次氯酸钠溶液通少量二氧化碳 ClO- +CO2 +H2O = HClO + CO32- ⑤.过氧化钠固体与水反应:2O22 ̄+2H2O=4OH ̄+O2↑ ⑥.氨水中通入过量二氧化硫:2NH3·H2O + SO2 = 2NH4+ +SO32 ̄ +H2O ⑦.澄清的石灰水中加人过量的NaHCO3溶液:Ca2++OH ̄+HCO3 ̄=CaCO3↓+H2O ⑧.将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合: 2Al3++7OH ̄=Al(OH)3↓+AlO2 ̄+2H2O ⑨、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O A.①③⑥⑨ B.②④⑤⑨ C.③④⑦⑧ D.①⑧⑨ 12.下列各组离子能在指定溶液中共存的是( ) ①无色溶液中:、、、、、 ②使pH试纸变深蓝的溶液中:、、、、、 ③水电离的c(H+)=1×10-12mol·L-1的溶液中:、、、、 ④加入Mg能放出的溶液中:、、、、 ⑤使甲基橙变红的溶液中:、、、、 ⑥pH=0的溶液中:、、、、、 A.①③ B.②④⑤ C.①②⑤ D.③⑥ 12.某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。为分析其组成,现进行如下实验: ①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。 ②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。 ③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解。 则下列说法正确的是( ) A.仅由实验①可推出肯定含有SO42-,不含Cl- B.该无色溶液肯定含有NH4+、K+、Al3+、SO42- C.该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- D.不能确定该无色溶液是否含有K+ 13.某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH 4 的物质的量之间的关系如图所示.则下列说法正确的是 ( ) A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ B.溶液中一定不含CO32-和NO3-,一定含有SO42- C.溶液中c(NH4+)=0.3 mol/L D.c(H+):c(Al3+):c(Mg2+)=1:1:1 14.下列反应的离子方程式书写不正确的是 ( ) A.用氨水吸收过量的二氧化硫:NH3·H2O+SO2=NH4++HSO3- B.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O C.双氧水作脱氧剂,用于消除水中的氯气:Cl2+H2O2= 2H++O2+2Cl- D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀: 2Ba2++ Al3++SO42-+4OH-═AlO2-+2BaSO4↓+2H2O 15.下列实验装置不能达到实验目的的是 ( ) A.图1:制备并观察氢氧化亚铁 B.图2:证明过氧化钠与水反应放热 C.图3:验证NaHCO3和Na2CO3的热稳定性 D.图4:验证酸性强弱H2SO4>H2CO3>H2SiO3 15.将少量Na2O2分别放入盛有下列溶液的小烧杯中,最终有白色沉淀产生的是( ) ①MgSO4溶液 ②FeCl2溶液 ③Ca(HCO3)2溶液 ④饱和澄清石灰水 A.①③ B.①④ C.①③④ D.①②③④ 第二卷 (非选择题 共52分) 二、填空题(每空2分,共52 分) 17.已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均呈黄色。 (1)写出下列物质的名称:B____________、E 。 (2)写出E→F的离子方程式__________________________________________。[来源:学#科#网Z#X#X#K] F(固体)→E的化学方程式____________________________________。 (3)写出C与二氧化碳反应的化学方程式为: 。 18.铝矾石(主要成分是Al2O3,还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下: 请回答下列有关问题: (1)下列有关铝矾石以及用铝矾石炼铝的说法中,正确的是________。 A.铝矾石中含有两种类型氧化物 B.铝矾石与河沙含有完全相同的成分 C.铝矾石炼铝需要消耗电能 D.铝矾石炼铝的过程中涉及置换反应 (2)加入原料A时发生反应的离子方程式有________________________________。 (3)滤液Ⅱ中所含溶质有__________;步骤③反应的离子方程式为___________。来源:Zxxk 19.无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。下图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答: 4 (1)A仪器的名称是 ; (2)B中反应的离子方程式为 ;其中浓盐酸表现出 性;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________。 (3)气体通过装置C的目的是 。 (4)D中的反应开始前,需进行的操作是 ,应采取的方法是 。 (5)D中发生反应的化学方程式为 。 (6)装置(Ⅰ)的主要缺点是 。 (7)装置(Ⅱ)中F中发生反应的化学方程式为 。如果选用(Ⅱ)装置来完成实验,则必须采取的改进措施是 。 20.已知有如下图所示转化关系(反应条件略)。 已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白: (1)Z是(写化学式):________。 (2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有________性。利用这种性质可以进行________项(填字母)实验操作。 A.钝化铁片 B.检验Ba2+ C.干燥氨气 D.干燥氯气 (3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________。 (4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的化学方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了________的问题。 (5)写出M与甲的浓溶液在加热条件下反应的化学方程式: ____________________________________________________________ ____________________________________________________________。 .Com 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 4查看更多