2018届一轮复习人教版原子结构与性质学案(6)
第十二章 物质结构与性质(选修3)
第一节 原子结构与性质
本节共设计1个学案
[高考导航]
1.了解原子核外电子的排布原理及能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子、价电子的排布。了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某些性质。
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
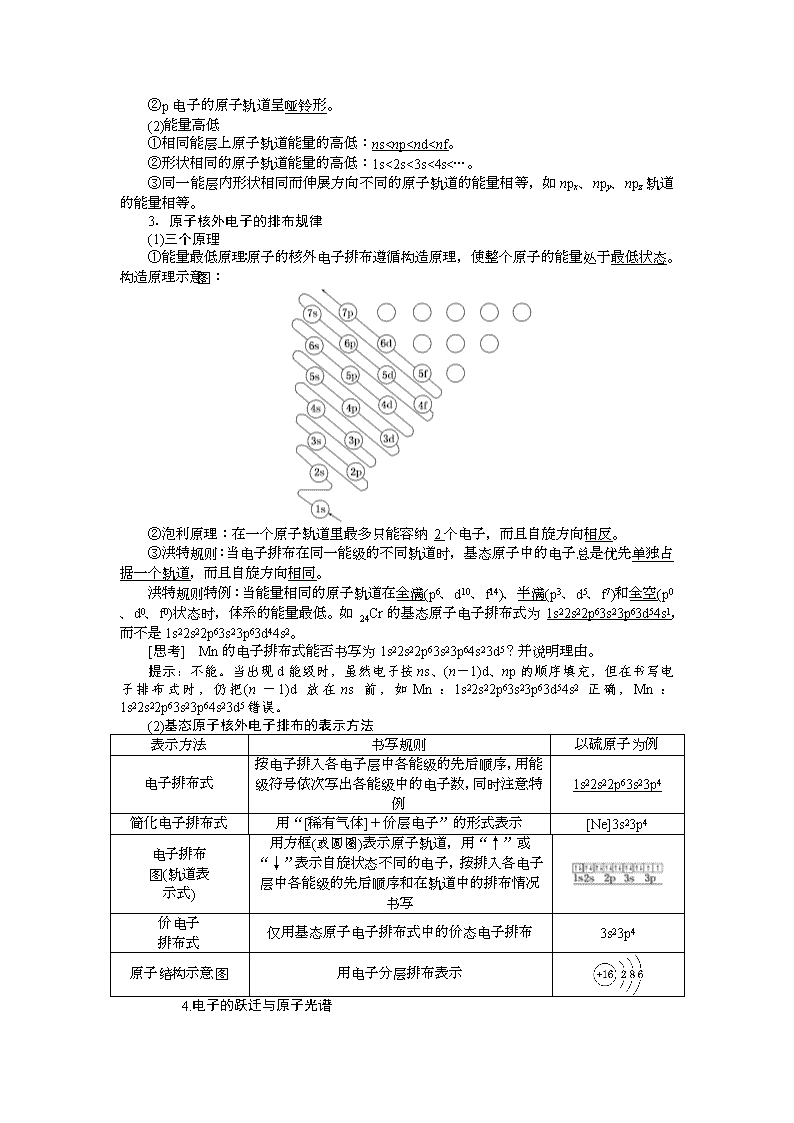
1.能层、能级、原子轨道和容纳电子数之间的关系
2.原子轨道的形状和能量高低
(1)轨道形状
①s电子的原子轨道呈球形。
②p电子的原子轨道呈哑铃形。
(2)能量高低
①相同能层上原子轨道能量的高低:ns
S>Se
[学案验收·块块过]
1.下列表示钠原子的式子中能反映能级差别和电子自旋状态的是( )
A. B.2311Na
C.1s22s22p63s1 D.
解析:选D 只有电子排布图才能反映出电子的自旋状态。
2.(2017·长治模拟)下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道且有一个未成对电子的基态原子和原子的价层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数 的原子和最外层电子排布式为4s24p5的原子
解析:选C A项,3p能级有一个空轨道的基态原子,按洪特规则可得其3p轨道上只能有两个电子,所以两个原子是同种元素的原子;B项,2p能级无空轨道且有一个未成对电子的基态原子,它的2p能级上只能是5个电子,所以两原子是同种元素的原子;C项,M层全充满而N层为4s2的原子,M层全充满则M层应为18个电子,而后者的M层上只有8个电子,所以两原子不是同种元素的原子;D项,最外层电子数是核外电子总数的 的原子中,最外层电子数要小于或等于8个电子,且电子总数为5的倍数,所以可得该原子可能是原子序数为5、10、15、20、25、30、35、40,其中满足最外层电子数是核外电子总数的 且符合核外电子排布规则的只能是35号元素,该元素原子的最外层电子排布式为4s24p5,所以两原子是同种元素的原子。
3.(2017·曲靖模拟)已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据表中所列数据判断,下列说法错误的是( )
元素
I1
I2
I3
I4
X
500
4 600
6 900
9 500
Y
580
1 820
2 750
11 600
A.元素X的常见化合价是+1价
B.元素Y是第ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
解析:选D 由数据分析X中I2≫I1,X易呈+1价,为第ⅠA族元素,A、C均正确;Y中I4≫I3,易呈+3价,应在第ⅢA族,B正确;若Y处于第三周期,则Y为铝元素,Al不与冷水反应,D错误。
4.下列关于元素第一电离能的说法不正确的是( )
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能依次增大
C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D.对于同一元素而言,原子的电离能I1”或“<”填空:
第一电
离能
离子半径
熔点
酸性
Si____S
O2-____Na+
NaCl____Si
H2SO4____HClO4
(6)下列微粒中基态原子的电子排布中未成对电子数最多的是________(填字母)。
a.H b.N c.Cu d.Cr e.C
(7)Ga与B同主族,Ga的基态原子核外电子排布式为____________。B、C、O三元素的第一电离能由大到小的顺序是__________。
答案:(1)1s22s22p63s23p63d84s2或[Ar] 3d84s2 2
(2)第4周期第ⅤB族
(3)1s22s22p63s23p63d3(或[Ar]3d3)
(4)1s22s22p63s23p63d10
(5)①三 ⅠA 2 1s22s22p63s23p2 ②< > < <
(6)d (7)1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
O>C>B
6.(2017·江门模拟)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素;A和E属同一族,它们原子最外层电子排布为ns1,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子最外层上电子数等于D原子最外层上电子数的一半。
请回答下列问题:
(1)A是__________,B是__________,C是__________,
D是__________,E是__________。
(2)由这五种元素组成的一种化合物是________(写化学式)。写出该物质的一种主要用途:________________________________________________________________________。
(3)写出C元素基态原子的电子排布式:_________________________________。
(4)用电子排布图表示D元素原子的价电子排布:_______________________________。
(5)元素B与D的电负性大小关系是B________D,C与E的第一电离能的大小关系是C________E。(填“>”、“<”或“=”)
解析:A、B、C、D、E 5种元素核电荷数都小于20,故都为主族元素,A、E同一族且最外层电子排布为ns1,故为第ⅠA族,而A为非金属元素,则A为H;B、D为同一族,其原子最外层的p能级电子数是s能级电子数的两倍,故其最外层电子排布为ns2np4,为第
ⅥA族元素,B核电荷数小于D,则B为O,D为S,E为K;C原子最外层上的电子数为S原子最外层上电子数的一半,则C为Al,同主族元素自上而下电负性逐渐减小,故B(O)的电负性大于D(S),E(K)的第一电离能小于Na,Na的第一电离能小于C(Al),故第一电离能Al>K。
答案:(1)H O Al S K(写元素名称也可)
(2)KAl(SO4)2·12H2O 作净水剂
(3)1s22s22p63s23p1 (4)
(5)> >
7.如图为周期表中部分元素的某种性质(X值)随原子序数变化的关系。
(1)短周期中原子核外p轨道上电子数与s轨道上电子总数相等的元素是________(写元素符号)。
(2)同主族内不同元素的X值变化的特点是_____________________________,
同周期内,随着原子序数的增大,X值变化的总趋势是____________________。周期表中X值的这种变化特点体现了元素性质的________________________________________________________________________
______________________变化规律。
(3)X值较小的元素集中在元素周期表的________。
a.左下角 b.右上角 c.分界线附近
(4)下列关于元素该性质的说法中正确的是______(选填代号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值大小可用来衡量元素金属性和非金属性的强弱
答案:(1)O、Mg (2)同一主族,从上到下,X值逐渐减小 逐渐增大 周期性 (3)a (4)b、c
8.下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有____________________________________________________________(填元素名称)。
(2)写出Cr3+的电子排布式:__________________________________________。
(3)Fe3+的化学性质比______________________________。
(4)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有________种。
(5)试比较:第一电离能I1(Cr)________I1(Co)(填“>”、“<”或“=”)。
解析:(1)由核外电子排布轨道能量顺序可知,4s轨道只有1个电子,则3d轨道可能为0(全空)、5(半充满)、10(全充满),则有1s22s22p63s23p64s1、1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1,分别为钾、铬、铜。(2)Cr失去3个电子生成Cr3+,则电子排布式为1s22s22p63s23p63d3。(3)Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6
,半充满结构更稳定。(4)分周期一一讨论,第一周期中基态原子中未成对电子数为1个的是H元素,第二周期中基态原子中未成对电子数为2个的可以是1s22s22p2或1s22s22p4,是C元素或O元素,第三周期中基态原子中未成对电子数为3个的是1s22s22p63s23p3,为P元素,第四周期中基态原子中未成对电子数为4个的只能是过渡元素,符合条件的只有Fe元素,其核外电子排布式为1s22s22p63s23p63d64s2,因此共有5种元素符合题意。(5)铬元素的价电子排布式为3d54s1,钴元素的价电子排布为3d74s2,前者第一电离能更小。
答案:(1)钾、铬、铜 (2)1s22s22p63s23p63d3(或[Ar]3d3)
(3)Fe3+的3d轨道填充了5个电子,为半充满状态
(4)5 (5)<
9.(2017·乐山调研)原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同:D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25。
(1)F基态原子的核外电子排布式为______________________________________。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是________(用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是________________________________________________________________________。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为________________________________________________________________________。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为________。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为__________。
解析:原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等,A为C元素,A的基态原子,2p能级上的未成对电子数为2,C的基态原子2p能级上的未成对电子数与A原子的相同,那么C是O元素,B是N元素,D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25,可以推出E为S元素,D为Na元素,F为Mn元素。(1)F基态原子的核外电子排布式为[Ar]3d54s2或1s22s22p63s23p63d54s2;(2)C、N、O三种元素中第一电离能由小到大的顺序为C、O、N;(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,是由于NH3分子之间可以形成氢键,而CH4分子间没有氢键;(4)已知CO2为直线型分子,C原子和每一个氧原子之间以双键相连接,由A、B、C形成的离子CAB-与AC2互为等电子体,所以NCO-也为直线型,C与N和C与O原子之间以双键相连,故结构式为[N===C===O]-;(5)元素A与E所形成的常见化合物为CS2,C与S原子间为双键,所以C的价层电子对数为2,则C原子采取sp杂化;(6)Na在棱边上,用均摊法可以算出Na+的个数为8×=2,NO可以当成一个整体看,NO主要位于顶点和体心,用均摊法计算得NO的个数为1+8×=2,所以化学式为NaNO2。
答案:(1)1s22s22p63s23p63d54s2 (2)C、O、N 或C
查看更多