2020届高考化学二轮复习化学平衡化学平衡移动学案
【知识精讲】
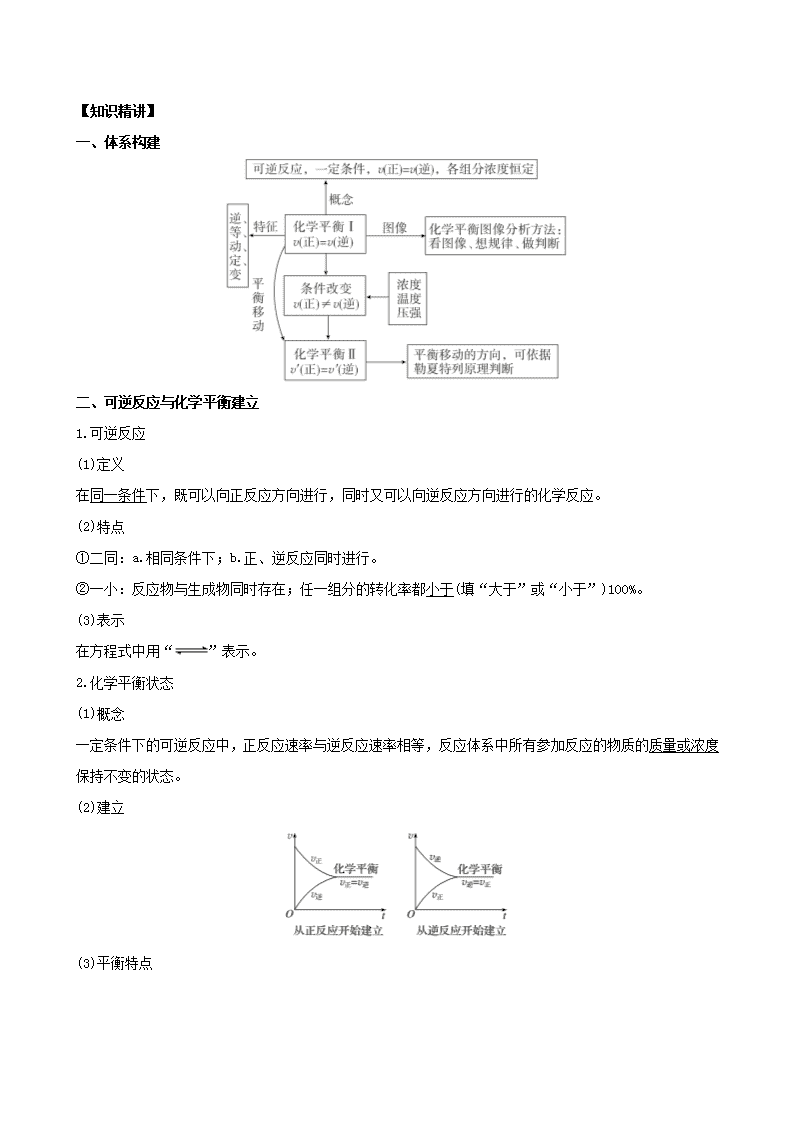
一、体系构建
二、可逆反应与化学平衡建立
1.可逆反应
(1)定义
在同一条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点
①二同:a.相同条件下;b.正、逆反应同时进行。
②一小:反应物与生成物同时存在;任一组分的转化率都小于(填“大于”或“小于”)100%。
(3)表示
在方程式中用“ ”表示。
2.化学平衡状态
(1)概念
一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度
保持不变的状态。
(2)建立
(3)平衡特点
3.判断化学平衡状态的两种方法
(1)动态标志:v 正=v 逆≠0
①同种物质:同一物质的生成速率等于消耗速率。
②不同物质:必须标明是“异向”的反应速率关系。如 aA+bB cC+dD,
v正A
v逆B=
a
b时,反应达到平
衡状态。
(2)静态标志:各种“量”不变
①各物质的质量、物质的量或浓度不变。
②各物质的百分含量(物质的量分数、质量分数等)不变。
③温度、压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变。
总之,若物理量由变量变成了不变量,则表明该可逆反应达到平衡状态;若物理量为“不变量”,则不能
作为平衡标志。
三、化学平衡移动
1.化学平衡移动的过程
2.化学平衡移动与化学反应速率的关系
(1)v 正>v 逆:平衡向正反应方向移动。
(2)v 正=v 逆:反应达到平衡状态,不发生平衡移动。
(3)v 正<v 逆:平衡向逆反应方向移动。
3.影响化学平衡的因素
(1)若其他条件不变,改变下列条件对化学平衡的影响如下:
改变的条件(其他条件不变) 化学平衡移动的方向
增大反应物浓度或减小生成物浓度 向正反应方向移动
浓度
减小反应物浓度或增大生成物浓度 向逆反应方向移动
压强(对有气体 反应前后气体体积改变 增大压强 向气体分子总数减小的方向移动
减小压强 向气体分子总数增大的方向移动参加的反应)
反应前后气体体积不变 改变压强 平衡不移动
升高温度 向吸热反应方向移动
温度
降低温度 向放热反应方向移动
催化剂 同等程度改变 v 正、v 逆,平衡不移动
(2)勒夏特列原理
如果改变影响化学平衡的条件之一(如温度、压强以及参加反应的物质的浓度),平衡将向着能够减弱这种
改变的方向移动。
(3)“惰性气体”对化学平衡的影响
①恒温恒容条件
原平衡体系 ― ― ― ― ― ― →充入惰性气体
体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温恒压条件
原平衡体系 ― ― ― ― ― ― →充入惰性气体
容器容积增大,各反应气体的分压减小―→
体系中各组分的浓度同倍数减小
(等效于减压)
四、等效平衡
1.等效平衡的含义
在一定条件下(恒温恒容或恒温恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,
还是正、逆反应同时投料,达到化学平衡状态时,任何相同组分的百分含量(质量分数、物质的量分数、
体积分数等)均相同。
2.等效平衡的判断方法
(1)恒温恒容条件下反应前后体积改变的反应
判断方法:极值等量即等效。
例如:2SO2(g)+O2(g) 2SO3(g)
① 2 mol 1 mol 0
② 0 0 2 mol
③ 0.5 mol 0.25 mol 1.5 mol
④ a mol b mol c mol
上述①②③三种配比,按化学方程式的化学计量关系均转化为反应物,则 SO2 均为 2 mol,O2 均为 1 mol,
三者建立的平衡状态完全相同。
④中 a、b、c 三者的关系满足:c+a=2,
c
2+b=1,即与上述平衡等效。
(2)恒温恒压条件下反应前后体积改变的反应
判断方法:极值等比即等效。
例如:2SO2(g)+O2(g) 2SO3(g)
① 2 mol 3 mol 0
② 1 mol 3.5 mol 2 mol
③ a mol b mol c mol
按化学方程式的化学计量关系均转化为反应物,则①②中
nSO2
nO2 =
2
3,故互为等效平衡。
③中 a、b、c 三者关系满足:
c+a
c
2+b
=
2
3,即与①②平衡等效。
(3)恒温条件下反应前后体积不变的反应
判断方法:无论是恒温恒容,还是恒温恒压,只要极值等比即等效,因为压强改变对该类反应的化学平衡
无影响。
例如:H2(g)+I2(g) 2HI(g)
① 1 mol 1 mol 0
② 2 mol 2 mol 1 mol
③ a mol b mol c mol
①②两种情况下,n(H2)∶n(I2)=1∶1,故互为等效平衡。
③中 a、b、c 三者关系满足(c
2+a )∶(c
2+b )=1∶1 或 a∶b=1∶1,c≥0,即与①②平衡等效。
3.虚拟“中间态”法构建等效平衡
(1)构建恒温恒容平衡思维模式
新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)
新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。
【典题精练】
考点 1、考查可逆反应的特点
6.一定条件下,对于可逆反应 X(g)+3Y(g) 2Z(g),若 X、Y、Z 的起始浓度分别为 c1、c2、c3(均不
为零),达到平衡时,X、Y、Z 的浓度分别为 0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断
正确的是( )
A.c1:c2=3:1
B.平衡时,Y 和 Z 的生成速率之比为 2:3
C.X、Y 的转化率相等
D.c1 的取值范围为 0
v(逆),②⑤
正确;平衡正向移动,反应物的转化率不一定增大,如 2SO2+O2 2SO3,增加 O2 的量,SO2 转化率增大,
而 O2 的转化率减小,③错误;若缩小体积,增大压强,反应物浓度会增大,④错误;加入催化剂平衡不移
动,⑥错误。综上所述,B 项正确。
答案:B
思维建模:判断化学平衡移动方向的思维模型
考点 4、考查等效平衡的应用
例 4.一定温度下,在 3 个容积均为 1.0 L 的恒容密闭容器中反应 2H2(g)+CO(g) CH3OH(g)达到平衡,
下列说法正确的是( )
物质的起始浓度/mol·L-1
物质的平衡浓度/mol·L-
1容器 温度/K
c(H2) c(CO) c(CH3OH) c(CH3OH)
Ⅰ 400 0.20 0.10 0 0.080
Ⅱ 400 0.40 0.20 0
Ⅲ 500 0 0 0.10 0.025
A.该反应的正反应吸热
B.达到平衡时,容器Ⅰ中反应物的转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中 c(H2)大于容器Ⅲ中 c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
解析:对比容器Ⅰ和Ⅲ可知两者投料量相当,若温度相同,最终建立等效平衡,但Ⅲ温度高,平衡时 c(CH3OH)
小,说明平衡向逆反应方向移动,即逆反应为吸热反应,正反应为放热反应,A 错误;Ⅱ相对于Ⅰ成比例
增加投料量,相当于加压,平衡正向移动,转化率提高,所以Ⅱ中转化率高,B 错误;不考虑温度,Ⅱ中
投料量是Ⅲ的两倍,相当于加压,平衡正向移动,所以Ⅱ中 c(H2)小于Ⅲ中 c(H2)的两倍,C 错误;对比Ⅰ
和Ⅲ,若温度相同,两者建立等效平衡,两容器中速率相等,但Ⅲ温度高,速率更快,D 正确。
答案:D
练后归纳:两平衡状态间要互为等效应满足四点:
①同一条件;②同一可逆反应;③仅仅由于初始投料不同(即建立平衡的方向可以不同);④平衡时相应物
质在各自平衡体系中的体积分数(或物质的量分数)相同。
考点 5、考查勒夏特列原理的应用
例 5.下列实验事实不能用平衡移动原理解释的是( )
A.
解析:本题考查化学平衡移动原理的应用。A 项中 NO2 球中存在 2NO2 N2O4,ΔH<0,正反应放热,NO2
球放入冷水,颜色变浅,NO2 球放入热水,颜色变深,可以用平衡移动原理解释,A 项错误;根据 B 中表格
的数据,温度升高,KW 增大,则水的电离是吸热反应,能用平衡移动原理解释,B 项错误;H2O2 溶液加 MnO2
是为了加快化学反应速率,MnO2 作催化剂,C 项正确;氨水中存在电离平衡 NH3·H2ONH+4 +OH-,随着
氨水浓度降低,氨水电离程度增大,可以用平衡移动原理解释,D 项错误。
答案:C
易错提醒:1.对于溶液中的离子反应,向溶液中加入与实际反应无关的离子,平衡不移动。
2.溶液中的可逆反应,达平衡后加水稀释,平衡向溶质微粒数增多的方向移动。
3.改变固体或纯液体的量,对平衡无影响。
4.当反应混合物中不存在气态物质时,压强的改变对平衡无影响。
5.对于反应前后气体体积无变化的反应,如 H2(g)+I2(g) 2HI(g),压强的改变对平衡无影响。但增
大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。
6.“惰性气体”对化学平衡的影响
①恒温、恒容条件
原平衡体系 ― ― →
充入惰性气体
体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系 ― ― →
充入惰性气体
容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小(等效
于减压)
考点 6、考查化学平衡图像分析
例 6.根据下列有关图象,说法正确的是( )
A.由图甲知,反应在 T1,T3 处达到平衡,且该反应的 ΔH<0
B.由图乙知,反应在 t6 时,NH3 体积分数最大
C.由图乙知,t3 时采取降低反应温度的措施
D.图丙在 10 L 容器、850 ℃,反应到 4 min 时,放出 51.6 kJ 的热量
解析:由图甲可知,T2 时处于化学平衡状态,升高温度,Z%减少,X%增多,所以 ΔH<0,A 错误;由图乙
可知,反应自 t3 开始一直在向逆反应方向移动,所以 t6 时 NH3 的体积分数最小,B 错误;由图乙可知,t3
时如果降低温度,平衡向正反应方向移动,则 v 正>v 逆,C 错误;由图丙可知,反应进行到 4 min 时,消耗
的反应物的物质的量为 0.12 mol·L-1×10 L=1.2 mol,所以放出的热量为 51.6 kJ,D 正确。
答案:D
练后总结:解答化学平衡图像题的思路、步骤与技巧
1.解题思路
2.解题步骤
3.解题技巧
(1)先拐先平数值大。在含量—时间曲线中,先出现拐点的则先达到平衡,说明该曲线表示的温度较高或
压强较大。
(2)定一议二。图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。即确定横坐标所表示
的量后,讨论纵坐标与曲线的关系;或确定纵坐标所表示的量后(通常可画一垂线),讨论横坐标与曲线的
关系。
(3)三步分析法。一看反应速率是增大还是减小;二看 v 正、v 逆的相对大小;三看化学平衡移动的方向。
考点 7、考查化学平衡原理在工农业生产中的应用
例 7.合成氨工业中,原料气(N2、H2 及少量 CO、NH3 的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液
来吸收原料气中的 CO,其反应是 Cu(NH3)2CH3COO+CO+NH3 Cu(NH3)3CH3COO·CO ΔH<0。
(1)必须除去原料气中 CO 的原因是_______________。
(2)醋酸二氨合铜(I)吸收 CO 的生产适宜条件应是________。
(3)吸收 CO 后的醋酸二氨合铜溶液经过适当处理又可再生,恢复其吸收 CO 的能力以供循环使用。醋酸二
氨合铜溶液再生的生产适宜条件应是________。
解析:合成氨的流程中的除杂,是为了除去能使催化剂中毒的物质。题中指出:在合成氨的过程中必须除
去 CO,因此 CO 是属于使催化剂中毒的物质。从吸收 CO 的化学方程式可得:吸收 CO 的反应是正反应为气
体体积缩小的放热反应,因此为了使 CO 尽最大可能地被吸收,应采取高压、低温的办法使平衡正向移动,
要使醋酸二氨合铜(I)溶液再生,即使平衡逆向移动,故必须采取低压、高温的办法。
答案:(1)防止 CO 使催化剂中毒 (2)低温、高压 (3)高温、低压
练后归纳:工农业生产中平衡类问题需综合考虑的几个方面
(1)原料的来源、除杂,尤其考虑杂质对平衡的影响。
(2)原料的循环利用。
(3)产物的污染处理。
(4)产物的酸碱性对反应的影响。
(5)气体产物的压强对平衡造成的影响。
(6)改变外界条件对多平衡体系的影响。
【名校新题】
1.(2019·辉县市第一高级中学高考模拟)下面是某化学研究小组探究外界条件对化学反应速率和化学平
衡影响的图像,其中图像和实验结论表达均正确的是
A.①是其他条件一定时,反应速率随温度变化的图像,正反应 ΔH<0
B.②是在平衡体系的溶液中溶入少量 KCl 晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a 是使用催化剂时的曲线
D.④是一定条件下,向含有一定量 A 的容器中逐渐加入 B 时的图像,压强 p1>p2
【答案】C
【解析】A.根据图象知,升高温度,平衡向正反应方向移动,则正反应的△H>0,故 A 错误;B.该反应
实质为 Fe3++3SCN-⇌Fe(SCN)3,钾离子和氯离子不参加反应,则 KCl 浓度增大不影响化学平衡移动,故 B
错误;C.使用催化剂,反应速率加快,缩短反应时间,所以先达到平衡状态,故 C 正确;D.该反应前后
气体的物质的量不变,改变压强不影响平衡状态,即不影响 A 的转化率,由于不断加入 B,A 的转化率增
大,故 D 错误。故选 C。
2.(2019·山东师范大学附中高考模拟)下图所示为工业合成氨的流程图。有关说法错误的是
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C.步骤③、④、⑤均有利于提高原料平衡的转化率
D.产品液氨除可生产化肥外,还可用作制冷剂
【答案】C
【解析】A 项:合成氨使用含铁催化剂,为防止催化剂中毒,须将原料“净化”处理,A 项正确;B 项:步
骤②中“加压”,可增大氮气、氢气浓度,加快合成氨反应速率又能使平衡右移,提高原料转化率,B 项正
确;C 项:合成氨反应放热,步骤③使用较高温度不利于提高原料转化率,同时使用催化剂也不能使平衡
移动,步骤④、⑤能有利于提高原料的转化率,故 C 项错误;D 项:产品液氨可用酸吸收生成铵态氮肥。
液氨汽化时会吸收大量热,可用作制冷剂,D 项正确。本题选 C。
3.(2019·山东高三期末)在一定条件下 A2 和 B2 可发生反应:A2(g)+3B2(g) 2AB3(g)。图 1 表示
在一定温度下此反应过程中的能量变化,图 2 表示在固定容积为 2L 的密闭容器中反应时 A2 的物质的量随
时间变化的关系,图 3 表示在其他条件不变的情况下,改变反应物 B2 的起始物质的量对此反应平衡的影响。
下列说法错误的是
A.该反应在低于某一温度时能自发进行
B.10min 内该反应的平均速率 v(B2)=0.045mol/(L·min)
C.11min 时,其他条件不变,压缩容器容积至 1L,n(A2)的变化趋势如图 2 中曲线 d 所示
D.图 3 中 T1△H , 即 △G>0 , 反 应 不 能 自 发 进 行 , A 正 确 ; B.10min 内 该 反 应 的 平 均 速 率 v(A2)=
mol/(L·min),根据方程式可知 v(B2)=3v(A2)=0.045mol/(L·min),B 正确;C.11min
时,其他条件不变,压缩容器容积至 1L,由于物质的浓度增大,化学平衡正向移动,不断消耗 A2,所以 n(A2)
的物质的量会进一步减少,n(A2)变化趋势如图 2 中曲线 d 所示,C 正确;D.在温度不变时,增大某种反应
物的浓度,化学平衡正向移动,可以使其它反应物的转化率提高,故当 T10,且 a=1.5
D. 若 图 4 表 示 常 温 下 用 0.1000mo1/L NaOH 溶 液 滴 定 25.00mL CH3COOH 溶 液 的 滴 定 曲 线 , 则
c(CH3COOH)=0.1000mo1/L
【答案】C
【解析】A. 由图 1 可知第 I 步比第Ⅱ步活化能高,因此反应②的第 I 步比第Ⅱ步反应速率慢,A 错误;B.
若图 2 为 1 mL pH=2 某一元酸溶液加水稀释时 pH 随溶液总体积的变化曲线,根据图像可知稀释 100 倍时
pH<4,则说明该酸是弱酸,B 错误;C. 由图 3 知温度越高,平衡时 C 的体积分数越大,这说明升高温度
平衡向正反应方向进行,ΔH>0。A 和 B 按照化学计量数比反应平衡时 C 的体积分数最大,因此反应 3A(g)
+2B(g) 2C(g)的 ΔH>0,且 a=1.5,C 正确;D. 恰好反应时溶液显碱性,因此根据图 4 无法计算
醋酸的浓度,D 错误;答案选 C。
13.(2019·山东高考模拟)氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染
有重要意义。回答下列问题:
(1)已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
写出 NO 与臭氧(O3)反应生成 NO2 的热化学方程式______________________。
(2)温度为 T1 时,在三个容积均为 1L 的密闭容器中仅发生反应:2NO(g)+O2(g) 2NO2(g) △H<0
实验测得:v 正=v(NO)消耗= 2v(O2) 消耗= k 正 c2(NO)·c(O2),v 逆=v(NO2) 消耗= k 逆 c2 (NO2),k 正、k 逆为速率常
数,受温度影响。
①温度为 T1 时, k 正/k 逆=___________;当温度升高为 T2 时,k 正、k 逆分别增大 m 倍和 n 倍,则
m___________n(填“>”、“<“或“=”)。
②若容器Ⅱ中达到平衡时 c(NO2)/c(NO)=1,则 NO 的转化率为___________,x=___________。
③容器Ⅲ中起始时 v 正___________v 逆(填“>”、“<”或“=”),理由是___________。
④T1 时,在 1L 密闭容器中按照一定比例充入 NO(g)和 O2(g),达到平衡时 NO2(g)的体积分数 Φ(NO2)随
n(NO)/n(O2)的变化如图所示,则 A、B、C 三点中 NO 的转化率最大的是___________;当 n(NO)/n(O2)=2.3
时,达到平衡时 Φ(NO2)可能是 D、E、F 三点中的___________。
【答案】(1)3NO(g)+O3(g)=3NO2(g) △H=-317.3kJ·mol-1 (2)①1.25 < ②20% 0.85 ③
< 因为 Qc=0.22/0.32×0.25=1.78>K=1.25,反应向逆反应方向进行,所以 v 正K =1.25,反应向逆反应方向进行,所以 v
正K=1.25,反应向逆反应方向进行,所以 v 正
查看更多