- 2021-07-08 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黄冈第一轮化学_第四章碱金属
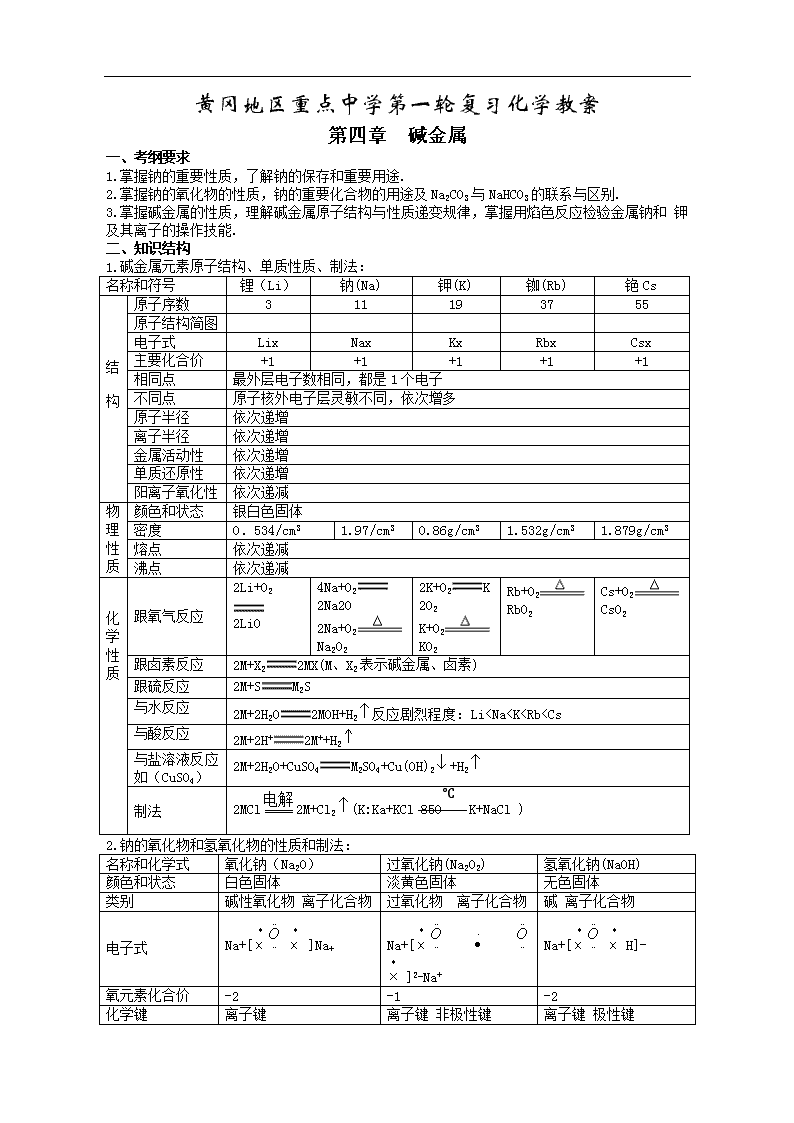
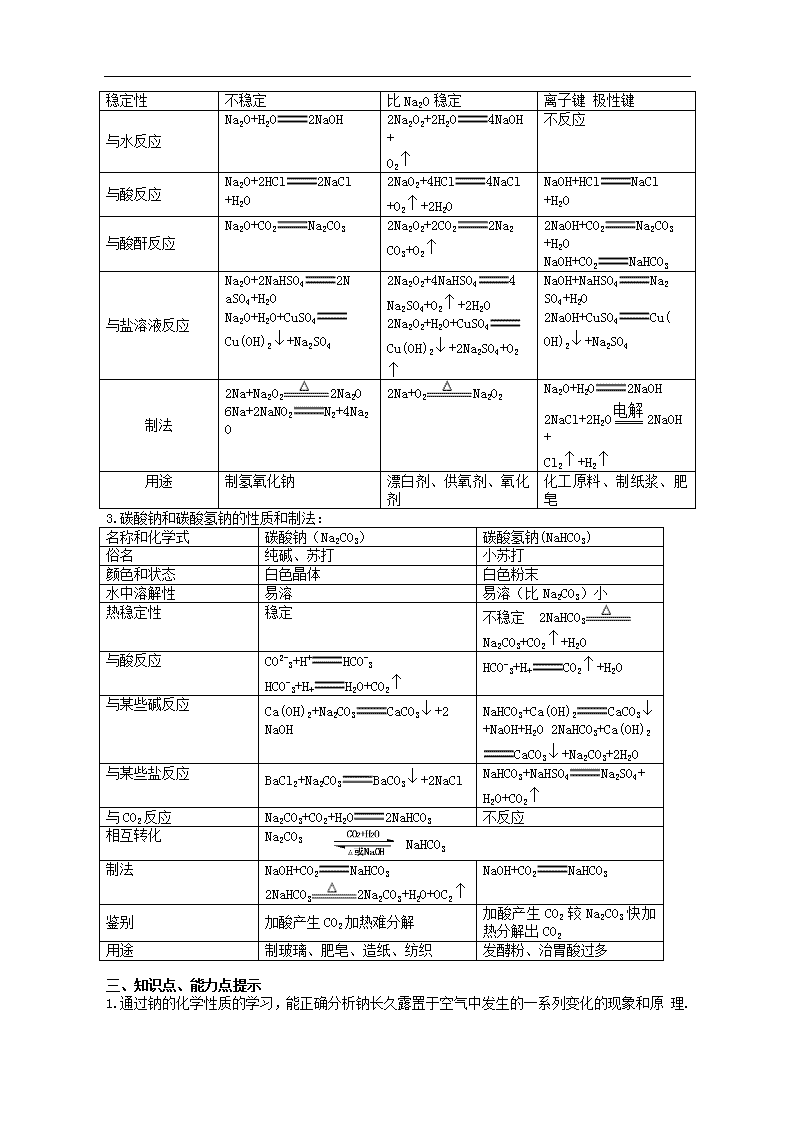
黄冈地区重点中学第一轮复习化学教案 第四章 碱金属 一、考纲要求 1.掌握钠的重要性质,了解钠的保存和重要用途. 2.掌握钠的氧化物的性质,钠的重要化合物的用途及Na2CO3与NaHCO3的联系与区别. 3.掌握碱金属的性质,理解碱金属原子结构与性质递变规律,掌握用焰色反应检验金属钠和 钾及其离子的操作技能. 二、知识结构 1.碱金属元素原子结构、单质性质、制法: 名称和符号 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯Cs 结 构 原子序数 3 11 19 37 55 原子结构简图 电子式 Lix Nax Kx Rbx Csx 主要化合价 +1 +1 +1 +1 +1 相同点 最外层电子数相同,都是1个电子 不同点 原子核外电子层灵敏不同,依次增多 原子半径 依次递增 离子半径 依次递增 金属活动性 依次递增 单质还原性 依次递增 阳离子氧化性 依次递减 物理性质 颜色和状态 银白色固体 密度 0.534/cm3 1.97/cm3 0.86g/cm3 1.532g/cm3 1.879g/cm3 熔点 依次递减 沸点 依次递减 化学性 质 跟氧气反应 2Li+O2 2LiO 4Na+O2 2Na2O 2Na+O2 Na2O2 2K+O2K 2O2 K+O2 KO2 Rb+O2 RbO2 Cs+O2 CsO2 跟卤素反应 2M+X22MX(M、X2表示碱金属、卤素) 跟硫反应 2M+SM2S 与水反应 2M+2H2O2MOH+H2反应剧烈程度:Li查看更多
相关文章
- 当前文档收益归属上传用户