- 2021-07-08 发布 |
- 37.5 KB |
- 26页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021高三化学人教版一轮学案:第三章 第三节 铁及其化合物 Word版含解析
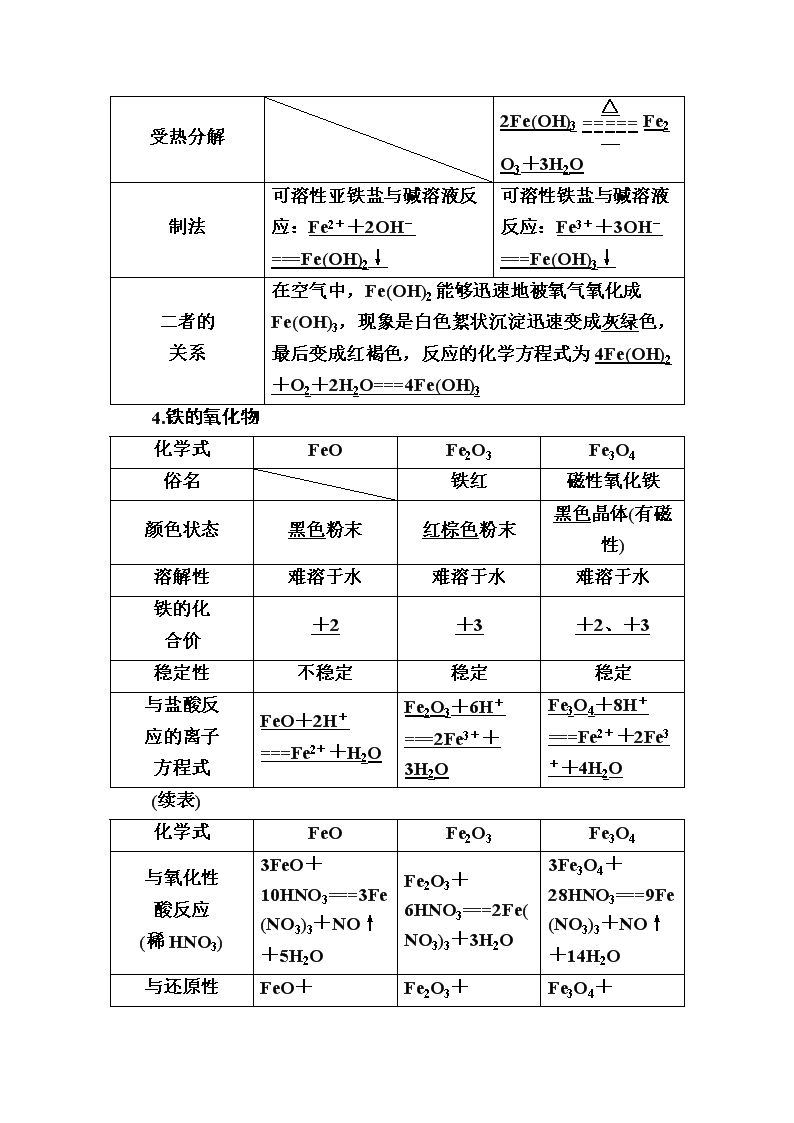
www.ks5u.com 第三节 铁及其化合物 最新考纲:1.掌握铁及其重要化合物的主要性质。2.掌握铁及其重要化合物的应用。3.了解常见金属及其重要化合物的制备方法。 核心素养:1.宏观辨识与微观探析:认识铁及其化合物的性质,能以Fe2+、Fe3+的相互转化为例,理解变价金属元素的氧化还原反应实质。2.科学探究与创新意识:能发现和提出有探究价值的氢氧化亚铁的制备探究方案,进行实验探究。 知识点一 铁及其氧化物、氢氧化物 1.铁的存在 2.铁的性质 (1)物理性质 颜色状态 导电、导热性、延展性 特性 地壳含量 银白色固体 良好 被磁铁吸引 占第4位 (2)化学性质(写出化学方程式或离子方程式) ①与非金属反应 与O2反应 常温 铁锈(成分为Fe2O3·xH2O) 点燃 3Fe+2O2Fe3O4 与Cl2反应 点燃 2Fe+3Cl22FeCl3 与S、I2反应 Fe+SFeS、Fe+I2FeI2 ②与H2O(g)反应 3Fe+4H2O(g)Fe3O4+4H2 ③与酸反应 与H+反应 Fe+2H+===Fe2++H2↑ 与稀HNO3 反应 HNO3 过量 Fe+4H++NO===Fe3++NO↑+2H2O HNO3 少量 3Fe+8H++2NO===3Fe2++2NO↑+4H2O 与浓H2SO4、 浓HNO3反应 常温下钝化,加热分别生成SO2、NO2 ④与盐(Cu2+、Fe3+)反应 Fe+Cu2+===Fe2++Cu、Fe+2Fe3+===3Fe2+ 3.铁的氢氧化物 Fe(OH)2 Fe(OH)3 颜色 状态 白色固体 红褐色固体 与盐酸 反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O 与氧化性 酸反应 (稀HNO3) 3Fe(OH)2+10HNO3(稀)===3Fe(NO3)3+NO↑+8H2O Fe(OH)3+3H+===Fe3++3H2O 与还原性 酸(HI)反 应 Fe(OH)2+2HI===FeI2+2H2O 2Fe(OH)3+6HI===2FeI2+I2+6H2O 受热分解 2Fe(OH)3Fe2O3+3H2O 制法 可溶性亚铁盐与碱溶液反应:Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应:Fe3++3OH-===Fe(OH)3↓ 二者的 关系 在空气中,Fe(OH)2能够迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应的化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3 4.铁的氧化物 化学式 FeO Fe2O3 Fe3O4 俗名 铁红 磁性氧化铁 颜色状态 黑色粉末 红棕色粉末 黑色晶体(有磁性) 溶解性 难溶于水 难溶于水 难溶于水 铁的化 合价 +2 +3 +2、+3 稳定性 不稳定 稳定 稳定 与盐酸反 应的离子 方程式 FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O Fe3O4+8H+===Fe2++2Fe3++4H2O (续表) 化学式 FeO Fe2O3 Fe3O4 与氧化性 酸反应 (稀HNO3) 3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O Fe2O3+6HNO3===2Fe(NO3)3+3H2O 3Fe3O4+28HNO3===9Fe(NO3)3+NO↑+14H2O 与还原性 Fe2O3 Fe3O4 酸反应 (如HI) FeO+2HI===FeI2+H2O +6HI===2FeI2+I2+3H2O +8HI===3FeI2+I2+4H2O 与还原 剂反应 FeO+COFe+CO2 Fe2O3+3CO2Fe+3CO2 Fe3O4+4CO3Fe+4CO2 判断正误(正确的打“√”,错误的打“×”) 1.铁位于元素周期表中第四周期第ⅧB族( × ) 提示:周期表中不存在第ⅧB族。 2.氧化铁能与酸反应,所以可用于制作红色染料( × ) 提示:氧化铁作红色燃料与其颜色有关,而与其化学性质无关。 3.根据铁与Cl2、S反应的条件可以判断氯元素和硫元素的非金属性强弱( × ) 提示:铁与氯气在点燃条件下反应生成氯化铁,铁与硫加热反应生成硫化亚铁,根据反应产物可判断硫元素和氯元素非金属性的强弱。 4.铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在( × ) 提示:铁在自然界中存在游离态,如陨石中铁以单质形式存在。 5.水溶液中Fe2+、H+、CO、ClO-可以共存( × ) 提示:Fe2+能被ClO-氧化,且H+与CO、ClO-不能共存。 6.活泼金属与水反应时,均生成氢氧化物和H2( × ) 提示:铁与水蒸气反应生成Fe3O4和H2。 7.饱和FeCl3溶液为红褐色,Fe(OH)2为灰绿色( × ) 提示:饱和FeCl3溶液为棕黄色,Fe(OH)2为白色。 8.Fe3O4可写作FeO·Fe2O3,所以Fe3O4是FeO和Fe2O3的混合物( × ) 提示:Fe3O4可写成FeO·Fe2O3,但Fe3O4是纯净物,并非FeO和Fe2O3的混合物。 1.常利用氧化铁的颜色将其配成涂料,同时利用了Fe2O3在空气中性质稳定的性质。 2.铁在潮湿的空气中生成的铁锈的主要成分是Fe2O3,而铁在纯氧中燃烧的产物是Fe3O4。 3.铁与硫蒸气反应生成的是FeS而不是Fe2S3;铁与碘蒸气反应生成的是FeI2而不是FeI3。 4.Fe3O4可以用FeO·Fe2O3表示,所以可以与强酸反应生成盐。但不能认为是二者的混合物。反应规律为:与非氧化性酸(如盐酸、稀硫酸)反应时生成Fe2+和Fe3+;与氧化性酸(如HNO3)反应时生成Fe3+;与还原性酸(如HI)反应时生成Fe2+。 1.(2020·湖南长郡中学月考)我国清代《本草纲目拾遗》中叙述了“铁线粉”:“粤中洋行有舶上铁丝,……日久起销,用刀刮其销,……,所刮下之销末,名铁线粉”。这里的“铁线粉”是指( D ) A.Fe B.FeCl3 C.FeO D.Fe2O3 解析:铁在空气中容易发生吸氧腐蚀,根据题意“舶上铁丝,……日久起销”,说明销是铁锈,铁锈的主要成分为Fe2O3,D项正确。 2.某同学欲探究铁及其化合物的性质,下列实验方案可行的是( D ) A.将铁粉加入热的浓硫酸中:探究铁的活泼性 B.将热的NaOH溶液滴入FeCl3溶液中:制备Fe(OH)3胶体 C.在蒸发皿中加热蒸干FeSO4溶液:制备FeSO4·6H2O晶体 D.将铜粉加入FeCl3溶液中:验证Fe3+的氧化性强于Cu2+ 解析:由于浓硫酸具有强氧化性,铁与其反应生成Fe2(SO)3和SO2,无法说明铁的活泼性,故A方案不可行;将NaOH加入FeCl3溶液中,得到Fe(OH)3沉淀,无法得到Fe(OH)3胶体,B方案不可行;在蒸发皿中加热蒸干FeSO4溶液,一方面氧气可将FeSO4氧化,另一方面会得到不含结晶水的化合物,故C方案不可行;将铜粉加入FeCl3溶液中,发生反应:Cu+2Fe3+===Cu2++2Fe2+,该反应说明Fe3+的氧化性强于Cu2+,故D方案可行。 3.下列反应最终能生成Fe3+的化合物的是( D ) ①过量Fe与稀HNO3溶液反应 ②铁丝在硫蒸气中燃烧 ③向FeBr2溶液中通入少量Cl2 ④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中 A.①②③ B.①③⑤ C.③④ D.③⑤ 解析:①过量Fe与稀HNO3溶液反应生成Fe(NO3)2、NO和H2O;②Fe与硫蒸气反应生成FeS;③由于Fe2+的还原性强于Br-,向FeBr2溶液中通入少量Cl2,先氧化Fe2+生成Fe3+;④铁与CuCl2溶液发生置换反应,生成FeCl2和Cu;⑤Fe(OH)2露置于空气中,被空气中O2氧化,最终转化为Fe(OH)3。 4.(2020·洛阳模拟)中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下图所示。 FeCl3·6H2OFeOOH纳米四氧化三铁 下列有关叙述不合理的是( B ) A.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病 B.纳米四氧化三铁可分散在水中,它与FeCl3 溶液的分散质直径大小相等 C.在反应①中环丙胺的作用可能是促进氯化铁水解 D.反应②的化学方程式是6FeOOH+CO===2Fe3O4+3H2O+CO2 解析:纳米四氧化三铁为磁性纳米晶体材料,可作为药物载体用于疾病的治疗,A正确;纳米四氧化三铁分散在适当的分散剂中形成的分散系属于胶体,不同于溶液中溶质微粒的直径,B错误;反应①中环丙胺不参加反应,但加入环丙胺后FeCl3发生水解生成FeOOH,即环丙胺会促进氯化铁的水解,C正确;由制备过程可知,反应②的反应物为FeOOH和CO,由一种生成物为Fe3O4和质量守恒定律可知,反应为6FeOOH+CO===2Fe3O4+3H2O+CO2,D正确。 5.(2020·武汉高三质检)铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( B ) A.FeO·3Fe2O3 B.2FeO·3Fe2O3 C.FeO·2Fe2O3 D.2FeO·Fe2O3 解析:化合物Fe8O11可以看作由FeO和Fe2O3组成的复杂氧化物,设化学式为nFeO·mFe2O3,则解得n=2,m=3,该化合物可以表示为2FeO·3Fe2O3。 素养一 含铁物质的相关计算 1.铁与稀硝酸反应的有关计算 一是明确哪种物质过量,二是根据两种物质的量分析讨论判断,根据反应方程式: HNO3过量:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O; Fe过量:Fe+2Fe(NO3)3===3Fe(NO3)2; 两者相加得总方程式:3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O,可以用数轴表示: 解题时需注意量的范围。 即:①≤,产物仅有Fe(NO3)3,HNO3可能有剩余;②≥,产物仅有Fe(NO3)2,Fe可能有剩余;③<<,产物为Fe(NO3)3和Fe(NO3)2,Fe和HNO3都反应完全。 2.确定铁的氧化物组成的基本方法 设铁的氧化物中铁元素与氧元素的质量比为m∶n, 则氧化物中n(Fe)∶n(O)=∶=a∶b, 若a∶b=1∶1,则铁的氧化物为FeO; 若a∶b=2∶3,则铁的氧化物为Fe2O3; 若a∶b=3∶4,则铁的氧化物是Fe3O4或FeO与Fe2O3按物质的量之比为1∶1的混合物或FeO、Fe2O3、Fe3O4的混合物(其中FeO、Fe2O3物质的量之比为1∶1,Fe3O4为任意值)。 1.(2020·长春模拟)向一定量的Fe、FeO、Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的CO在加热下还原相同质量的混合物,能得到铁的物质的量为( B ) A.0.24 mol B.0.21 mol C.0.16 mol D.0.14 mol 解析:根据题意知反应后的溶液为Fe(NO3)2 溶液,根据氮原子守恒可知n(Fe)=×(0.12×4 mol- mol)=0.21 mol,故相同质量的混合物与足量CO反应生成的Fe为0.21 mol。 2.把22.4 g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是( C ) A.反应后生成的盐只为Fe(NO3)3 B.反应后生成的盐只为Fe(NO3)2 C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3 D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1 解析:由于铁的物质的量为=0.4 mol,所以在反应的过程中它失去的电子数应介于0.8 mol(此时只产生Fe2+)和1.2 mol(此时只产生Fe3+)之间,又产生0.3 mol NO2和0.2 mol NO,即反应过程中硝酸得到的电子物质的量为0.3 mol×(5-4)+0.2 mol×(5-2)=0.9 mol,所以对应的产物既有Fe(NO3)3又有Fe(NO3)2。设前者的物质的量为x,后者的物质的量为y,则由铁原子守恒可得x+y=0.4 mol,由得失电子守恒得3x+2y=0.9 mol,解得x=0.1 mol,y=0.3 mol。 3.向含有1 mol HNO3和1 mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是( C ) A.a表示Fe3+的关系曲线 B.n1=0.75 C.P点时,n(Fe2+)=0.562 5 mol D.向P点溶液中加入铜粉,最多可溶解14.4 g 解析:该反应可以看作两步:①Fe+4H++NO===Fe3++NO↑+2H2O,硝酸根过量,氢离子不足;②2Fe3++Fe===3Fe2+。a表示Fe3+的关系曲线,A正确;溶液中共有3 mol H+参加反应,消耗铁为0.75 mol,B正确;P点n(Fe2+)=n(Fe3+),二者均为0.45 mol,C错误,剩余0.45 mol Fe3+,消耗0.225 mol铜,质量为14.4 g,D正确。 素养二 铁元素变价的理解、Fe(OH)2制备 1.铁元素变价的理解 (1)单质铁 ①生成+2价:铁与S、H+、Cu2+、I2等反应生成+2价。如Fe+SFeS、Fe+Cu2+===Fe2++Cu。 ②生成+3价:铁与Cl2、Br2等反应生成+3价。 如2Fe+3Cl22FeCl3。 ③生成+2、+3价:铁与H2O、O2反应生成Fe3O4。 如3Fe+4H2O(g)Fe3O4+4H2。 ④铁与HNO3反应: 当Fe过量生成+2价,3Fe+8H++2NO===3Fe2++2NO↑+4H2O;当Fe不足时生成+3价,Fe+4H++NO===Fe3++NO↑+2H2O。 (2)铁的化合物:FeO、Fe3O4、Fe2O3、Fe(OH)2、Fe(OH)3、Fe2+、Fe3+等。 +2价铁具有还原性,与强氧化剂如HNO3、Cl2等发生氧化还原反应:如3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O。 +3价铁具有氧化性,与强还原剂如:HI、Fe、Cu、I-、S2- 等发生氧化还原反应,如Fe2O3+6HI===2FeI2+I2+3H2O,2Fe3++Cu===2Fe2++Cu2+。 2.氢氧化亚铁的制备原理和方法 (1)制备原理 ①制备原理:Fe2++2OH-===Fe(OH)2↓。 ②成功关键:溶液中不含O2等氧化性物质;制备过程中,保证生成的Fe(OH)2在密闭的、隔绝空气的体系中。 (2)常用方法 ①有机层隔离法 a.反应在试管底部进行(这是唯一一种把胶头滴管插入反应溶液的实验)。 b.加隔氧剂,如加入汽油、苯等比水轻的有机溶剂[如图,由于苯的液封作用,可防止生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH)2沉淀]。 ②还原性气体保护法 该方法是先在装置Ⅰ中产生FeSO4溶液,并利用产生的H2排尽整个装置中的空气,待检验H2的纯度后,再关闭止水夹K,利用H2产生的压力把FeSO4溶液压入装置Ⅱ中与NaOH溶液进行反应。 ③电解法 该方法中铁作电解池的阳极,电极反应为Fe-2e-===Fe2+,阴极反应为2H++2e-===H2↑,生成的氢气可以赶走溶液中的氧气,溶液中c(OH-)增大,与Fe2+结合生成Fe(OH)2沉淀,汽油起“液封”作用。 电解时,在两极间最先观察到白色沉淀。 1.(2020·天津南开中学月考)在硫酸铁溶液中,加入a g铜完全溶解后再加入b g铁,充分反应后得到c g残余固体,下列说法中正确的有( D ) ①若a>c,则残余固体是铁和铜的混合物 ②若a>c,则最终溶液中一定有Fe2+和Cu2+ ③若a>c,则最终溶液中一定没有Fe3+ ④若a查看更多
相关文章
- 当前文档收益归属上传用户