- 2021-07-08 发布 |
- 37.5 KB |
- 79页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习物质结构元素周期律课件(79张)(全国通用)
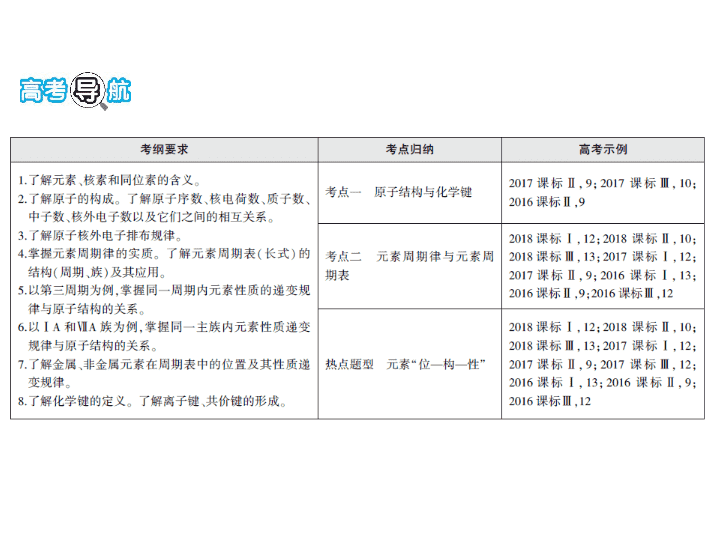
专题四 物质结构 元素周期律 总纲目录 考点一 原子结构与化学键 考点二 元素周期律与元素周期表 热点题型突破 3 元素“位 — 构 — 性” 考点一 原子结构与化学键 1. 辨析原子结构中各微粒间的关系(正确的划“√”,错误的划 “ ✕ ”)。 (1)质子数为35、中子数为45的溴原子 Br ( ) (2 U和 U是中子数不同、质子数相同的同种核素 ( ) (3 Cl与 Cl得电子能力相同 ( ) (4)通过化学变化可以实现 16 O与 18 O间的相互转化 ( ) (5) 14 C可用于文物的年代鉴定, 14 C与 12 C互为同素异形体 ( ) (6)Ne、CH 4 、H 2 O、OH - 、F - 、—CH 3 、—OH均是10电子微粒 ( ) (7)核聚变如 H H He n,因为有新微粒生成,所以该变化是化 学变化 ( ) 答案 (1)√ (2)✕ (3)√ (4)✕ (5)✕ (6)✕ (7)✕ 2. 1~18号元素原子结构的特殊性。 (1)原子核中无中子的原子 。 (2)最外层电子数是次外层电子数2倍的元素 ;是次外层 电子数3倍的元素 。 (3)电子层数和最外层电子数相等的元素 。 (4)电子总数为最外层电子数2倍的元素 。 (5)次外层电子数是最外层电子数2倍的元素 。 (6)内层电子总数是最外层电子数2倍的元素 。 答案 (1 H (2)C O (3)H、Be、Al (4)Be (5)Li、Si (6) Li、P 3. (1)常见的10e - 微粒有Ne、 。 (2)常见的18e - 微粒有Ar、 。 答案 (1)Na + 、Mg 2+ 、Al 3+ 、OH - 、O 2- 、F - 、N 、H 3 O + 、CH 4 、 NH 3 、H 2 O、HF (2)K + 、Ca 2+ 、HS - 、Cl - 、S 2- 、 、SiH 4 、PH 3 、H 2 S、HCl、C 2 H 6 、 CH 3 OH、H 2 O 2 、N 2 H 4 、F 2 4. 对于下列物质:①NaOH ②Na 2 O 2 ③Cl 2 ④NaCl ⑤C 2 H 6 ⑥H 2 O ⑦Ar ⑧NH 4 Cl (1)只含离子键的有 ,只含共价键的有 ,不含化 学键的有 。 (2)既含离子键又含共价键的有 。 (3)属于共价化合物的有 ,属于离子化合物的有 。 答案 (1)④ ③⑤⑥ ⑦ (2)①②⑧ (3)⑤⑥ ①②④⑧ 题组一 原子结构及核外电子排布规律的应用 1. (2017北京理综,7,6分)2016年IUPAC命名117号元素为Ts(中文 名“ ”,tián),Ts的原子核外最外层电子数是7。下列说法不正 确的是 ( ) A.Ts是第七周期第ⅦA族元素 B.Ts的同位素原子具有相同的电子数 C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts核素符号是 Ts 答案 D 中子数为176的Ts核素符号为 Ts。 2. X、Y、Z均为短周期元素。已知X元素的原子核内无中子,Y元 素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地 壳中含量最丰富的元素。有下列含该三种元素的化学式:①X 2 Y 2 Z 2 ②X 2 YZ 3 ③X 2 YZ 2 ④X 2 Y 2 Z 4 ⑤X 3 YZ 4 ⑥XYZ 3 ,其中可 能存在对应物质的是 ( ) A.只有② B.只有②④ C.只有②⑤⑥ D.只有①②③④ 答案 D 由题意可知,X为H、Y为C、Z为O。他们组合起来可 能为H 2 CO 3 、H 2 CO 4 、HCOOH、HCHO。 3. (2018河南濮阳三模)短周期主族元素W、X、Y、Z、R原子序 数依次增大。考古时利用W的一种同位素测定一些文物的年代, X是地壳中含量最多的元素,Y、Z的质子数分别是W、X的质子 数的2倍。下列说法错误的是 ( ) A.Y单质可以与WX 2 发生置换反应 B.工业上常用电解熔融的Y与R形成的化合物的方法制取Y C.原子半径:Y>Z>R;简单离子半径:Z>X>Y D.可以用澄清的石灰水鉴别WX 2 与ZX 2 答案 D 考古时利用W的一种同位素测定一些文物的年代,即 W为C,X是地壳中含量最多的元素,即X为O,Y、Z的质子数分别 是W、X的质子数的2倍,推出Y为Mg,Z为S,R为Cl。Mg能与CO 2 发生反应:2Mg+CO 2 2MgO+C,此反应属于置换反应,故A说 法正确;工业上电解熔融MgCl 2 得到金属镁单质,故B说法正确;原 子半径:Mg>S>Cl,简单离子半径:S 2- >Cl - >Mg 2+ ,故C说法正确;WX 2 为CO 2 ,ZX 2 为SO 2 ,都能使澄清石灰水变浑浊,因此用澄清石灰水无 法鉴别CO 2 和SO 2 ,故D说法错误。 1. 抓住描述对象判断“四同” (1)同位素——原子,如 H H H。 (2)同素异形体——单质,如O 2 、O 3 。 (3)同系物——有机化合物,如CH 3 CH 3 、CH 3 CH 2 CH 3 。 (4)同分异构体——有机化合物,如正戊烷、新戊烷。 解题必备 2. 明确元素符号周围数字的含义 , 如: 题组二 物质结构与化学键 4. 下列说法正确的是 ( ) A. 分子中既含极性键,又含非极性键 B.只含H、N、O三种元素的化合物,可能是离子化合物,也可能 是共价化合物 C.非金属元素组成的化合物只含共价键 D.钠的单质在空气中燃烧生成只含离子键的化合物 答案 B A项,没有同种元素之间的共价键,因而不含非极性键, 错误;B项,NH 4 NO 3 为离子化合物,HNO 3 为共价化合物,正确;C项, 非金属元素组成的化合物可能含有共价键,也可能含有离子键,如 NH 4 Cl,错误;D项,Na 2 O 2 中存在共价键,错误。 5. (2018山西孝义一模)短周期主族元素W、X、Y、Z原子序数依 次增大,其中W的负一价阴离子W - 能与水反应生成W 2 ,Y、Z同主 族,其原子L电子层的电子数之比为3∶4,X、Y、Z的最外层电子 数之和为17。下列说法正确的是 ( ) A.原子半径:W>X>Y B.W、X、Y三者可形成离子化合物 C.简单氢化物的沸点:Z>X>Y D.W与X只能形成含有极性键的化合物 答案 B W的负一价阴离子W - 能与水反应生成W 2 ,氢负离子与 水反应生成氢气,W为H;Y、Z同主族,其原子L电子层的电子数比 之为3∶4,所以Y为O,Z为S;短周期主族元素W、X、Y、Z原子序 数依次增大,X、Y、Z的最外层电子数之和为17,X为N。同一周 期,从左到右,主族元素原子半径减小,所以原子半径:N>O>H,A错 误;N、O、H三种元素可以形成硝酸铵,属于离子化合物,B正确; 简单氢化物为硫化氢、氨气和水,由于水形成的氢键比氨气多,硫 化氢分子不形成氢键,所以沸点由大到小的顺序为水、氨气和硫 化氢,C错误;H与N可以形成NH 3 (含有极性键的化合物)也可以形 成N 2 H 4 ,氮氮之间为非极性共价键,D错误。 6. (2018广东东莞第二次综合测试)X、Y、Z、W是短周期主族元 素。已知Z是地壳中含量第二位的元素,W在短周期主族元素中 原子半径最大,Z、X、Y在元素周期表中的相对位置如图所示。 下列说法正确的是 ( ) A.Z的氧化物属于酸性氧化物,能与水反应生成相应的酸 B.W 2 Y和W 2 Y 2 中阴、阳离子的个数比相同,化学键类型不完全相同 C.X、Y与H三种元素形成的物质中一定不含离子键 D.X和Y只能形成一种物质 答案 B X、Y、Z、W是短周期主族元素,Z是地壳中含量第二 位的元素硅元素,W在短周期主族元素中原子半径最大为钠元素, Z、X、Y在元素周期表中的相对位置如图所示,故X为氮元素、 Y为氧元素。A项,Z的氧化物二氧化硅属于酸性氧化物,但不能与 水反应生成相应的酸,错误;B项,W 2 Y和W 2 Y 2 中阴、阳离子的个数 比相同,化学键类型不完全相同,后者含有共价键,正确;C项,X、Y 与H三种元素形成的物质中硝酸铵含离子键,错误;D项,X和Y能 形成多种物质,如一氧化氮、二氧化氮、五氧化二氮等,错误。 归纳总结 理清化学键与物质类别的关系 (1)从图中可以看出,离子化合物中一定含有离子键,离子键只能存在于离子化合物中。 (2)共价键可存在于离子化合物、共价化合物和共价单质分子 中。 (3)熔融状态下能导电的化合物是离子化合物,如NaCl。 (4)金属元素与非金属元素形成的化合物不一定是离子化合物,如 AlCl3为共价化合物;只由非金属元素形成的化合物不一定是共价 化合物,如NH4Cl为离子化合物。 (5)有些物质中不存在化学键,如稀有气体分子中不存在化学键 。 题组三 “10e - ”“18e - ”微粒在推断题中的应用 7. (2018四川凉山第三次诊断性检测)甲、乙、丙、丁4种物质分 别含2种或3种元素,它们的分子中均含18个电子,甲是气态氢化 物,在水中分步电离出两种阴离子,下列推断不正确的是 ( ) A.甲通入硫酸铜溶液中无明显现象,但甲能与碱反应 B.乙的摩尔质量为32 g/mol,则乙分子中可能含有极性键、非极性键 C.若丙中含有第二周期第ⅣA族的元素,则丙可能是甲烷的同系物 D.若丁中各元素质量比跟甲中各元素质量比相同,则丁既可能表 现氧化性也可能表现还原性 答案 A 甲是气态氢化物,在水中分步电离出两种阴离子,说明 甲是H 2 A型的二元弱酸,再根据甲中含18个电子,得到甲为H 2 S,硫 化氢通入硫酸铜溶液应该有硫化铜的黑色沉淀生成,A项错误。 8. 已知A、B、C、D四种物质均是由短周期元素原子组成的,它 们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C 是一种含有10电子的微粒。请完成下列各题: (1)若A、D均是气态单质分子,写出A与B反应的化学方程式: 。 (2)若B、D属同主族元素的单质分子,写出C的电子式: 。 (3)若A、B均是含2个原子核的微粒,其中B中含有10个电子,D中 含有18个电子,则A、B之间发生反应的离子方程式为 。 (4)若D是一种含有22电子的分子,则符合上图关系的A的物质有 (写物质的化学式,若是有机物则写相应的结构 简式)。 答案 (1)2F 2 +2H 2 O 4HF+O 2 (2)H·· ··H (3)HS - +OH - S 2- +H 2 O (4)CH 3 CH 3 、CH 3 OH 解析 (1)18电子的气态单质分子为F 2 ,则C为HF、B为H 2 O、D为 O 2 ,反应的化学方程式为2F 2 +2H 2 O 4HF+O 2 。 (2)B、D为同主族元素的单质,且A含有18个电子,C含有10个电 子,则B为O 2 、A为H 2 S、C为H 2 O、D为S,反应的化学方程式为2H 2 S+O 2 2H 2 O+2S↓(氧气少量)。 (3)含2个原子核的18电子的微粒为HS - ,10电子的微粒为OH - ,反应 的离子方程式为HS - +OH - S 2- +H 2 O。 (4)含22电子的分子为CO 2 ,则A为含18电子的由C、H或C、H、O 组成的化合物,可能为CH 3 CH 3 和CH 3 OH。 归纳总结 巧记“10e - ”“18e - ”微粒 以Ne为中心记忆10电子粒子: Ne 以Ar为中心记忆18电子粒子: Ar 此外,10电子粒子中的CH 4 、NH 3 、H 2 O、HF失去一个H后剩余的 —CH 3 、—NH 2 、—OH、—F为9电子粒子,组合得到的物质如CH 3 CH 3 、CH 3 OH、H 2 O 2 、N 2 H 4 、F 2 等也为18电子粒子。 考点二 元素周期律与元素周期表 1. 金属性和非金属性强弱的判断方法 2. 主族元素性质的递变规律 内容 同周期(从左到右) 同主族(从上到下) 元素的性质 金属性 逐渐 逐渐 非金属性 逐渐 逐渐 主要化合价 一般,最高正价:+1→+7;负化合价:主族序数-8 最高正价数=主族序数(O、F除外) 化合物性质 最高价氧化物对应的水化物 酸性逐渐 碱性逐渐 酸性逐渐 碱性逐渐 氢化物稳定性 逐渐 逐渐 答案 减弱 增强 增强 减弱 增强 减弱 减弱 增强 增强 减弱 3. 元素周期表与元素周期律的应用 (1)这些元素中, 是最活泼的金属元素; 是最活 泼的非金属元素; 是最不活泼的元素。 (2) 是 (填元素名称),该元素在元素周期表中位置是 。 (3)这些元素最高价氧化物对应的水化物中酸性最强的是 ;碱性最强的是 ;呈两性的是 。 主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 一 H 二 ① ② ③ ④ 三 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ (4)⑤、⑥、⑦三种元素的金属性由强到弱顺序是 ,其 最高价氧化物对应的水化物碱性强弱顺序是 。 (5)第三周期的主族元素中,原子半径最大的是 ,原子半 径最小的是 ,离子半径最小的是 。 (6)⑧、⑨、⑩、 四种元素的非金属性由强到弱顺序为 ,其最高价氧化物对应的水化物酸性强弱顺序是 ,氢化物的稳定性强弱顺序是 。 化合物,各列举两个例子,共价化合物: 、 ;离 子化合物: 、 。 (8)如何通过实验比较⑩、 两种元素非金属性的强弱: 。 (7)氢元素与②、③三种元素既可形成共价化合物,又可形成离子 答案 (1)Na F Ar (2)氯 第三周期、第ⅦA族 (3)HClO 4 NaOH Al(OH) 3 (4)Na>Mg>Al NaOH>Mg(OH) 2 >Al(OH) 3 (5)Na Cl Al 3+ (6)Cl>S>P>Si HClO 4 >H 2 SO 4 >H 3 PO 4 >H 2 SiO 3 HCl>H 2 S>PH 3 >SiH 4 (7)HNO 3 HNO 2 NH 4 NO 3 NH 4 NO 2 (8)向氢硫酸(H 2 S)中通入Cl 2 ,有黄色浑浊产生 题组一 元素金属性、非金属性的强弱比较 1. 不能作为判断硫、氯两种元素非金属性强弱的依据是 ( ) A.单质氧化性的强弱 B.单质沸点的高低 C.单质与氢气化合的难易 D.最高价氧化物对应水化物的酸性强弱 答案 B A项,元素的非金属性越强,其单质获得电子的能力就 越强,因此单质氧化性就越强,故可以通过比较单质氧化性的强 弱,判断元素的非金属性强弱;B项,S单质、Cl 2 都是分子晶体,分子 间作用力越大,物质的熔、沸点就越高,这与元素的非金属性强弱 无关;C项,元素的非金属性越强,其单质与氢气化合形成氢化物越 容易;D项,元素的非金属性越强,其最高价氧化物对应水化物的酸 性就越强。 2. 下列进行性质比较的实验,不合理的是 ( ) A.比较Cu、Fe的还原性:Cu加入Fe 2 (SO 4 ) 3 溶液中 B.比较氯的非金属性强于溴:NaBr溶液中通入Cl 2 C.比较KMnO 4 的氧化性强于Cl 2 :KMnO 4 中加入浓盐酸 D.比较Mg的金属性强于Al:取一小段表面积相同的去氧化膜的 镁带和铝片,分别加入1.0 mol·L -1 的盐酸中 答案 A A项,比较Cu、Fe的还原性应将Cu加入FeSO 4 溶液中;B 项,Cl 2 可以和NaBr溶液反应生成单质Br 2 ,说明Cl的非金属性强于 Br;C项,KMnO 4 可将浓盐酸氧化成Cl 2 ,说明KMnO 4 的氧化性强于 Cl 2 ;D项,分别加入1.0 mol·L -1 的盐酸中,Mg比Al反应剧烈,说明Mg 的金属性强于Al。 误区警示 (1)比较元素金属性强弱的注意事项 ①依据金属与酸反应的剧烈程度进行比较时,所用的酸是非氧化 性酸(如盐酸、稀H 2 SO 4 )而不是氧化性酸(如HNO 3 )。 ②依据金属阳离子氧化性强弱进行比较时,要注意一些特例,如Fe 3+ 的氧化性大于Cu 2+ ,但金属性:Fe>Cu。 ③依据原电池原理进行比较时,要注意一些特例,如Mg-Al-NaOH 溶液形成的原电池中,Al作负极,但金属性:Mg>Al。 (2)比较元素非金属性强弱的注意事项 应根据最高价氧化物对应水化物酸性的强弱进行比较,而不是根 据非金属元素对应氢化物或其他氧化物对应水化物酸性的强弱 进行比较。 题组二 元素周期表及其应用 3. (2018北京东城二模)将碲化镉涂在玻璃上可制得“发电玻 璃”。碲(Te)位于周期表的第五周期第ⅥA族,下列说法正确的 是 ( ) A.原子半径:Te>S B.单质的氧化性:Te>S C.最高正价:Te>S D.气态氢化物稳定性:H 2 Te>H 2 S 答案 A 同主族,从上到下,原子半径逐渐增大,原子半径:Te>S, 故A正确;同主族,从上到下,元素非金属性减弱,对应单质的氧化 性逐渐减弱,氧化性:Te查看更多
相关文章
- 当前文档收益归属上传用户