2018-2019学年江西省分宜中学高一下学期第二次段考化学试卷
2018-2019学年江西省分宜中学高一下学期第二次段考化学试卷
可能用到的原子量:C:12; H:1; O:16; Cl:35.5; Mg:24; Al:27; Na:23; S:32
一、单选题(每小题只有一个正确答案,每小题3分,共48分)
1.以下叙述中,错误的是( )
A.钠单质与氯气反应后,体系的能量降低,稳定性增强
B.需要加热才能发生的反应一定是吸热反应
C.反应物的总能量高于生成物的总能量时,则反应释放能量
D.化学反应的实质是旧化学键断裂和新化学键形成
2.某些有机物质的分子式采取适当变形会简化计算.下列计算中错误的是( )
A.等质量的甲烷、乙烯、乙炔充分燃烧,消耗的氧气的物质的量依次增多
B.Wg葡萄糖充分燃烧后,燃烧产物经过足量的Na2O2充分反应,固体质量增加Wg
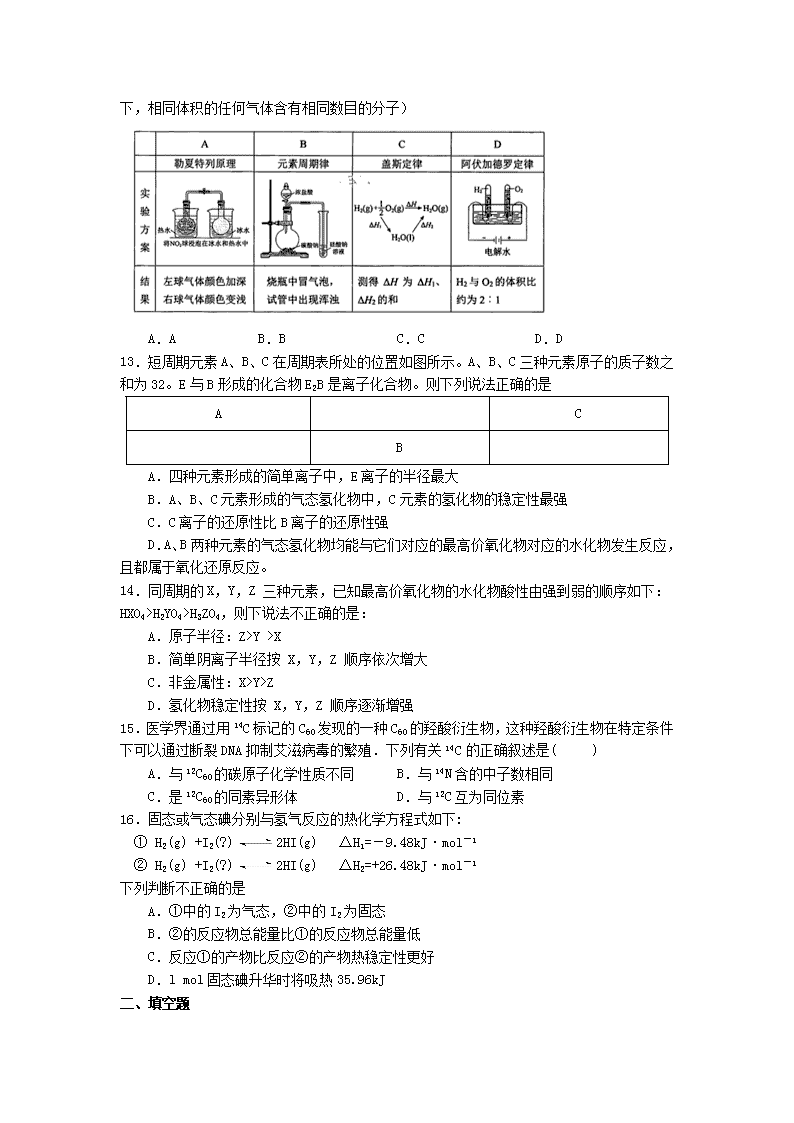
C.乙酸和两种链状单烯烃混合物中氧的质量分数为a,则碳的质量分数是
D.等物质的量的乙醇与丙烯酸充分燃烧,消耗的氧气的物质的量相同
3.下列说法不正确的是:
A.全由非金属元素构成的化合物中可能含有离子键
B.某些分子中可能不存在任何化学键
C.离子键和共价键可能同时存在于同一化合物中
D.非极性键可能由不同元素的原子形成
4.反应 A(s)+3B(g)=2C(g)+2D(g),在不同条件下测得反应速率,其中最快的是
A.υ(C)=0.3 mol/(L·s) B.υ(D)=0.35 mo/l(L·s)
C.υ(B)=0.6 mol/(L·s) D.υ(A)=0.3 mol/(L·s)
5.下列关于化学反应的速率和限度的说法错误的是( )
A.化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示
B.影响化学反应速率的条件只有温度和催化剂
C.化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态
D.催化剂只能加快化学反应速率,不能提高原料利用率和转化率
6.下列反应过程中的能量变化符合图的是:
①酸碱中和;②镁与盐酸的反应;③生石灰变成熟石灰的反应;④铝热反应;
⑤石灰石分解;⑥甲烷燃烧;⑦灼热的炭与二氧化碳反应
A.①②③⑤ B.④⑤⑦ C.③④⑦ D.⑤⑦
7.天然气的主要成分为CH4,可将CH4设计成燃料电池,来解决能源问题,装置如图所示。在标准状况下,持续通入甲烷,消耗甲烷VL。下列说法错误的是
A.当0
H2YO4>H3ZO4,则下说法不正确的是:
A.原子半径:Z>Y >X
B.简单阴离子半径按 X,Y,Z 顺序依次增大
C.非金属性:X>Y>Z
D.氢化物稳定性按 X,Y,Z 顺序逐渐增强
15.医学界通过用14C标记的C60发现的一种C60的羟酸衍生物,这种羟酸衍生物在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖.下列有关14C 的正确叙述是( )
A.与12C60的碳原子化学性质不同 B.与14N含的中子数相同
C.是12C60的同素异形体 D.与12C互为同位素
16.固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)2HI(g) △H1=-9.48kJ·mol-1
② H2(g) +I2(?)2HI(g) △H2=+26.48kJ·mol-1
下列判断不正确的是
A.①中的I2为气态,②中的I2为固态
B.②的反应物总能量比①的反应物总能量低
C.反应①的产物比反应②的产物热稳定性更好
D.l mol固态碘升华时将吸热35.96kJ
二、填空题
17.(14分)为探究实验室制乙烯及乙烯和溴水的加成反应:
甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细观察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
(1)写出甲同学实验中认为达到实验目的的两个反应的化学方程式:____________________________、___________________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):____________________
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________。
18.(8分)现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O
(B)Cu+2Ag+=2Ag+Cu2+
(1)根据两反应本质,判断各自能否设计成原电池________________________________。
(2)如果不能,说明其原因_______________。
(3)如果可以,则写出正、负极电极反应式:
负极: ________。
正极: ________。
19.(10分)请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是________;
(2)既发生离子键破坏、又发生共价键破坏的是______________;
(3)Na2O2的电子式为________;
(4)用电子式表示MgCl2的形成过程 _____________
20.(10分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外最外层共有24个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同
回答下列问题:
(1) A与E形成的化合物的化学式是__________.B的最高价氧化物化学式为_____________,
(2)D的单质与水反应的方程式为__________________________________________________.
(3) 向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是___________________:有关反应的离子方程式为:_____________________________________.
21.(10分)按要求在下列空格中填空。
(1)一定量的乙醇与苯的混合物与足量的金属钠反应,可生成11.2L氢气(在标准状况下),将此混合物燃烧能生成108g水。
①求混合物中苯的质量
(2)某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,求:
①该烃的相对分子质量: ,
②如果该烃的一氯取代物有4种,写出该烃的结构简式:
(3)5.8g有机物完全燃烧,只生成CO2和H2O气其体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰在增加18.6g,同量的有机物与0.1mol乙酸完全发生酯化反应.又知该有机物对空气的相对密度为2。(注意:羟基不能直接连在双键上)
①有机物的分子式
②有机物的结构简式
分宜中学2018-2019学年度下学期高一年级第二次段考
化 学 答 案
1.B 2.A 3.D 4.C 5.B 6.D 7.B 8.B 9.C 10.B
11.B 12.B 13.B 14.D 15.D 16.C
17.CH3CH2OH CH2=CH2↑ + H2O CH2=CH2 + Br2 Br-CH2CH2-Br
C SO2 Br2 + SO2 + 2H2O = 2HBr + H2SO4 安全装置,防倒吸 吸收乙烯、二氧化硫气体
18.(A)不能,(B)可以 (A)不是氧化还原反应,没有电子转移
Cu−2e−=Cu2+ 2Ag++2e−=2Ag
19.①② ③④ ⑥
20.Al2O3 P2O5 Cl2 + H2O = HCl + HClO 先产生白色胶状沉淀,后又逐渐溶解 Al3+ + 3OH- = Al(OH)3↓、Al(OH)3 + OH- = AlO2- + 2H2O
21.(1)①78g
(2)①72, ②
(3)①C3H6O ②CH2=CHCH2OH
(每空2分)