【化学】陕西省西安中学2020届高三第四次模拟考试
陕西省西安中学2020届高三第四次模拟考试
可能用到的相对相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na-23 S-32 Fe-56 Cu-64 Ba-137 Pb-207
一、选择题(本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的)
7.《本草纲目》中收载“烧酒”篇:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。《本草经集注》中记载关于鉴别硝石(KNO3)和朴硝(Na2SO4)之法:“强烧之,紫青烟起,……,云是真硝石也”。文字中两处涉及“法”,分别是指( )
A.蒸馏、焰色反应 B.萃取、升华 C.蒸馏、丁达尔效应 D.升华、焰色反应
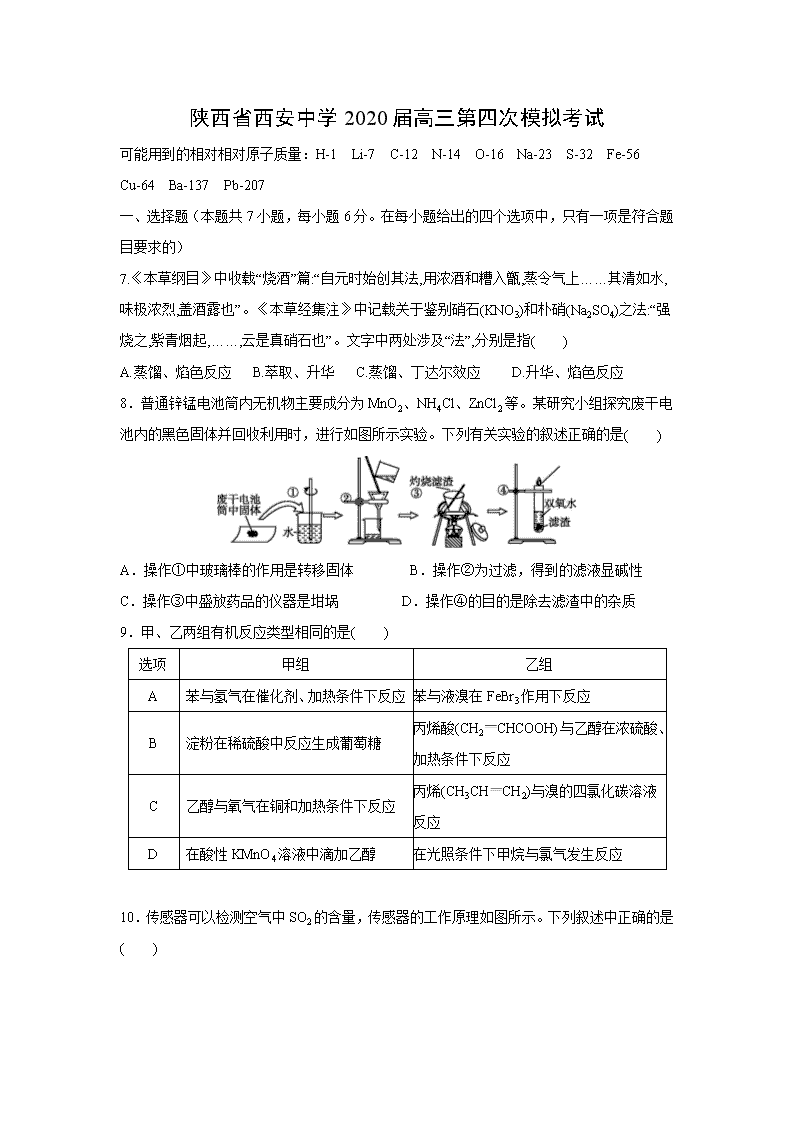
8.普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废干电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是( )
A.操作①中玻璃棒的作用是转移固体 B.操作②为过滤,得到的滤液显碱性
C.操作③中盛放药品的仪器是坩埚 D.操作④的目的是除去滤渣中的杂质
9.甲、乙两组有机反应类型相同的是( )
选项
甲组
乙组
A
苯与氢气在催化剂、加热条件下反应
苯与液溴在FeBr3作用下反应
B
淀粉在稀硫酸中反应生成葡萄糖
丙烯酸(CH2CHCOOH)与乙醇在浓硫酸、加热条件下反应
C
乙醇与氧气在铜和加热条件下反应
丙烯(CH3CHCH2)与溴的四氯化碳溶液反应
D
在酸性KMnO4溶液中滴加乙醇
在光照条件下甲烷与氯气发生反应
10.传感器可以检测空气中SO2的含量,传感器的工作原理如图所示。下列叙述中正确的是( )
A.b为电源的正极
B.阳极的电极反应式为Ag++Cl-AgCl
C.当电路中电子转移5×10-5 mol时,进入传感器的SO2为1.12 mL
D.阴极的电极反应式为2HSO3-+2H++2e-S2O42-+2H2O
11.某有机物的分子式为C4H9ClO,分子中含有羟基和一个氯原子,且两者不能连到同一个碳原子上的同分异构体共有( )
A.8种 B.9种 C.10种 D.12种
12.V、W、X、Y、Z五种短周期主族元素,原子序数依次增大,X原子的最外层电子数是内层电子数的3倍,W的气态氢化物和最高价氧化物对应的水化物反应生成一种盐,Y是同周期中原子半径最大的元素,Z的原子序数等于V、W、X的原子序数之和。下列说法错误的是( )
A.X、Z同主族,Y、Z同周期 B.简单离子的半径:W>Y
C.V、X可形成原子个数比为1∶1、2∶1的化合物 D.气态氢化物的热稳定性:X
c(H2CO3)+c(HCO3-)+c(H+)
D.在B点所示的溶液中,离子浓度最大的是HCO3-
二、非选择题
(一)必考题(共11题,计129分)
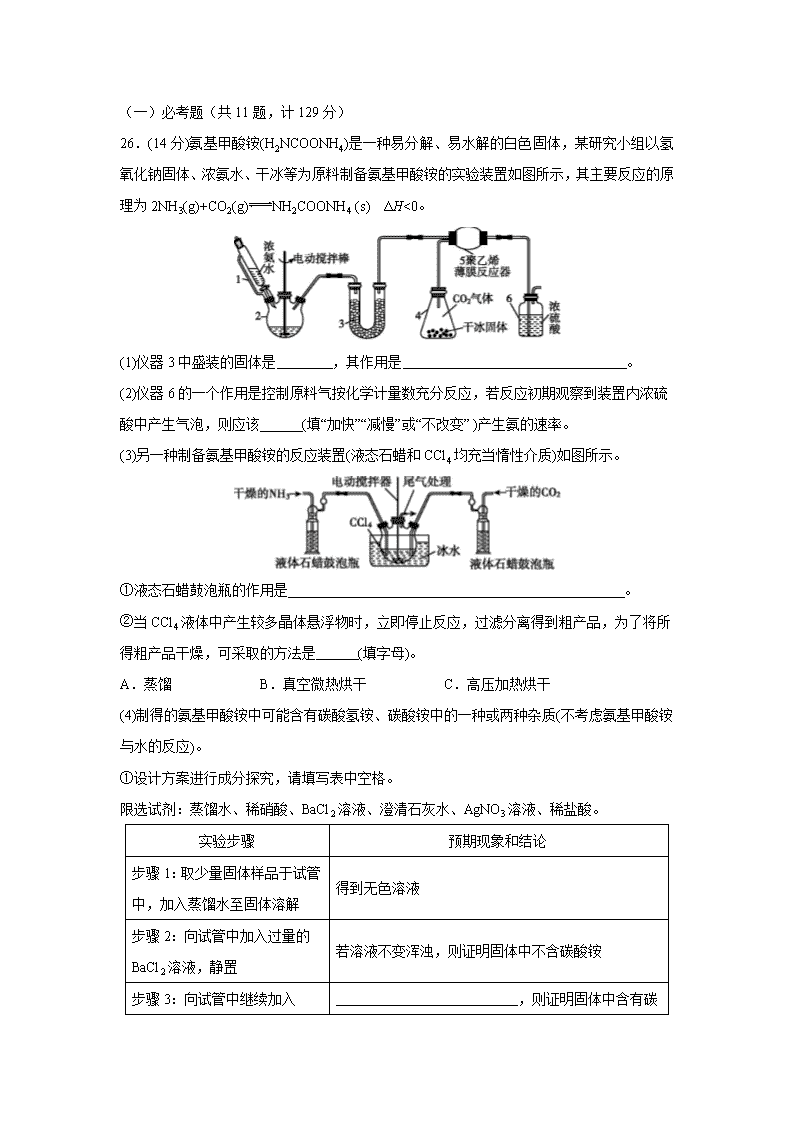
26.(14分)氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组以氢氧化钠固体、浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图所示,其主要反应的原理为2NH3(g)+CO2(g)NH2COONH4 (s) ΔH<0。
(1)仪器3中盛装的固体是 ,其作用是 。
(2)仪器6的一个作用是控制原料气按化学计量数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该 (填“加快”“减慢”或“不改变” )产生氨的速率。
(3)另一种制备氨基甲酸铵的反应装置(液态石蜡和CCl4均充当惰性介质)如图所示。
①液态石蜡鼓泡瓶的作用是 。
②当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是 (填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤
预期现象和结论
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解
得到无色溶液
步骤2:向试管中加入过量的BaCl2溶液,静置
若溶液不变浑浊,则证明固体中不含碳酸铵
步骤3:向试管中继续加入____________
,则证明固体中含有碳酸氢铵
②根据①的结论,取15.8 g氨基甲酸铵样品,用足量氢氧化钡溶液充分处理后,过滤洗涤、干燥,测得沉淀的质量为1.97 g。则样品中氨基甲酸铵的质量分数为 。
27.(14分)三盐基硫酸铅(3PbO·PbSO4·H2O,相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0 t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备“三盐”的工艺流程如图所示。
已知:①Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;②铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式: ,该反应能发生的原因是 。
(2)步骤②“过滤1”后所得滤渣的主要成分为 。
(3)步骤③“酸溶”,最适合选用的酸为 ,为提高酸溶速率,可采取的措施是
(任意写出一条)。
(4)从原子利用率的角度分析该流程的优点为 。
(5)步骤⑥“合成”的化学方程式为 。若得到纯净干燥的“三盐”49.5 t,假设铅泥中的铅元素有80%转化为“三盐”,则铅泥中铅元素的质量分数为 %(结果保留一位小数)。
28.(15分)氮的化合物在生产生活中广泛存在。回答下列问题:
(1)①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
化学键
键能/(kJ·mol-1)
N—H
391.3
Cl—Cl
243.0
N—Cl
191.2
H—Cl
431.8
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为2NO(g)+C(s)N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min
0
40
80
120
160
n(NO)(甲容器)/mol
2.00
1.50
1.10
0.80
0.80
n(NO)(乙容器)/mol
1.00
0.80
0.65
0.53
0.45
n(NO)(丙容器)/mol
2.00
1.45
1.00
1.00
1.00
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min末达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A) (填“<”或“>”或“=”)Kc(B)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(二)选考题
35.[化学——物质结构与性质](15分)Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素
相关信息
Y
原子核外有6个不同运动状态的电子
Z
非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同
W
主族元素,与Z原子的价电子数相同
R
价层电子排布式为3d64s2
M
位于第ⅠB族,其被称作“电器工业的主角”
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是 ,M2+的核外电子排布式为 。
(2)M2Z的熔点比M2W的 (填“高”或“低”),请解释原因:
。
(3)WZ2的VSEPR模型名称为 ;WZ3气态为单分子,该分子中W原子的杂化轨道类型为 ;WZ3的三聚体环状结构如图(a)所示,该结构的分子中含有 个σ键,写出一种;写出一种与WZ3互为等电子体的分子的化学式
(4)MRW2的晶胞如图 (b)所示,晶胞参数a=0.524 nm、c=1.032 nm;MRW2的晶胞中,晶体密度ρ= g/cm3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA=6.02×1023 mol-1)。
36.[化学——有机化学基础](15分)呋喃(C4H4O)是生产抗流感药物磷酸奥司他韦(又名达菲)的原料之一,以玉米芯为原料制备呋喃及相关衍生物的一种工艺流程如下:
已知:①A可以发生银镜反应;②+‖。
试回答下列问题:
(1)D的分子式为 。
(2)呋喃的结构简式为 ;②的反应类型为 。
(3)A发生银镜反应的化学方程式为 。
(4)反应①在有机合成中具有重要意义,则B的结构简式为 。
(5)C的同分异构体中,含有“”结构的共有 种(不含立体异构),其中能发生银镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为 。
(6)参照上述合成路线,设计以环己烯和丙烯为原料制备的合成路线(无机试剂任选)。
【参考答案】
7
8
9
10
11
12
13
A
C
B
D
B
D
D
26.(1)碱石灰(2分) 干燥氨,防止仪器5中生成的氨基甲酸铵水解(2分)
(2)加快(1分)
(3)①通过观察气泡,调节NH3与CO2的通入比例(或通过观察气泡,控制通入NH3与CO2的速率)(2分)
②B(1分)
(4)①少量澄清石灰水(2分) 若溶液变浑浊(2分) ②0.95(或95%)(2分)
27.(1)PbSO4+Na2CO3PbCO3+Na2SO4 (2分) Ksp(PbSO4)>Ksp(PbCO3),容易实现沉淀的转化(2分)
(2)Pb、PbO、PbCO3(2分)
(3)HNO3(1分) 适当升温(适当增加硝酸浓度、减小滤渣颗粒大小等合理答案均可)(1分)
(4)滤液2(HNO3溶液)可以循环利用(2分)
(5)4PbSO4+6NaOH3PbO·PbSO4·H2O+3Na2SO4+2H2O(2分) 51.8(2分)
28.(1)①略 (1分) +11.3 kJ·mol-1(2分)
②NH2Cl+H2ONH3+HClO或NH2Cl+2H2ONH3·H2O+HClO (2分)
(2)①放热(2分) ②0.003 mol·L-1·min-1(2分)
(3)①=(2分) ②A(2分) ③2MPa(2分)
35.(1)O (1分) [Ar]3d9或1s22s22p63s23p63d9(1分)
(2)高(1分)氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高
(3) 平面三角形(1分) sp2 BF3等 12
(4)
36.(1)C7H12O3(1分)
(2)(2分) 取代反应(1分)
(3)+2Ag(NH3)2OH+2Ag↓+3NH3+H2O(2分)
(4)(2分)
(5)13(2分) (2分)
(6)(3分,每步1分,反应条件错,该步不得分)