- 2021-07-08 发布 |
- 37.5 KB |
- 13页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【新高考】2021高考化学一轮考评特训:单元检测7 化学反应与能量
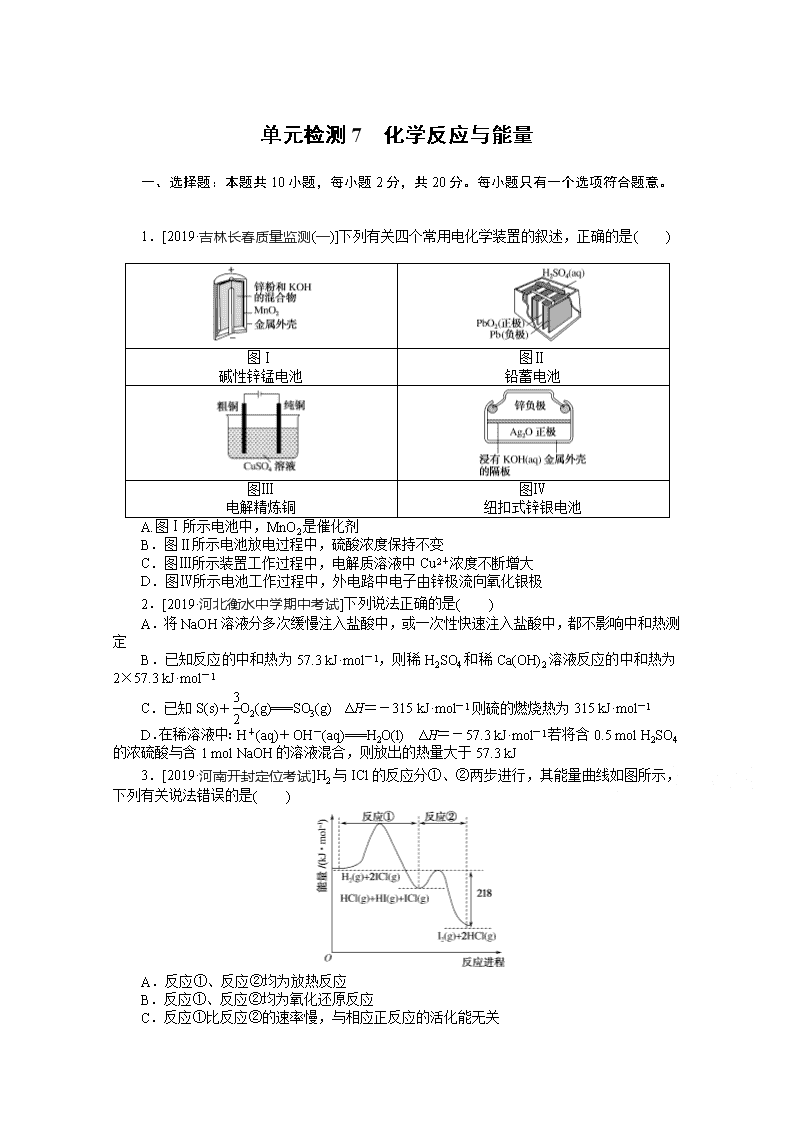
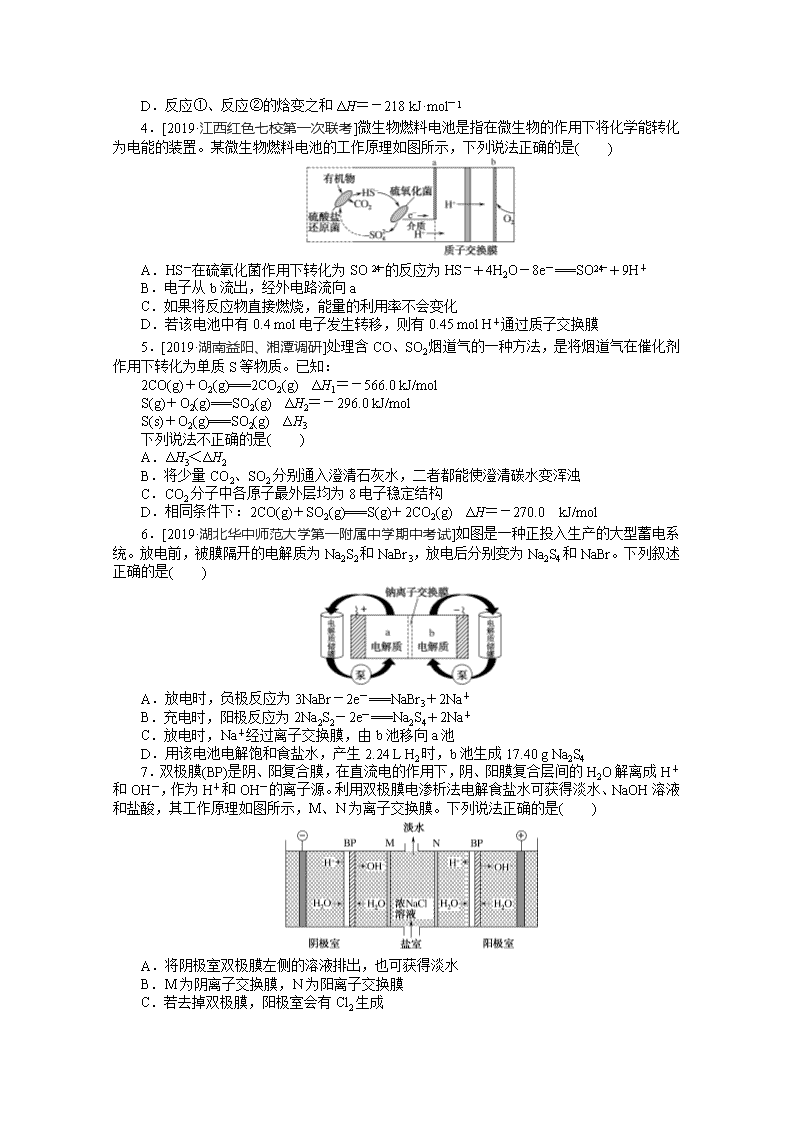
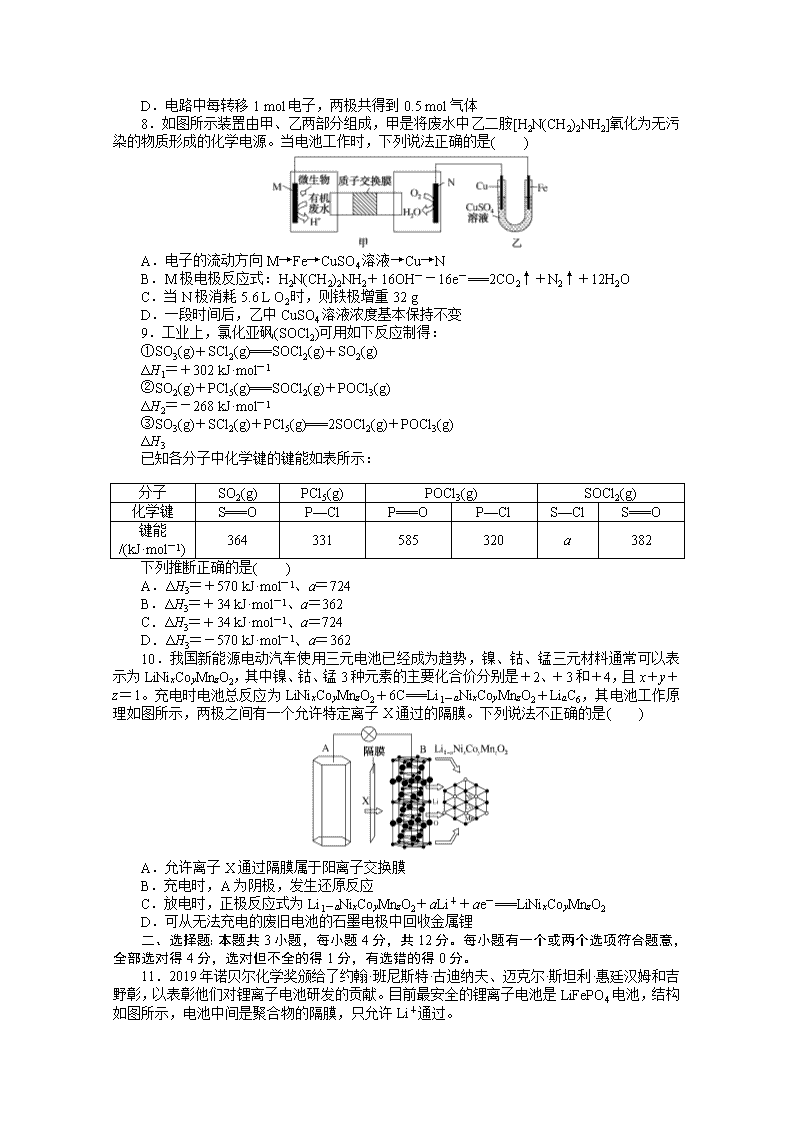
www.ks5u.com 单元检测7 化学反应与能量 一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。 1.[2019·吉林长春质量监测(一)]下列有关四个常用电化学装置的叙述,正确的是( ) 图Ⅰ 碱性锌锰电池 图Ⅱ 铅蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 纽扣式锌银电池 A.图Ⅰ所示电池中,MnO2是催化剂 B.图Ⅱ所示电池放电过程中,硫酸浓度保持不变 C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度不断增大 D.图Ⅳ所示电池工作过程中,外电路中电子由锌极流向氧化银极 2.[2019·河北衡水中学期中考试]下列说法正确的是( ) A.将NaOH溶液分多次缓慢注入盐酸中,或一次性快速注入盐酸中,都不影响中和热测定 B.已知反应的中和热为57.3 kJ·mol-1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热为2×57.3 kJ·mol-1 C.已知S(s)+O2(g)===SO3(g) ΔH=-315 kJ·mol-1则硫的燃烧热为315 kJ·mol-1 D.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,则放出的热量大于57.3 kJ 3.[2019·河南开封定位考试]H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是( ) A.反应①、反应②均为放热反应 B.反应①、反应②均为氧化还原反应 C.反应①比反应②的速率慢,与相应正反应的活化能无关 D.反应①、反应②的焓变之和ΔH=-218 kJ·mol-1 4.[2019·江西红色七校第一次联考]微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( ) A.HS-在硫氧化菌作用下转化为SO的反应为HS-+4H2O-8e-===SO+9H+ B.电子从b流出,经外电路流向a C.如果将反应物直接燃烧,能量的利用率不会变化 D.若该电池中有0.4 mol电子发生转移,则有0.45 mol H+通过质子交换膜 5.[2019·湖南益阳、湘潭调研]处理含CO、SO2烟道气的一种方法,是将烟道气在催化剂作用下转化为单质S等物质。已知: 2CO(g)+O2(g)===2CO2(g) ΔH1=-566.0 kJ/mol S(g)+O2(g)===SO2(g) ΔH2=-296.0 kJ/mol S(s)+O2(g)===SO2(g) ΔH3 下列说法不正确的是( ) A.ΔH3<ΔH2 B.将少量CO2、SO2分别通入澄清石灰水,二者都能使澄清碳水变浑浊 C.CO2分子中各原子最外层均为8电子稳定结构 D.相同条件下:2CO(g)+SO2(g)===S(g)+2CO2(g) ΔH=-270.0 kJ/mol 6.[2019·湖北华中师范大学第一附属中学期中考试]如图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( ) A.放电时,负极反应为3NaBr-2e-===NaBr3+2Na+ B.充电时,阳极反应为2Na2S2-2e-===Na2S4+2Na+ C.放电时,Na+经过离子交换膜,由b池移向a池 D.用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40 g Na2S4 7.双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-的离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH溶液和盐酸,其工作原理如图所示,M、N为离子交换膜。下列说法正确的是( ) A.将阴极室双极膜左侧的溶液排出,也可获得淡水 B.M为阴离子交换膜,N为阳离子交换膜 C.若去掉双极膜,阳极室会有Cl2生成 D.电路中每转移1 mol电子,两极共得到0.5 mol气体 8.如图所示装置由甲、乙两部分组成,甲是将废水中乙二胺[H2N(CH2)2NH2] 氧化为无污染的物质形成的化学电源。当电池工作时,下列说法正确的是( ) A.电子的流动方向M→Fe→CuSO4溶液→Cu→N B.M极电极反应式:H2N(CH2)2NH2+16OH--16e-===2CO2↑+N2↑+12H2O C.当N极消耗5.6 L O2时,则铁极增重32 g D.一段时间后,乙中CuSO4溶液浓度基本保持不变 9.工业上,氯化亚砜(SOCl2)可用如下反应制得: ①SO3(g)+SCl2(g)===SOCl2(g)+SO2(g) ΔH1=+302 kJ·mol-1 ②SO2(g)+PCl5(g)===SOCl2(g)+POCl3(g) ΔH2=-268 kJ·mol-1 ③SO3(g)+SCl2(g)+PCl5(g)===2SOCl2(g)+POCl3(g) ΔH3 已知各分子中化学键的键能如表所示: 分子 SO2(g) PCl5(g) POCl3(g) SOCl2(g) 化学键 S===O P—Cl P===O P—Cl S—Cl S===O 键能 /(kJ·mol-1) 364 331 585 320 a 382 下列推断正确的是( ) A.ΔH3=+570 kJ·mol-1、a=724 B.ΔH3=+34 kJ·mol-1、a=362 C.ΔH3=+34 kJ·mol-1、a=724 D.ΔH3=-570 kJ·mol-1、a=362 10.我国新能源电动汽车使用三元电池已经成为趋势,镍、钴、锰三元材料通常可以表示为LiNixCoyMnzO2,其中镍、钴、锰3种元素的主要化合价分别是+2、+3和+4,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定离子X通过的隔膜。下列说法不正确的是( ) A.允许离子X通过隔膜属于阳离子交换膜 B.充电时,A为阴极,发生还原反应 C.放电时,正极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2 D.可从无法充电的废旧电池的石墨电极中回收金属锂 二、选择题:本题共3小题,每小题4分,共12分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。 11.2019年诺贝尔化学奖颁给了约翰·班尼斯特·古迪纳夫、迈克尔·斯坦利·惠廷汉姆和吉野彰,以表彰他们对锂离子电池研发的贡献。目前最安全的锂离子电池是LiFePO4电池,结构如图所示,电池中间是聚合物的隔膜,只允许Li+通过。 原理如下: (1-x)LiFePO4+xFePO4+LixCnLiFePO4+nC。 下列说法不正确的是( ) A.放电时,B电极发生氧化反应 B.放电时,导线转移1 mol电子,B电极室质量减少7x g C.充电时,A电极电极反应式:xLiFePO4-xe-===xFePO4+xLi+ D.充电时,Li+从B电极室向A电极室移动 12.已知:C(s)+O2(g)===CO(g) ΔH=-110.4 kJ·mol-1,氧化亚铜与氧化反应的能量变化如图所示。 下列叙述正确的是( ) A.1 mol C(s)完全燃烧的反应热小于-110.4 kJ·mol-1 B.CuO分解生成Cu2O的反应为放热反应 C.由图可知在隔绝空气的条件下CuO的热稳定性比Cu2O差 D.足量炭粉与CuO反应生成Cu2O的热化学方程式为C(s)+2CuO(s)===Cu2O(s)+CO(g) ΔH=+35.6 kJ·mol-1 13.某科研团队研制出“TM-LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气与氢气合成NH3的效率,原理示意如图: 下列分析不合理的是( ) A.状态Ⅰ,放出能量并有N≡N键发生断裂 B.合成NH3总反应的原子利用率是100% C.“TM-LiH”能降低合成氨反应的ΔH D.生成NH3:2LiNH+3H2===2LiH+2NH3 14.生活污水中的氮和磷主要以铵盐和磷酸盐的形式存在,可用铁、石墨作电极,用电解法从溶液中去除。电解时,利用如图甲原理所示可进行除氮,有Cl-存在时,主要依靠有效氯(HClO、ClO-)将NH或NH3氧化为N2;翻转电源正负极,可进行除磷,原理是利用Fe2+将PO转化为Fe3(PO4)2沉淀,图乙为某含Cl-的污水在氮磷联合脱除过程中溶液pH的变化。下列说法正确的是( ) A.电解法除氮时有效氯HClO氧化NH的离子方程式为3HClO+2NH===3Cl-+N2↑+3H2O+5H+ B.溶液pH越小,有效氯浓度越大,氮的去除率越高 C.图乙中20~40 min时脱除的元素是磷元素,此时阴极电极反应式为2H++2e-===H2↑ D.图乙中0~20 min时脱除的元素是氮元素,此时铁作阳极 15.图1为光伏并网发电装置示意图。图2为电解尿素[CO(NH2)2]的碱性溶液制氢装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。 下列叙述正确的是( ) A.图1中N型半导体为正极,P型半导体为负极 B.图2溶液中电子从B极流向A极 C.X2为氧气 D.工作时,A极的电极反应式为CO(NH2)2+8OH--6e-===CO+N2↑+6H2O 三、非选择题:本题共5小题,共60分。 16.(12分)利用如图所示装置测定中和热的实验步骤如下: ①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合溶液最高温度。回答下列问题: (1)所用NaOH溶液要稍过量,理由是________________________________。 (2)如图装置中碎泡沫塑料及泡沫塑料板的作用是________________________________。 (3)环形玻璃搅拌棒搅拌溶液的操作是____________________________________________________。 (4)假设盐酸和NaOH溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如表所示: 实验序号 起始温度T1/℃ 终止温度T2/℃ 盐酸 NaOH溶液 混合溶液 1 20.0 20.1 23.2 2 20.2 20.4 23.4 3 20.5 20.6 23.6 依据该学生的实验数据计算,该实验测得的中和热|ΔH|=________(小数点后保留1位数字)。 (5)________(填“能”或“不能”)用Ba(OH)2溶液和H2SO4溶液代替NaOH溶液和盐酸,理由是________________________________________。 (6)现将一定量的稀NaOH溶液、Ca(OH)2溶液、稀氨水分别和l L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________。 17.(12分)氢能是新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题: (1)与汽油相比,氢气作为燃料的优点是__________________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:________________________________________________________________________ ________________________________________________________________________。 (2)化工生产的副产物氢是氢气的来源之一。可通过电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-FeO+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO,镍电极附近有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4在强碱性条件下稳定存在,易被H2还原。 ①电解一段时间后,c(OH-)降低的区域在________(填“阴极室”或“阳极室”)。 ②电解过程中,需要将阴极产生的气体及时排出,其原因为____________________________。 ③c(Na2FeO4)随初始c(NaOH)的变化如图2所示,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:________________________________________________________。 (3)图3为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。 ①腐蚀过程中,负极是________(填“a”“b”或“c”)。 ②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为____________________________。 ③若生成4.29 g Cu2(OH)3Cl,则理论上消耗氧气的体积为________ L(标准状况)。 18.(12分)氮的固定及CO2的资源化利用是科学家目前研究的重要课题。 (1)请选择下表中的数据计算ΔH1和ΔH2。 物质 石墨 H2 CO CH4 燃烧热/(kJ·mol-1) 393.5 285.8 283.0 890.3 化学键 H—H C===O CO H—O C—H E/(kJ·mol-1) 436 799 1 076 465 413 CO2(g)+4H2(g)===CH4(g)+2H2O(g)的ΔH1=________ kJ·mol-1; CH4(g)+H2O(l)===3H2(g)+CO(g)的ΔH2=________ kJ·mol-1。 (2)某同学对工业合成氨反应进行了探究。回答下列问题: ①模拟工业合成氨 按如图装置实验,观察到B中的现象是________,铁触媒能加快反应速率的原因是__________________________________。 ②查阅文献,几种化学键键能数据如下: 化学键 H—H N≡N N—H E/(kJ·mol-1) 436 946 391 氨分解反应[NH3(g)N2(g)+H2(g)]的活化能Ea1=300 kJ·mol-1,由此计算合成氨反应[N2(g)+H2(g)NH3(g)]的活化能Ea2=________ kJ·mol-1。 ③一定条件下,1 mol N2与4 mol H2在密闭容器中充分反应,测得放出热量13.8 kJ,H2的转化率为________,为提高原料的利用率,工业合成氨应该采取的措施是________________________。 19.(12分)膜技术原理在化工生产中有着广泛的应用,有人设想利用电化学原理制备少量H2SO4和绿色硝化剂N2O5,制备装置如图1所示: (1)A装置是________(填“原电池”或“电解质”,下同),B装置是________________________________________________________________________。 (2)N2O5在电解池的________(填“阳极”或“阴极”)区生成,其电极反应式为________________________________________________________________________。 (3)通入O2一极的电极反应式为______________________________。 (4)若通入SO2的速率为2.24 L·min-1(标准状况),为持续稳定生产,H2SO4溶液的浓度应维持不变,则左侧水的注入速率应为________ g·min-1。 (5)电解NO可以制备NH4NO3,其工作原理如图2所示。为使电解产物全部转化为NH4NH3,需补充物质A。A是________________(填化学式),说明理由:____________________________________。 (6)电化学降解NO的原理如图3所示。若电解过程转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________ g。 20.(12分)某课外化学兴趣小组设计两组实验,探究KI的性质。 Ⅰ.探究KI与FeCl3的反应,设计方案如图1所示: (1)请用离子方程式表示上述实验现象所得的结论:__________________________________。 (2)小组成员经过讨论,认为还有必要补充做FeCl2溶液与碘水的实验,则该实验操作和相应的现象是________________________________________。 Ⅱ.为了探究KBrO3溶液与KI溶液的反应。该小组查阅资料,得知氧化性强弱顺序为BrO>IO>Br2>Fe3+,并设计如图2所示装置。电极均为碳电极,盐桥中的电解质为硫酸钾。在右池中加入100 mL 0.6 mol·L-1 KI溶液及少许淀粉溶液,左池中先加入足量的稀硫酸,再通过滴定管逐滴滴加0.1 mol·L-1 KBrO3溶液,观察到以下现象:当滴加KBrO3溶液时,电流计的指针发生偏转,同时右池中的溶液变蓝,继续滴加KBrO3溶液时,发现滴加过程中有一段时间电流计的指针不再偏转,再继续滴加,发现电流计的指针又开始发生偏转,同时右池溶液蓝色逐渐变浅。 (3)当开始滴加KBrO3溶液时,右池中的电极反应式为____________________________。 (4)在电流计指针不再发生偏转的这段时间里,滴加的KBrO3溶液的体积为________mL。 (5)当电流计的指针重新发生偏转时,左池中的电极反应式为________________________________________________________________________。 (6)利用上述电化学装置,可以进行氧化还原滴定,则反应达到滴定终点的现象是________________。称量10.0 g绿矾(FeSO4·7H2O)固体溶于水,加入到上述装置的右池中,左池中先加入适量的稀硫酸,若终点时消耗0.25 mol·L-1KBrO3溶液20.00 mL,则绿矾的质量分数为________。 单元检测7 化学反应与能量 1.D 图Ⅰ所示电池中MnO2是氧化剂,作正极,得电子,发生还原反应,A项错误;图Ⅱ所示铅蓄电池放电过程的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,放电过程中消耗H2SO4,生成H2O,使硫酸浓度减小,B项错误;图Ⅲ所示电解精炼铜的过程中,阳极粗铜中比铜活泼的金属优先失去电子,之后是铜失电子,阴极上Cu2+得电子生成Cu,因此电解质溶液中Cu2+浓度减小,C项错误;图Ⅳ所示电池工作过程中,外电路中电子由锌极流向氧化银极,D项正确。 2.D 将NaOH溶液分多次缓慢注入盐酸中,会有较多热量损失,测定的中和热数值偏小,必须一次性快速注入盐酸中,以减小热量损失,故A错误;中和热是指在稀溶液中,强酸与强碱发生中和反应生成1 mol H2O(l)和可溶性盐放出的热量,与酸、碱的元数无关,故B错误;S的燃烧热是指1 mol S固体完全燃烧生成SO2(g)放出的热量,故C错误;浓硫酸溶于水时放热,其与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ,故D正确。 3.C 根据图像可知,反应①和反应②中反应物的总能量都大于生成物的总能量,则反应①、反应②均为放热反应,故A项正确;反应①中氢气参与反应,反应产物中都是化合物,则一定存在化合价变化,反应②中反应物都是化合物,生成物中有碘单质,也一定存在化合价变化,所以反应①②均为氧化还原反应,故B项正确;反应①比反应②的速率慢,说明反应①中正反应的活化能较大,反应②中正反应的活化能较小,故C项错误;反应①、反应②总的能量变化为218 kJ·mol-1,根据盖斯定律可知,反应①、反应②的焓变之和ΔH=-218 kJ·mol-1,故D项正确。 4.A 根据图示,HS-在硫氧化菌作用下转化为SO,发生氧化反应:HS-+4H2O-8e-===SO+9H+,A项正确;电极a上发生氧化反应,电极a为负极,电子从电极a流出,经外电路流向电极b,B项错误;如果将反应物直接燃烧,有化学能转化为热能或光能,能量的利用率降低,C项错误;若该电池中有0.4 mol电子发生转移,则有0.4 mol H+通过质子交换膜,D项错误。 5.A 设S(g)===S(s) ΔH4,则ΔH4<0,由盖斯定律,得ΔH3=ΔH2-ΔH4,所以ΔH3>ΔH2,A错误;少量CO2和SO2都能与Ca(OH)2反应,且生成的CaCO3和CaSO3都是难溶于水的白色沉淀,故B正确;CO2的电子式为,分子中各原子最外层均为8电子稳定结构,C正确;①2CO(g)+O2(g)===2CO2(g) ΔH1=-566.0 kJ·mol-1,②S(g)+O2(g)===SO2(g) ΔH2=-296.0 kJ·mol-1,由盖斯定律,①-②得:2CO(g)+SO2(g)===S(g)+2CO2(g) ΔH=-270.0 kJ·mol-1,D正确。 6.C 根据放电后Na2S2转化为Na2S4,S元素化合价升高,知Na2S2被氧化,故负极反应为2Na2S2-2e-===Na2S4+2Na+,A项错误;充电时阳极上发生氧化反应,NaBr转化为NaBr3,电极反应为3NaBr-2e-===NaBr3+2Na+,B项错误;放电时,阳离子向正极移动,故Na+经过离子交换膜,由b池移向a池,C项正确;放电时,b池为负极区域,发生氧化反应2Na2S2-2e-===Na2S4+2Na+,用该电池电解饱和食盐水,产生标准状况下2.24 L H2时转移0.2 mol电子,生成0.1 mol Na2S4,其质量为17.40 g,但题中没有说明H2所处的状况,D项错误。 7.C 阴极室发生还原反应,电极反应为2H++2e-===H2↑,H+放电,破坏了水的电离,使溶液的酸碱性发生改变,且阴极室的溶液中必须加入强电解质以增强溶液的导电性,将阴极室双极膜左侧的溶液排出,不能获得淡水,A错误;盐室中的Na+向阴极移动,离子交换膜M为阳离子交换膜,使Na+进入阴极室双极膜的右侧,获得NaOH溶液。Cl-向阳极移动,离子交换膜N为阴离子交换膜,使Cl-进入阳极室双极膜的左侧,得到盐酸,B错误;若去掉双极膜,盐室中的Cl-进入阳极室,在阳极放电生成Cl2,C正确;阴、阳极的电极反应分别为2H++2e-===H2↑,4OH--4e-===O2↑+2H2O,电路中每转移1 mol电子,阴极产生0.5 mol H2,阳极产生0.25 mol O2,两极共得到0.75 mol气体,D错误。 8.D 根据甲中N极上O2转化为H2O,O2发生还原反应,知N极为正极,M极为负极,故电子的流动方向为M→Fe、Cu→N,电子不能通过电解质溶液,A项错误;根据乙二胺被氧化为无污染的物质,推知乙二胺转化为CO2、N2,故M极电极反应式为H2N(CH2)2NH2+ 4H2O-16e-===2CO2↑+N2↑+16H+,B项错误;N极上发生反应:O2+4H++4e-===2H2O,铁极上发生反应:Cu2++2e-===Cu,根据各电极上通过电荷量(或转移电子数)相等,可得关系式:O2~2Cu,当N极消耗标准状况下5.6 L O2时,铁极增加的质量为×2×64 g=32 g,但题中没有说明O2所处的状况,C项错误;乙中Cu为阳极,Fe为阴极,原理为铁上镀铜,CuSO4溶液浓度基本保持不变,D项正确。 9.B 根据盖斯定律知,ΔH3=ΔH1+ΔH2=+(302-268) kJ·mol-1=+34 kJ·mol-1;选择反应②计算键能。反应热=反应物的总键能-生成物的总键能=[364×2+331×5-(585+320×3+2a+382)] kJ·mol-1=-268 kJ·mol-1,解得a=362。 10.D 根据充电时电池总反应知,放电时负极反应式为LiaC6-ae-===6C+aLi+,正极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2,将放电时负极、正极反应式左右颠倒,即分别得到充电时阴极、阳极反应式。放电时,A是负极、B是正极,Li+向正极移动,则X是Li+,允许阳离子通过的隔膜为阳离子交换膜,A项正确;充电时,A是阴极,发生还原反应,B项正确;由上述分析可知,C项正确;根据充电时电池总反应知,充电时石墨电极发生C→LiaC6的反应,无法充电的废旧电池的石墨电极中不含有锂元素,不能回收金属锂,D项错误。 11.BD 由总反应(1-x)LiFePO4+xFePO4+LixCnLiFePO4+nC,放电时,作为原电池,LixCn为负极,失去电子,发生氧化反应,电极反应式为LixCn-xe-===xLi++nC,电子由负极由正极移动;FePO4为正极,得到电子,发生还原反应,电极反应式为xFePO4+xLi++xe-===xLiFePO4。充电时,作为电解池,LiFePO4参与阴极与阳极的反应,阳离子向阴极移动。放电时,A电极为正极,B电极为负极,负极失去电子,发生氧化反应,故A正确;放电时,根据电极反应式,导线转移1 mol电子,内电路中通过膜转移了1 mol Li+,B电极室质量减少7 g,故B错误;充电时,A为阳极,阳极失电子,发生氧化反应,A极电极反应式:xLiFePO4-xe-===xFePO4+xLi+,故C正确;充电时,作为电解池,阳离子向阴极移动,Li+从A电极室向B电极室移动,故D错误。 12.AD 1 mol C(s)完全燃烧生成CO2(g)所放出的热量大于生成CO(g)所放出的热量,则其反应热小于-110.4 kJ·mol-1,A正确;由图可知,CuO(s)的能量低于Cu2O(s)和O2(g)的能量之和,所以CuO分解生成Cu2O的反应为吸热反应,B错误;由图中数据可知,CuO(s)的能量比Cu2O(s)和O2(g)的总能量低,但无法比较CuO(s)和Cu2O(s)的能量高低,则CuO与Cu2O的稳定性也无法比较,C错误;由题干信息可知,2C(s)+O2(g)===2CO(g)的ΔH1=-220.8 kJ·mol-1,反应4CuO(s)===2Cu2O(s)+O2(g)的ΔH2=292 kJ·mol-1,则反应C(s)+2CuO(s)===Cu2O(s)+CO(g)的ΔH3=ΔH1/2+ΔH2/2=+35.6 kJ·mol-1,D正确。 13.AC 由流程可知氮气在TM-LiH催化作用下与LiH反应生成LiNH,LiNH与氢反应生成氨和LiH,发生反应:2LiNH+3H2===2LiH+2NH3。A项,状态Ⅰ为氮气生成LiNH的过程,吸收能量并存在N≡N键发生断裂,错误;B项,由流程可知氮气和氢气反应只生成氨气,原子利用率为100%,正确;C项,催化剂可降低反应的活化能,但不能降低反应物和生成物的总能量,不能改变反应焓变,错误;D项,由状态Ⅲ可知生成NH3:2LiNH+3H2===2LiH+2NH3,正确。 14.AC 电解法除氮时有效氯HClO将NH氧化为N2的离子方程式为3HClO+2NH===3Cl-+N2↑+3H2O+5H+,故A正确;随溶液pH降低,c(H+)增大,Cl2+H2OH++Cl-+HClO平衡逆向移动,溶液中c(HClO)减小,使NH的氧化率下降,则氮的去除率随pH的降低而下降,故B错误;除磷时,Fe失电子作阳极,石墨作阴极,阴极电极反应式为2H++2e-===H2↑,溶液pH会增大,图乙中20~40 min时溶液pH增大,故脱除的元素是磷元素,故C正确;由图乙中0~20 min时溶液pH减小得出脱除的元素是氮元素,此时铁作阴极,故D错误。 15.D 题图1中N型半导体为负极,P型半导体为正极,A项错误;电解质溶液中是离子定向移动而导电,没有电子的移动,B项错误;B极与外接电源负极相连,为电解池的阴极,放出的是氢气,而不是氧气,C项错误;A极为阳极,阳极上发生的是CO(NH2)2失电子生成N2的反应,则电极反应式为:CO(NH2)2-6e-+8OH-===N2↑+CO+6H2O,D项正确。 16.答案:(1)确保盐酸被完全中和 (2)保温、隔热,减少实验过程中热量的损失 (3)用环形玻璃搅拌棒轻轻搅动溶液 (4)51.8 kJ·mol-1 (5)不能 H2SO4与Ba(OH)2反应生成BaSO4沉淀,沉淀的生成热会影响中和热的测定 (6)ΔH1=ΔH2<ΔH3 解析:(1)在中和热的测定实验中为了确保反应物被完全中和,常常使加入的一种反应物稍微过量一些。(4)三次实验温度变化的平均值为3.1 ℃,ΔH=-≈-51.8(kJ·mol-1)。(5)H2SO4与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响中和热的测定,故不能用Ba(OH)2溶液和H2SO4溶液代替NaOH溶液和盐酸。(6)稀NaOH溶液和稀Ca(OH)2溶液中溶质都完全电离,它们的中和热相同,稀氨水中的溶质是弱电解质,它与盐酸的反应中NH3·H2O的电离要吸收热量,故焓变大一些。 17.答案:(1)污染小、可再生、来源广、资源丰富、燃烧热值高(任写其中2点,其他合理答案也可) H2-2e-+2OH-===2H2O (2)①阳极室 ②防止Na2FeO4与H2反应使产率降低 ③M点:c(OH-)相对较低,Na2FeO4稳定性差,且反应慢,产率较低[或N点:c(OH-)过高,铁电极上有Fe(OH)3生成,使Na2FeO4产率降低] (3)①c ②2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓ ③0.448 解析:(1)氢气相对于汽油,其主要优点有污染小、可通过水制备而再生、以水制备来源广、资源丰富、燃烧热值高等。碱性氢氧燃料电池中氢气在负极放电,电极反应为H2-2e-+2OH-===2H2O。(2)①该电解池的阳极反应为Fe-6e-+8OH-===FeO+4H2O,阴极的电极反应为2H2O+2e-===H2↑+2OH-,电解过程中阳极室消耗OH-,c(OH-)降低,阴极室消耗H+,c(OH-)增大。②由于Na2FeO4易被H2还原,若不及时排出H2,生成的H2会将FeO还原,使FeO的产率降低。③M点至最高点:由于Na2FeO4在强碱性条件下稳定存在,此时c(OH-)相对较低,生成的FeO不稳定,容易反应,且c(OH-)较低,反应速率较小,所以溶液中的c(Na2FeO4)低于最高值;最高点至N点:由于氢氧化钠溶液浓度过高会在铁电极区产生红褐色的Fe(OH)3沉淀,使Fe元素的利用率降低而导致Na2FeO4产率降低。(3)①根据图示,青铜基体发生氧化反应被腐蚀,转化为Cu2+,故c作负极。②负极上Cu被氧化生成Cu2+,正极O2被还原为OH-,环境中的Cl-扩散到孔口,与Cu2+、OH-反应,反应的离子方程式为2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓。③n[Cu2(OH)3Cl]==0.02 mol,由于负极反应为Cu-2e-===Cu2+,则反应中转移的电子的物质的量n(e-)=0.02 mol×2×2=0.08 mol。正极反应为O2+4e-+2H2O===4OH-,根据得失电子守恒,反应的氧气的物质的量n(O2)=0.02 mol,标准状况下V(O2)=0.02 mol×22.4 L/mol=0.448 L。 18.答案:(1)-170 +250.1 (2)①溶液由无色变为浅红色,有气泡逸出 降低反应的活化能 ②254 ③11.25% 循环利用未反应的N2、H2;适当增大反应体系压强 解析:(1)ΔH1=2E(C===O)+4E(H—H)-4E(C—H)-4E(H—O)=(2×799+4×436-4×413-4×465) kJ·mol-1=-170 kJ·mol-1。根据燃烧热写出如下热化学方程式:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH3=-890.3 kJ·mol-1;H2(g)+O2(g)===H2O(l) ΔH4=-285.8 kJ·mol-1;CO(g)+O2(g)===CO2(g) ΔH5=-283.0 kJ·mol-1;ΔH2=ΔH3-3ΔH4-ΔH5=(-890.3+3×285.8+283.0) kJ·mol-1=+250.1 kJ·mol-1。 (2)①氨溶于水生成一水合氨,一水合氨电离出OH-使溶液显碱性(NH3+H2ONH3·H2O,NH3·H2ONH+OH-),可观察到酚酞溶液由无色变为浅红色,氮气、氢气不溶于水,试管B中产生气泡;铁触媒能加快反应速率的原因:降低反应的活化能,从而增大活化分子百分数,增加有效碰撞次数。②氨分解反应的ΔH=3E(N-H)-E(N≡N)-E(H-H)=3×391 kJ·mol-1-×946 kJ·mol-1-×436 kJ·mol-1=+46 kJ·mol-1。ΔH等于正反应的活化能与逆反 应的活化能之差,则ΔH=Ea1-Ea2,Ea2=300 kJ·mol-1-46 kJ·mol-1=254 kJ·mol-1。 ③设H2的转化率为x,列式计算如下: N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1 3 -92 4x -13.8 =,x=11.25%。 工业合成氨为了提高原料的利用率,要采用循环操作,也就是把未反应的氮气、氢气从反应混合气中分离出来,重新送回反应器中;由于合成氨是气体体积减小的反应,为提高原料利用率,也可适当增大反应体系压强。 19.答案:(1)原电池 电解池 (2)阳极 N2O4+2HNO3-2e-===2N2O5+2H+ (3)O2+4e-+4H+===2H2O (4)13.4 (5)NH3 根据总反应8NO+7H2O3NH4NO3+2HNO3,可知反应中有HNO3生成,需要补充NH3将HNO3转化为NH4NO3(其他合理答案也可) (6)14.4 解析:(1)A装置中SO2与O2自发反应生成H2SO4,符合原电池原理,且B装置中c、d两极均为惰性电极,不符合构成原电池的条件,因此可推知A装置为原电池,用来制备H2SO4;B装置为电解池,用来制备N2O5。 (2)装置B中,N2O4被氧化生成N2O5,N2O5在阳极区即c电极生成(N2O5是硝酸的酸酐,极易和水反应,不可能在d极生成)。阳极区是无水硝酸,HNO3没有电离,溶液中不存在H+和NO,在电极反应式中应保留其化学式,所以阳极的电极反应式为N2O4+2HNO3-2e-===2N2O5+2H+。 (3)通入O2的电极为正极,O2得到电子被还原,电极反应式为O2+4e-+4H+===2H2O。 (4)A装置中通入SO2的一极发生氧化反应,电极反应式为SO2-2e-+2H2O===4H++SO,为持续稳定生产,H2SO4溶液的浓度维持不变,SO2的消耗速率为0.1 mol·min-1,消耗H2O的速率为0.2 mol·min-1,同时生成H2SO4的速率为0.1 mol·min-1,即9.8 g·min-1,所以加入水的速率为(0.2×18+9.8)g·min-1=13.4 g·min-1。 (5)方法一:电解的总反应为8NO+7H2O3NH4NO3+2HNO3,在电解过程中有HNO3产生,需要补充NH3将HNO3转化为NH4NO3; 方法二:由图示可知,阴极电极反应为NO+5e-+6H+===NH+H2O,阳极反应为NO-3e-+2H2O===NO+4H+,根据得失电子守恒可判断出:当转移的电子数目相同时,阳极产生的NO的物质的量多于阴极产生的NH的物质的量,为使电解产物全部转化为NH4NO3,需要补充NH3。 (6)右室中NO被还原生成N2,右室是阴极室,阴极电极反应为2NO+10e-+6H2O===N2↑+12OH-;阳极电极反应为2H2O-4e-===4H++O2↑。若反应中转移2 mol电子,阳极放出0.5 mol O2,同时生成的2 mol H+经质子交换膜进入电解池的右侧,则Δm左=0.5×32 g+2×1 g=18 g;阴极放出0.2 mol N2,同时有2 mol H+进入,则Δm右=0.2×28 g-2×1 g=3.6 g;故Δm左-Δm右=18 g-3.6 g=14.4 g。 20.答案:(1)2Fe3++2I-2Fe2++I2 (2)取少许FeCl2溶液于试管中,加入2~3滴KSCN溶液,无明显现象,再加入碘水,溶液变红 (3)2I--2e-===I2 (4)20.00 (5)2BrO+10e-+12H+===Br2+6H2O (6)电流计的指针不再偏转 83.4% 解析:(1)结合分组实验方案可知KI与FeCl3反应后的溶液中含有I2和Fe3+,即该反应为可逆反应,其离子方程式为2Fe3++2I-2Fe2++I2。(2)要补充做FeCl2溶液与碘水的实验,在实验时应向FeCl2溶液中加入KSCN溶液,无明显现象,滴入碘水后,看到溶液变成红色,则说明碘水能将Fe2+氧化成Fe3+,从而说明反应可逆。(3)开始滴加KBrO3 溶液时,看到右池中溶液变蓝,说明有I2生成,则右池中的电极反应式为2I--2e-===I2。(4)电流计指针不再发生偏转时,右池中I-完全被氧化为I2,根据2I--2e-===I2知转移电子的物质的量为n(e-)=n(KI)=0.1 L×0.6 mol·L-1=0.06 mol;左池中的电极反应式为BrO+6e-+6H+===Br-+3H2O,转移0.06 mol电子消耗0.01 mol KBrO3,生成0.01 mol Br-,在电流计指针不再发生偏转的这段时间内,左池中发生氧化还原反应BrO+5Br-+6H+===3Br2+3H2O,在将生成的Br-完全反应掉之前电流计指针都不发生偏转,则这段时间内加入的n(KBrO3)=n(Br-)=0.002 mol,滴加的KBrO3溶液的体积为20.00 mL。(5)电流计的指针重新发生偏转时看到右池中溶液蓝色逐渐变浅,说明右池中I2被氧化成IO,则左池中BrO在酸性条件下得电子被还原为Br2,其电极反应式为2BrO+10e-+12H+===Br2+6H2O。(6)利用该装置进行氧化还原滴定,达到滴定终点时,电流计的指针不再发生偏转。在题述装置右池中加入绿矾,结合题中已知氧化性顺序:BrO>IO>Br2>Fe3+可知,还原性:Fe2+>Br-,即BrO被还原为Br-,则装置中发生的总反应为2BrO+12Fe2++12H+===2Br-+12Fe3++6H2O,根据题中数据可求出绿矾的质量为 =8.34 g,则绿矾的质量分数为×100%=83.4%。查看更多