- 2021-07-08 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年化学人教版选修5学案:1-4-1 有机物的分离和提纯 Word版含解析
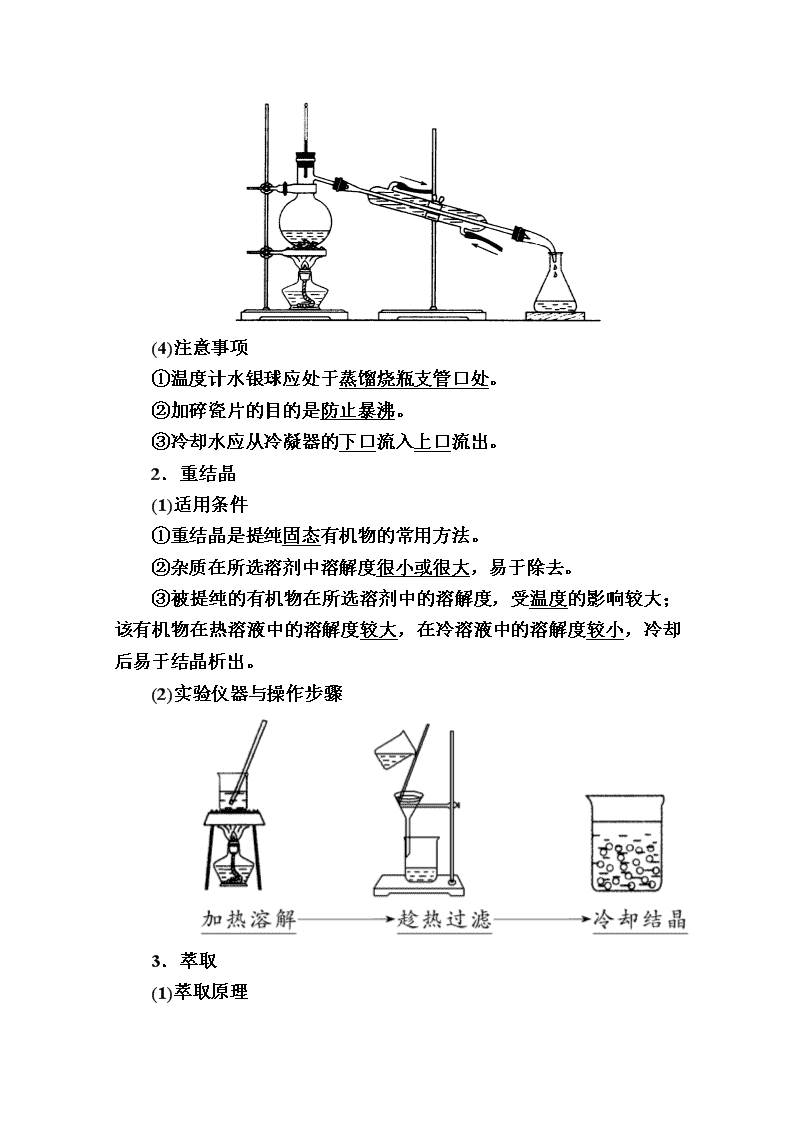
www.ks5u.com 第四节 研究有机化合物的一般步骤和方法 第1课时 有机物的分离和提纯 一、研究有机化合物的基本步骤 二、有机物的分离、提纯 1.蒸馏 (1)用途:常用于分离、提纯沸点不同的液态有机物。 (2)适用条件 ①有机物热稳定性较强; ②有机物与杂质的沸点相差较大(一般约大于30_℃)。 (3)实验装置 (4)注意事项 ①温度计水银球应处于蒸馏烧瓶支管口处。 ②加碎瓷片的目的是防止暴沸。 ③冷却水应从冷凝器的下口流入上口流出。 2.重结晶 (1)适用条件 ①重结晶是提纯固态有机物的常用方法。 ②杂质在所选溶剂中溶解度很小或很大,易于除去。 ③被提纯的有机物在所选溶剂中的溶解度,受温度的影响较大;该有机物在热溶液中的溶解度较大,在冷溶液中的溶解度较小,冷却后易于结晶析出。 (2)实验仪器与操作步骤 3.萃取 (1)萃取原理 ①液—液萃取 利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。 ②固—液萃取 用有机溶剂从固体物质中溶解出有机物的过程。 (2)仪器:分液漏斗、烧杯、铁架台。 (3)操作要求 加萃取剂后充分振荡,静置分层后,打开分液漏斗活塞,从下口将下层液体放出,并及时关闭活塞,上层液体从上口倒出。 探究点一 物质的分离和提纯 1.物质的分离和提纯的目的 (1)物质的分离:把混合物中的各种物质逐一分开,得到各纯净物,分开以后的各物质应该尽量减少损失;各组分要尽量纯净。 (2)物质的提纯:将某物质中的杂质,采用物理或化学方法除掉的过程;提纯也称除杂。它和分离的主要区别在于除掉的杂质可以不进行恢复。 2.物质的性质与分离、提纯方案的选择 (1)根据物质的溶解性差异,可选用结晶、过滤的方法将混合物分离。 (2)根据物质的沸点差异,可选用蒸馏的方法将互溶性液体混合物分离。 (3)根据物质在不同溶剂中的溶解性的差异,用萃取的方法把溶质从溶解性小的溶剂中转移到溶解性较大的溶剂中。 (4)根据混合物中各组分的性质可采用加热、调节pH、加入适当的试剂等方法,使某种成分转化,再用物理方法分离而除去。 混合物的分离与提纯,重在理解物质的性质,并根据性质考虑所采取的方法。一般应注意: ①先考虑是否能用物理方法分离与提纯,再考虑用化学方法分离与提纯。 ②认真分析被提纯物质的性质,选择的试剂应只和杂质反应,而不与主要物质反应。 3.有机物分离、提纯的常用方法 1.重结晶实验中,温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好? 提示:不是。温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的。 2.当互溶的两种液态有机物中各组分的沸点相差较小时如何处理? 提示:最好将混合物“预处理”,一般先将其中的一种物质转化为不挥发的盐类化合物,再进行蒸馏。比如乙醇中混有乙酸,可先加生石灰,将乙酸转化为乙酸钙再蒸馏。 3.冷凝管是蒸馏操作中的重要仪器。在实验操作中冷水的通入、停止与加热的先后关系是什么?冷凝管中冷却水的流向是什么? 提示:实验开始时,应先通冷却水,后点燃酒精灯。实验结束时应先熄灭酒精灯(注意不能蒸干,应在蒸馏烧瓶内还有少量液体时停止),等蒸馏烧瓶恢复至室温时停止通入冷却水。冷凝管中冷却水的流动方向一般是进水口在下,出水口在上(低口进,高口出),冷却水的流动方向与需要冷却的蒸气的方向相反,冷却效果好。 【例1】 现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表: 由此推知分离甲和乙的最佳方法是( ) A.萃取法 B.升华法 C.蒸馏法 D.分液法 【思路分析】 解答本题的依据是表格中的数据: 【解析】 这两种有机物常温下呈液态,故不能用升华法分离,B项错误;甲、乙两物质均为有机物,能够互溶,且均溶于水,所以不能用分液法和萃取法,A项和D项错误;根据表格中的沸点数据,应采用蒸馏法,C项正确。 【答案】 C 现有三组混合液体:①乙酸乙酯和乙酸钠溶液;②乙醇和己醇;③碘化钠和单质碘的水溶液。分离以上混合液的正确方法依次是( C ) A.蒸馏、萃取、分液 B.分液、萃取、蒸馏 C.分液、蒸馏、萃取 D.萃取、蒸馏、分液 解析:①因为乙酸乙酯不溶于水而CH3COONa可溶于水,所以用分液的方法分离;② 乙醇和己醇互溶,但沸点不同,故可以用蒸馏法分离;③NaI可溶于水,I2也部分溶于水,但I2更易溶于有机溶剂,所以可以用有机溶剂萃取I2。 探究点二 常见有机物的分离方法 有机物的分离方法:依据有机物的水溶性、互溶性以及酸碱性等,可选择不同的分离方法达到分离、提纯的目的。在进行分离操作时,通常根据有机物的沸点不同进行蒸馏或分馏;根据物质的溶解性不同,采取萃取、重结晶或过滤的方法。有时,也可采用水洗、酸洗或碱洗的方法进行提纯操作。常见有机物的提纯方法如下表所示(括号内为杂质)。 依据被提纯物质的性质,选择适当的物理方法和化学方法可以解决有机物的分离提纯问题。在分离和提纯时要注意以下几点:①除杂试剂需过量;②过量试剂需除尽;③除去多种杂质时要考虑加入试剂的顺序。 【例2】 下列实验中,所采取的分离方法与对应原理都正确的是( ) 【思路分析】 本题考查物质的分离提纯,意在考查学生运用有关原理解决问题的能力。 【解析】 乙醇与水互溶,不能作萃取剂,A错误。乙酸乙酯与乙醇互溶,不能用分液的方法分离,B错误。除去硝酸钾中的氯化钠可用重结晶的方法,是由于氯化钠在水中的溶解度受温度变化的影响较小,故C错误。乙醚和丁醇互溶,但沸点差别较大,可用蒸馏的方法进行分离,D正确。 【答案】 D 除去下列物质内所含的杂质(括号内的物质),所选用的试剂不正确的是( A ) A.乙酸(苯甲酸):NaOH溶液 B.甲烷(乙烯):溴水 C.苯(苯甲酸):NaOH溶液 D.乙炔(硫化氢):亚硫酸钠酸性溶液 解析:A项,乙酸和苯甲酸都能与NaOH反应而溶于该溶液,因此A错误;B项,可以通过溴水,乙烯与溴水发生加成反应,从而除去了乙烯;C项,苯甲酸溶于NaOH溶液而除去;D项,通过亚硫酸钠酸性溶液,硫化氢与亚硫酸钠反应生成了硫,从而除去。 1.下列各组液体混合物,可以用分液漏斗分离的是( B ) A.乙醇和水 B.溴乙烷和水 C.溴乙烷和氯仿 D.苯和溴苯 解析:可用分液漏斗分离的液体应互不相溶,A、C、D三项中的两种物体可以互溶,B项中的两种物质互不相溶,可用分液漏斗分离。 2.将CH3CHO(易溶于水,沸点为20.8 ℃的易挥发性液体)和CH3COOH分离的最佳方法是( C ) A.加热蒸馏 B.加入Na2CO3后,通过萃取的方法分离 C.加入烧碱溶液之后蒸出乙醛,再加入浓硫酸,蒸出乙酸 D.和Na反应后进行分离 解析:尽管乙醛沸点仅为20.8 ℃,而乙酸沸点为117.9 ℃,但考虑到两者均易挥发,因此C选项的方法分离效果更好。 3.下列有关苯甲酸重结晶实验的说法错误的是( A ) A.溶解粗苯甲酸的过程中,加热、玻璃棒搅拌均能提高苯甲酸的溶解度 B.苯甲酸溶解时,若加水加热后仍有不溶物,说明该不溶物是不溶性杂质 C.过滤时,趁热过滤可防止苯甲酸晶体提前析出 D.冷却结晶时,温度过低杂质将析出,故此时温度不是越低越好 解析:加热能提高苯甲酸的溶解速率,也能提高苯甲酸的溶解度,但搅拌只能提高溶解速率,不能改变溶解度。 4.下列除去括号内杂质的有关操作方法正确的是( B ) ①CO2(SO2):饱和NaHCO3溶液,洗气 ②KCl(AlCl3):氨水,过滤 ③乙酸乙酯(乙酸):乙醇和浓硫酸 ④水(碘):酒精,萃取分液 ⑤苯(甲苯):分馏 A.①②③ B.①⑤ C.②④ D.③④⑤ 5.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。 下列说法错误的是( C ) A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗 C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置 解析:步骤(1)的操作应为过滤,需要过滤装置;步骤(2)分液得到水层和有机层,需用到分液漏斗;步骤(3)的操作应为蒸发结晶,需用蒸发皿而不是坩埚;步骤(4)从有机层中分离出甲苯需用蒸馏的方法。 6.以下实验能获得成功的是( D ) A.用KMnO4酸性溶液鉴别乙烯和乙醇 B.将乙烷与溴水混合光照制溴乙烷 C.苯和硝基苯的混合物采用分液的方法分离 D.可用CCl4萃取碘水中的碘 解析:乙烯和乙醇均能使高锰酸钾酸性溶液褪色,无法鉴别二者,A错。应用乙烯和HBr加成制备溴乙烷,B错。苯和硝基苯互溶,不能直接分液,C错。 7.选择下列实验方法分离物质,将分离提纯方法的序号填在横线上。 A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气 (1)F分离饱和食盐水与沙子的混合物; (2)CF从硝酸钾和氯化钠的混合溶液中获得硝酸钾; (3)D分离水和汽油的混合物; (4)E分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。 (5)G除去混在乙烷中的乙烯。 (6)A提取碘水中的碘。 解析:沙子不溶于食盐水,采用过滤的方法即可分离;硝酸钾在水中的溶解度随温度升高明显增大而NaCl在水中的溶解度受温度影响不大,采用重结晶法和过滤可将其分离;水和汽油互不相溶,分层,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点差大于30 ℃,可用蒸馏法分离;乙烯中含双键,可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取分液方法提取。 8.现拟分离乙酸乙酯、乙酸、乙醇的混合物,下面是分离操作步骤流程图。图中圆括号内表示需要加入的适当试剂,方括号内表示适当的分离方法,方框内的字母表示所分离的有关物质(主要物质)的名称。请根据图示,回答下列问题。 已知:各物质的沸点:乙酸乙酯77.1 ℃,乙醇78.5 ℃,乙酸118 ℃。 (1)分离方法:①是分液,②是蒸馏,③是蒸馏。 (2)试剂a是饱和Na2CO3溶液,试剂b是硫酸。 (3)分离的物质:A是乙酸乙酯,B是CH3CH2OH、CH3COONa,C是CH3COONa,D是CH3COOH,E是CH3CH2OH。 解析:三者为互溶的液体,乙酸乙酯不溶于水,乙酸和乙醇均易溶于水,故可先用饱和Na2CO3溶液分离出乙酸乙酯;乙醇 、乙酸的沸点相差不大且极易溶于水,故可把乙酸转化为盐类,而后利用蒸馏法得到乙醇,最后将乙酸盐再转化为乙酸,蒸馏即得。查看更多