- 2021-07-08 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习(山西专用版)物质的量浓度及其溶液配制作业
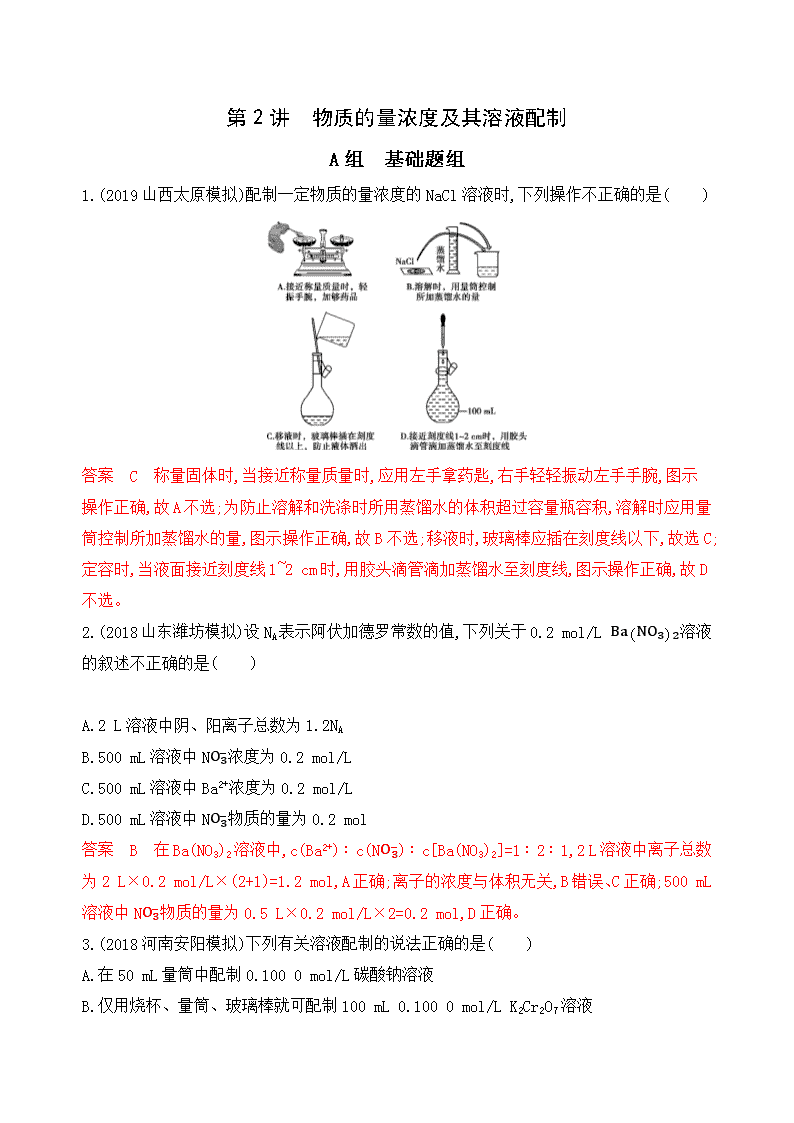
第2讲 物质的量浓度及其溶液配制 A组 基础题组 1.(2019山西太原模拟)配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( ) 答案 C 称量固体时,当接近称量质量时,应用左手拿药匙,右手轻轻振动左手手腕,图示操作正确,故A不选;为防止溶解和洗涤时所用蒸馏水的体积超过容量瓶容积,溶解时应用量筒控制所加蒸馏水的量,图示操作正确,故B不选;移液时,玻璃棒应插在刻度线以下,故选C;定容时,当液面接近刻度线1~2 cm时,用胶头滴管滴加蒸馏水至刻度线,图示操作正确,故D不选。 2.(2018山东潍坊模拟)设NA表示阿伏加德罗常数的值,下列关于0.2 mol/L Ba(NO3)2溶液的叙述不正确的是( ) A.2 L溶液中阴、阳离子总数为1.2NA B.500 mL溶液中NO3-浓度为0.2 mol/L C.500 mL溶液中Ba2+浓度为0.2 mol/L D.500 mL溶液中NO3-物质的量为0.2 mol 答案 B 在Ba(NO3)2溶液中,c(Ba2+)∶c(NO3-)∶c[Ba(NO3)2]=1∶2∶1,2 L溶液中离子总数为2 L×0.2 mol/L×(2+1)=1.2 mol,A正确;离子的浓度与体积无关,B错误、C正确;500 mL溶液中NO3-物质的量为0.5 L×0.2 mol/L×2=0.2 mol,D正确。 3.(2018河南安阳模拟)下列有关溶液配制的说法正确的是( ) A.在50 mL量筒中配制0.100 0 mol/L碳酸钠溶液 B.仅用烧杯、量筒、玻璃棒就可配制100 mL 0.100 0 mol/L K2Cr2O7溶液 C.用100 mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100 mL pH=2的盐酸 D.配制溶液时,若加水超过容量瓶刻度线,应用胶头滴管将多余液体吸出 答案 C 配制一定物质的量浓度的溶液,应在容量瓶中进行,选项A、B错误;配制溶液定容时,若加水超过容量瓶刻度线,必须重新配制,D错误。 4.如图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a等于( ) A.2 B.3 C.4 D.5 答案 C 据稀释定律:c1V1=c2V2可得,2 mol·L-1×1 L=0.5 mol·L-1×a L,解得a=4。 5.某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,则300 mL该溶液中Cl-的物质的量等于( ) A.0.37 mol B.0.63 mol C.0.74 mol D.1.50 mol 答案 D 300 mL该氯化镁溶液的质量为1.18 g·cm-3×300 mL=354 g,镁离子的物质的量为354 g×5.1%24 g·mol-1≈0.75 mol,氯化镁溶液中n(Cl-)=2n(Mg2+)=2×0.75 mol=1.50 mol,故选D。 6.在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,质量分数为ω,其中含有NH4+的物质的量是b mol,下列叙述中正确的是( ) A.溶质的质量分数ω=aρV-a×100% B.溶质的物质的量浓度c=1 000a35V mol·L-1 C.溶液中c(OH-)=1 000bV mol·L-1+c(H+) D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5ω 答案 C A项,溶质的质量分数ω=aρV×100%;B项,氨水中的溶质在计算时以NH3为准,将ω=aρV×100%代入公式c=1 000ρωM,可得c=1 000a17V mol·L-1;C项,氨水中含有的阳离子为H+和NH4+,含有的阴离子只有OH-,结合电荷守恒可知溶液中c(OH-)=1 000bV mol·L-1+c(H+);D项,由于氨水的密度小于水的密度,与水等体积混合所得溶液的质量大于原氨水质量的2倍,故其质量分数小于0.5ω。 7.有Al2(SO4)3和Na2SO4的混合溶液V L,将它均分成两份。一份滴加氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO42-完全沉淀。反应中消耗a mol NH3·H2O、b mol BaCl2。据此得知原混合溶液中的c(Na+)(mol·L-1)为( ) A.(4b-2a)/V B.(2b-2a)/V C.(2b-a)/V D.(b-2a)/V 答案 A 根据题意可知每份溶液中Al3+的物质的量为a3 mol,SO42-的物质的量为b mol,设每份溶液中Na+的物质的量为x mol,则b=32×a3+x2,x=2b-a,原混合溶液中的c(Na+)=(4b-2a)/V mol·L-1。 8.把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( ) A.(b10-a20)mol·L-1 B.(2b-a)mol·L-1 C.(5b-5a2)mol·L-1 D.(10b-5a)mol·L-1 答案 D 设100 mL溶液中含有NH4HCO3、Na2CO3的物质的量分别为x、y,NH4HCO3和Na2CO3的混合溶液中加入含a mol NaOH的溶液,反应为NH4HCO3+2NaOH NH3·H2O+Na2CO3+H2O,则NH4HCO3为0.5a mol;加入含b mol HCl的盐酸发生的反应为NH4HCO3+HCl NH4Cl+CO2↑+H2O、Na2CO3+2HCl 2NaCl+H2O+CO2↑,则Na2CO3的物质的量为12(b-0.5a)mol,n(Na+)=2n(Na2CO3)=(b-0.5a)mol,c(Na+)=(b-0.5a)mol0.1 L=(10b-5a)mol·L-1。 9.(2018湖北荆州第一次质量检查)将一定质量的铁粉和铝粉的均匀混合物平均分成两份。一份与足量的稀硫酸反应,收集到H2在标准状况下的体积为1.792 L;另一份与某浓度的硝酸反应,生成的气体与标准状况下1.12 L的O2一起通入水中,反应后无气体剩余。则原混合物中铁粉的质量为( ) A.2.24 g B.3.36 g C.4.48 g D.5.60 g 答案 C 根据得失电子守恒有2n(Fe)+3n(Al)=1.792 L22.4 L·mol-1×2,与某浓度的硝酸反应,产生的气体,再与标准状况下1.12 L的O2一起通入水中,反应后无气体剩余,氧气得到的电子最终来自Fe和Al,因此有3n(Fe)+3n(Al)=1.12 L22.4 L·mol-1×4,解得n(Fe)=0.04 mol,混合物均匀分成两份,则混合物中铁质量为2×0.04×56 g=4.48 g,C项正确。 10.有9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2.24 L。将溶液稀释为1 L,测得溶液的pH=1,此时溶液中NO3-的浓度为( ) A.0.3 mol·L-1 B.0.4 mol·L-1 C.0.5 mol·L-1 D.0.6 mol·L-1 答案 B NO气体是Cu和Zn的合金还原HNO3得到的,在这个过程中,金属失去的电子跟HNO3得到电子数相等,在这个过程中金属失去0.3 mol的电子,又由于都是二价金属,所以跟Cu2+和Zn2+结合的NO3-的物质的量也为0.3 mol。再加上溶液中的0.1 mol的硝酸,总共是0.4 mol的NO3-,又因为溶液的体积为1 L,即B正确。 11.298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。 (1)制备20.0 mL 0.10 mol·L-1的氨水,需向水中通入NH3的体积为 L(标准状况)。 (2)假设0.10 mol·L-1氨水的密度为0.95 g·cm-3,则该氨水的溶质质量分数约为 。 (3)使氨水恰好完全反应需盐酸的体积为 mL。 (4)配制250 mL 0.10 mol·L-1的氨水,需5.0 mol·L-1的氨水 mL,配制时需要的仪器有 ,配制过程中俯视刻度线定容,所配溶液浓度 (填“偏大”“偏小”或“不变”)。 答案 (1)0.044 8 (2)0.18% (3)20.0 (4)5.0 量筒、烧杯、玻璃棒、250 mL容量瓶、胶头滴管 偏大 解析 (1)溶液中n(NH3)=0.10 mol·L-1×0.020 0 L=0.002 0 mol,V(NH3)=0.002 0 mol×22.4 L·mol-1=0.044 8 L。(2)根据公式c=1 000ρωM,则ω=cM1 000ρ=0.10mol·L-1×17 g·mol-11 000 cm3·L-1×0.95 g·cm-3=0.18%。(3)使氨水完全反应,n(HCl)=n(NH3),则盐酸体积为20.0 mL。(4)根据稀释过程溶质的物质的量不变,则0.10 mol·L-1×0.25 L=5.0 mol·L-1×V,V=0.005 0 L=5.0 mL。定容时俯视刻度线,会使溶液的体积偏小,浓度偏大。 12.在0.4 L由NaCl、MgCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。 (1)该混合液中,NaCl的物质的量为 mol,含溶质MgCl2的质量为 g。 (2)该混合液中CaCl2的物质的量为 mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为 mol·L-1。 (3)向该稀释后的溶液中加入足量硝酸化的硝酸银溶液,可得到沉淀 mol。 答案 (1)0.4 19 (2)0.2 0.2 (3)1.2 解析 由图可知c(Na+)=c(NaCl)=1.0 mol·L-1。c(Mg2+)=c(MgCl2)=0.5 mol·L-1,则c(CaCl2)=3mol·L-1-1.0 mol·L-1-0.5 mol·L-1×22=0.5 mol·L-1。 (1)n(NaCl)=1.0 mol·L-1×0.4 L=0.4 mol m(MgCl2)=0.5 mol·L-1×0.4 L×95 g·L-1=19 g (2)n(CaCl2)=0.5 mol·L-1×0.4 L=0.2 mol c(Ca2+)=0.2mol1 L=0.2 mol·L-1 (3)原溶液中n(Cl-)=3 mol·L-1×0.4 L=1.2 mol 由反应Ag++Cl- AgCl↓可知,生成AgCl沉淀1.2 mol。 13.(2019河南安阳期末)“84”消毒液能有效杀灭甲型H1N1等病毒,某同学购买了一瓶“威露士”牌“84”消毒液,并查阅相关资料和消毒液包装说明得到如下信息;含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释后使用。 请根据信息和相关知识回答下列问题: (1)该“84”消毒液的物质的量浓度为 mol·L-1。 (2)该同学取100 mL该“84”消毒液,加入10 000 mL水进行稀释,稀释后的溶液中c(Na+)= mol·L-1。(假设稀释后溶液密度为1.0 g·cm-3) (3)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是 。 A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 C.利用购买的商品NaClO来配制可能导致结果偏低 D.需要称量的NaClO固体质量为143.0 g 答案 (1)4.0 (2)0.04 (3)C 解析 (1)c(NaClO)=1 000 mL×1.19 g·cm-3×25%74.5 g·mol-1×1 L=4.0 mol·L-1。 (2)根据稀释前溶质的物质的量不变,则100 mL×4.0 mol·L-1=1.19 g·cm-3×100 mL+1.0 g·cm-3×10 000 mL1.0 g·cm-3×c(NaClO),解得c(NaClO)≈0.04 mol·L-1,故稀释后的溶液中c(Na+)=c(NaClO)≈0.04 mol·L-1。(3)配制480 mL含25% NaClO的消毒液时,用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、500 mL容量瓶、胶头滴管,故题图中①~④四种仪器不需要,但还需量筒、玻璃棒和胶头滴管,A项错误;容量瓶不能烘干,容量瓶用蒸馏水洗净后,可以直接使用,不用干燥,B项错误;由于NaClO易变质,所以商品NaClO可能部分变质导致NaClO的物质的量减小,从而使结果偏低,C项正确;配制480 mL该“84”消毒液,应选取500 mL的容量瓶,所以需要称量的NaClO固体的质量为0.5 L×4.0 mol·L-1×74.5 g·mol-1=149.0 g,D项错误。 B组 提升题组 14.16 mL由NO与NH3组成的混合气体在催化剂作用下于400 ℃左右可发生反应:6NO+4NH3 5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5 mL,则原混合气体中NO与NH3的体积之比有四种情况:①5∶3、②3∶2、③4∶3、④9∶7。其中正确的是( ) A.①② B.①④ C.②③ D.③④ 答案 C 根据反应前后气体的总体积,可用差量法直接求解。 6NO+4NH3 5N2+6H2O(g) ΔV 6 4 5 6 1 9 mL 6 mL 17.5 mL-16 mL=1.5 mL 由此可知共消耗15 mL气体,还剩余1 mL气体,假设剩余的气体全部是NO,则V(NO)∶V(NH3)=(9 mL+1 mL)∶6 mL=5∶3;假设剩余的气体全部是NH3,则V(NO)∶V(NH3)=9 mL∶(6 mL+1 mL)=9∶7,但因该反应是可逆反应,剩余气体实际上是NO、NH3的混合气体,故V(NO)∶V(NH3)介于9∶7与5∶3之间,对照所给的数据知3∶2与4∶3在此区间内。 15.有三种镁铝合金样品(组分比例不一定相同)Ⅰ、Ⅱ、Ⅲ。三位同学各取一种样品,对合金中镁的质量分数进下列实验探究: (1)第一位同学取样品Ⅰ m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体的质量仍为m1 g。则合金中镁的质量分数为 (保留小数点后2位)。 (2)第二位同学取样品Ⅱ m2 g和足量的稀硫酸反应,发现固体完全溶解,并得到标准状况下气体的体积为V L,则m2的取值范围是 (结果化为最简分数)。 (3)第三位同学取不同质量的样品Ⅲ分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如表所示: 实验序号 a b c 合金质量/g 0.51 0.765 0.918 气体体积/mL 560 672 672 ①盐酸的物质的量浓度为 。 ②合金中镁的质量分数为 。 ③要使c组实验后剩余合金中的铝恰好完全溶解,还需向容器中加入1.0 mol·L-1的氢氧化钠溶液 mL。 答案 (1)47.06% (2)45V56查看更多
相关文章
- 当前文档收益归属上传用户