- 2021-07-08 发布 |
- 37.5 KB |
- 22页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习盖斯定律的应用课件(22张)
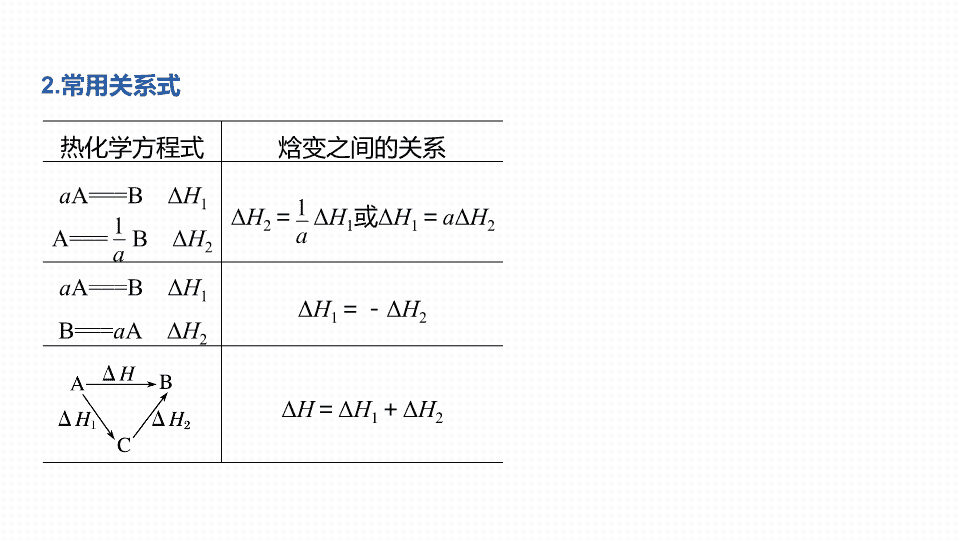
盖斯定律的应用 专题 五 大题 题 空逐空突破 ( 六 ) 高考必备 1 1. 定律内容 一定条件下,一个反应不管是一步完成,还是分几步完成,反应的总热效应相同,即反应热的大小与反应途径无关,只与反应的始态和终态有关。 热化学方程式 焓变之间的关系 a A == =B Δ H 1 A == = B Δ H 2 Δ H 2 = Δ H 1 或 Δ H 1 = a Δ H 2 a A == =B Δ H 1 B == = a A Δ H 2 Δ H 1 =- Δ H 2 Δ H = Δ H 1 + Δ H 2 2. 常用关系式 3. 答题模板 —— 叠加法 步骤 1 “ 倒 ” 为了将方程式相加得到目标方程式,可将方程式颠倒过来,反应热的数值不变,但符号相反。这样,就不用再做减法运算了,实践证明,方程式相减时往往容易出错。 步骤 2 “ 乘 ” 为了将方程式相加得到目标方程式,可将方程式乘以某个倍数,反应热也要相乘。 步骤 3 “ 加 ” 上面的两个步骤做好了,只要将方程式相加即可得目标方程式,反应热也要相加。 1. [2019· 全国卷 Ⅱ , 27(1)] 环戊二烯 ( ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题: 已知: (g) == = (g) + H 2 (g) Δ H 1 = 100.3 kJ·mol - 1 ① H 2 (g) + I 2 (g) == =2HI(g) Δ H 2 =- 11.0 kJ·mol - 1 ② 对于反应: (g) + I 2 (g) == = (g) + 2HI(g) ③ Δ H 3 = _____kJ·mol - 1 。 真题演练 2 1 2 3 4 89.3 解析 将题给三个热化学方程式依次编号为 ① 、 ② 、 ③ ,根据盖斯定律,由反应 ① +反应 ② 得反应 ③ ,则 Δ H 3 = Δ H 1 + Δ H 2 = (100.3 - 11.0)kJ·mol - 1 = 89.3 kJ·mol - 1 。 2. [2019· 全国卷 Ⅲ , 28(2)] Deacon 直接氧化法可按下列催化过程进行: 1 2 3 4 CuO(s) + 2HCl(g) == =CuCl 2 (s) + H 2 O(g) Δ H 3 =- 121 kJ·mol - 1 则 4HCl(g) + O 2 (g) == =2Cl 2 (g) + 2H 2 O(g) 的 Δ H = _____kJ·mol - 1 。 - 116 解析 将已知热化学方程式依次编号为 ① 、 ② 、 ③ ,根据盖斯定律,由 ( ① + ② + ③ ) × 2 得 4HCl(g) + O 2 (g) == =2Cl 2 (g) + 2H 2 O(g) Δ H =- 116 kJ·mol - 1 。 3.(1) [2018· 北京, 27(1)] 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下: 1 2 3 4 反应 Ⅰ : 2H 2 SO 4 (l) == =2SO 2 (g) + 2H 2 O(g) + O 2 (g) Δ H 1 =+ 551 kJ·mol - 1 反应 Ⅲ : S(s) + O 2 (g) == =SO 2 (g) Δ H 3 =- 297 kJ·mol - 1 反应 Ⅱ 的热化学方程式: ___________________________________________________ 。 3SO 2 (g) + 2H 2 O(g)===2H 2 SO 4 (l) + S(s) Δ H 2 =- 254 kJ·mol - 1 解析 由题图可知,反应 Ⅱ 的化学方程式为 3SO 2 + 2H 2 O 2H 2 SO 4 + S ↓ 。根据盖斯定律,反应 Ⅱ =- ( 反应 Ⅰ +反应 Ⅲ ) 可得: 3SO 2 (g) + 2H 2 O(g)===2H 2 SO 4 (l) + S(s) Δ H 2 =- 254 kJ·mol - 1 。 1 2 3 4 (2) [2018· 江苏, 20(1)] 用水吸收 NO x 的相关热化学方程式如下: 2NO 2 (g) + H 2 O(l) == =HNO 3 (aq) + HNO 2 (aq) Δ H =- 116.1 kJ·mol - 1 3HNO 2 (aq) == =HNO 3 (aq) + 2NO(g) + H 2 O(l) Δ H = 75.9 kJ·mol - 1 反应 3NO 2 (g) + H 2 O(l) == =2HNO 3 (aq) + NO(g) 的 Δ H = ________kJ·mol - 1 。 - 136.2 解析 将题给三个热化学方程式依次编号为 ① 、 ② 和 ③ ,根据盖斯定律可知, ③ = ( ①× 3 + ② ) /2 ,则 Δ H = ( - 116.1 kJ·mol - 1 × 3 + 75.9 kJ·mol - 1 )/ 2 =- 136.2 kJ·mol - 1 。 1 2 3 4 (3) [2018· 全国卷 Ⅰ , 28(2) ① ] 已知: 2N 2 O 5 (g)===2N 2 O 4 (g) + O 2 (g) Δ H 1 =- 4.4 kJ·mol - 1 2NO 2 (g) == =N 2 O 4 (g) Δ H 2 =- 55.3 kJ·mol - 1 + 53.1 解析 令 2N 2 O 5 (g) == =2N 2 O 4 (g) + O 2 (g) Δ H 1 =- 4.4 kJ·mol - 1 a 2NO 2 (g) == =N 2 O 4 (g) Δ H 2 =- 55.3 kJ·mol - 1 b 1 2 3 4 (4) [2018· 全国卷 Ⅲ , 28(2)] SiHCl 3 在催化剂作用下发生反应: 2SiHCl 3 (g) == =SiH 2 Cl 2 (g) + SiCl 4 (g) Δ H 1 = 48 kJ·mol - 1 3SiH 2 Cl 2 (g) == =SiH 4 (g) + 2SiHCl 3 (g) Δ H 2 =- 30 kJ·mol - 1 则反应 4SiHCl 3 (g) == =SiH 4 (g) + 3SiCl 4 (g) 的 Δ H 为 _____kJ·mol - 1 。 114 解析 将题给两个热化学方程式依次编号为 ① 、 ② ,根据盖斯定律,由 ①× 3 + ② 可得: 4SiHCl 3 (g) == =SiH 4 (g) + 3SiCl 4 (g) , 则有 Δ H = 3Δ H 1 + Δ H 2 = 3 × 48 kJ·mol - 1 + ( - 30 kJ·mol - 1 ) = 114 kJ·mol - 1 。 1 2 3 4 (5) [2018· 全国卷 Ⅱ , 27(1) 节选 ] CH 4 —CO 2 催化重整反应为 CH 4 (g) + CO 2 (g) == =2CO(g) + 2H 2 (g) 。 已知: C(s) + 2H 2 (g) == =CH 4 (g) Δ H =- 75 kJ·mol - 1 C(s) + O 2 (g) == =CO 2 (g) Δ H =- 394 kJ·mol - 1 该催化重整反应的 Δ H = ______kJ·mol - 1 。 + 247 1 2 3 4 解析 将题给三个反应依次编号为 ① 、 ② 、 ③ : C(s) + 2H 2 (g) == =CH 4 (g) Δ H =- 75 kJ·mol - 1 ① C(s) + O 2 (g) == =CO 2 (g) Δ H =- 394 kJ·mol - 1 ② 根据盖斯定律,由 ③× 2 - ① - ② 可得: CH 4 (g) + CO 2 (g) == =2CO(g) + 2H 2 (g) Δ H =+ 247 kJ·mol - 1 。 4. 按要求回答下列问题 1 2 3 4 则反应 As 2 O 5 (s) + 3H 2 O(l) == =2H 3 AsO 4 (s) 的 Δ H = _________________ 。 2Δ H 1 - 3Δ H 2 - Δ H 3 解析 令题干中三个热化学方程式分别为: ① 、 ② 、 ③ ,由盖斯定律可知 ①× 2 - ②× 3 - ③ 可得所求反应,故 Δ H = 2Δ H 1 - 3Δ H 2 - Δ H 3 。 (2) [2017· 全国卷 Ⅰ , 28(2)] 下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 1 2 3 4 通过计算,可知系统 ( Ⅰ ) 和系统 ( Ⅱ ) 制氢的热化学方程式分别为 __________________ ________________________ 、 ____________________________________ ,制得等量 H 2 所需能量较少的是 ________ 。 H 2 O(l) == =H 2 (g) + H 2 S (g) == =H 2 (g) + S(s) Δ H = 20 kJ·mol - 1 系统 ( Ⅱ ) 1 2 3 4 解析 令题干中的四个热化学方程式分别为 ② SO 2 (g) + I 2 (s) + 2H 2 O(l) == =2HI(aq) + H 2 SO 4 (aq) Δ H 2 =- 151 kJ·mol - 1 ③ 2HI(aq) == =H 2 (g) + I 2 (s) Δ H 3 = 110 kJ·mol - 1 ④ H 2 S(g) + H 2 SO 4 (aq) == =S(s) + SO 2 (g) + 2H 2 O(l) Δ H 4 = 61 kJ·mol - 1 根据盖斯定律,将 ① + ② + ③ 可得,系统 ( Ⅰ ) 中的热化学方程式: 1 2 3 4 同理,将 ② + ③ + ④ 可得,系统 ( Ⅱ ) 中的热化学方程式: H 2 S(g)===H 2 (g) + S(s) Δ H = Δ H 2 + Δ H 3 + Δ H 4 =- 151 kJ·mol - 1 + 110 kJ·mol - 1 + 61 kJ·mol - 1 = 20 kJ·mol - 1 由所得两热化学方程式可知,制得等量 H 2 所需能量较少的是系统 ( Ⅱ ) 。 (3) [2016· 全国卷 Ⅱ , 26(3)] ① 2O 2 (g) + N 2 (g) == =N 2 O 4 (l) Δ H 1 ② N 2 (g) + 2H 2 (g) == =N 2 H 4 (l) Δ H 2 ③ O 2 (g) + 2H 2 (g) == =2H 2 O(g) Δ H 3 ④ 2N 2 H 4 (l) + N 2 O 4 (l) == =3N 2 (g) + 4H 2 O(g) Δ H 4 =- 1 048.9 kJ·mol - 1 上述反应热效应之间的关系式为 Δ H 4 = _________________ , 联氨和 N 2 O 4 可作为火箭推进剂的主要原因为 _____________________________ 。 1 2 3 4 解析 对照目标热化学方程式中的反应物和生成物在已知热化学方程式中的位置和化学计量数,利用盖斯定律,故 Δ H 4 = 2Δ H 3 - 2Δ H 2 - Δ H 1 ; 联氨有强还原性, N 2 O 4 具有强氧化性,两者混合在一起易自发地发生氧化还原反应,反应放热量大并产生大量的气体,可为火箭提供很大的推进力。 2Δ H 3 - 2Δ H 2 - Δ H 1 反应放热量大、产生大量的气体 (4) [2017· 海南, 14(2) 节选 ] 已知: ① 2NaOH(s) + CO 2 (g)===Na 2 CO 3 (s) + H 2 O(g) Δ H 1 =- 127.4 kJ·mol - 1 ② NaOH(s) + CO 2 (g) == =NaHCO 3 (s) Δ H 2 =- 131.5 kJ·mol - 1 反应 2NaHCO 3 (s) == =Na 2 CO 3 (s) + H 2 O(g) + CO 2 (g) 的 Δ H = _______kJ·mol - 1 。 1 2 3 4 解析 ① - 2 ×② 得到: 2NaHCO 3 (s)===Na 2 CO 3 (s) + CO 2 (g) + H 2 O(g) Δ H = ( - 127.4 + 2 × 131.5) kJ·mol - 1 =+ 135.6 kJ·mol - 1 。 + 135.6 1. 已知: H 2 (g) 、 CH 3 OH(l) 的燃烧热 (Δ H ) 分别为- 285.8 kJ·mol - 1 和- 726.5 kJ·mol - 1 ; CH 3 OH (l) == =CH 3 OH (g) Δ H =+ 35.2 kJ·mol - 1 ; H 2 O(l) == =H 2 O(g) Δ H =+ 44 kJ·mol - 1 。 则 CO 2 (g) + 3H 2 (g) CH 3 OH(g) + H 2 O(g) Δ H = ______kJ·mol - 1 。 模拟预测 3 1 2 3 - 51.7 1 2 3 ③ CH 3 OH(l) == =CH 3 OH(g) Δ H =+ 35.2 kJ·mol - 1 ; ④ H 2 O(l) == =H 2 O(g) Δ H =+ 44 kJ·mol - 1 。 将得 ①× 3 - ② + ③ + ④ ,得 CO 2 (g) + 3H 2 (g) CH 3 OH(g) + H 2 O(g) 的 Δ H =- 51.7 kJ·mol - 1 。 2. 用 NaOH 溶液吸收热电企业产生的废气时,涉及如下转化,由下图关系可得: Δ H 4 = _______________ 。 1 2 3 Δ H 1 + Δ H 2 - Δ H 3 解析 根据盖斯定律分析,反应的能量变化取决于反应物和生成物,与过程无关,所以根据图分析,有 Δ H 1 + Δ H 2 = Δ H 3 + Δ H 4 ,可以计算 Δ H 4 = Δ H 1 + Δ H 2 - Δ H 3 。 3.CH 4 催化还原 NO 、 NO 2 的热化学方程式如下: 1 2 3 序号 热化学方程式 ① 4NO 2 (g) + CH 4 (g) 4NO(g) + CO 2 (g) + 2H 2 O (g) Δ H =- 574 kJ·mol - 1 ② 4NO(g) + CH 4 (g) 2N 2 (g) + CO 2 (g) + 2H 2 O (g) Δ H =- 1 160 kJ·mol - 1 则 4NO(g) N 2 (g) + 2NO 2 (g) 的 Δ H = ______________ 。 - 293 kJ·mol - 1查看更多